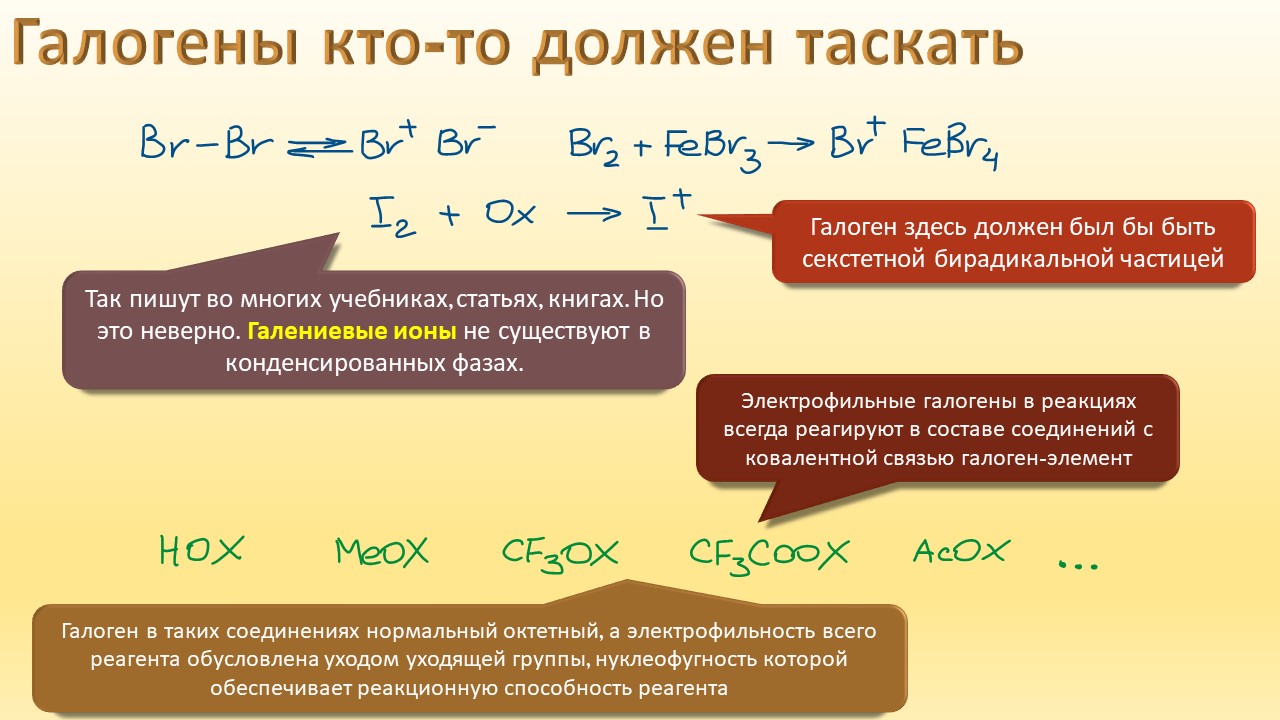
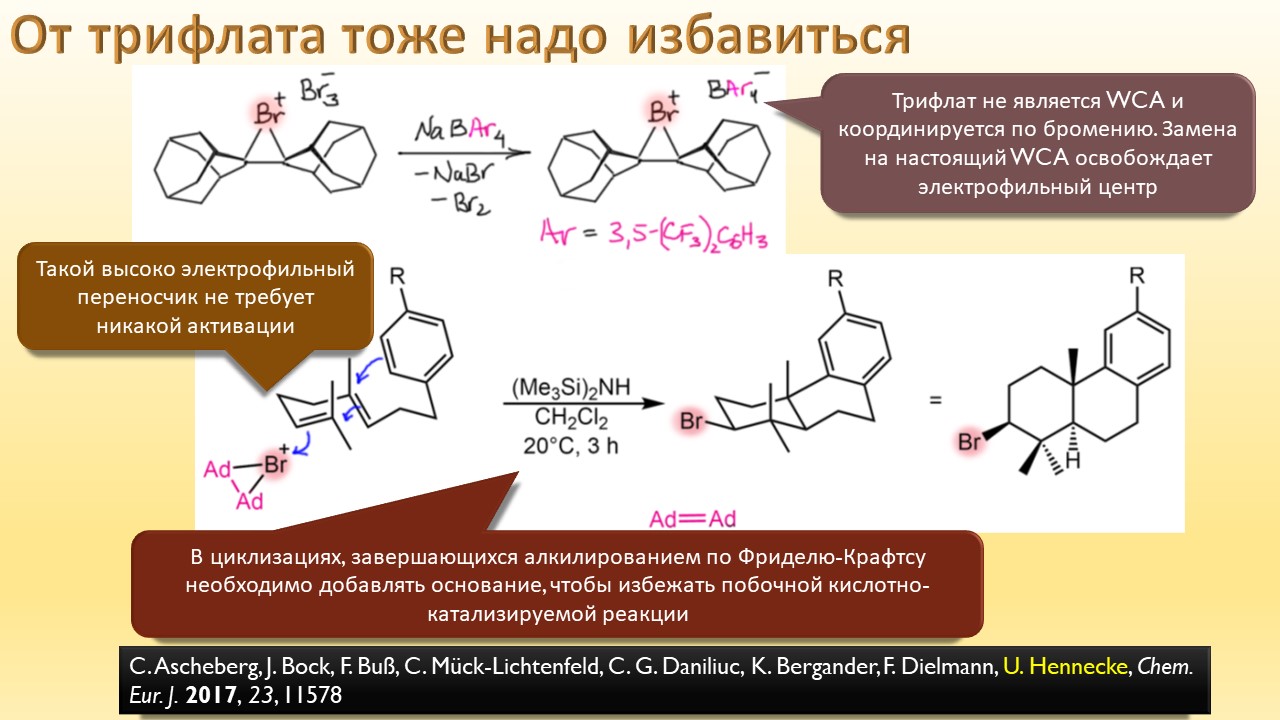
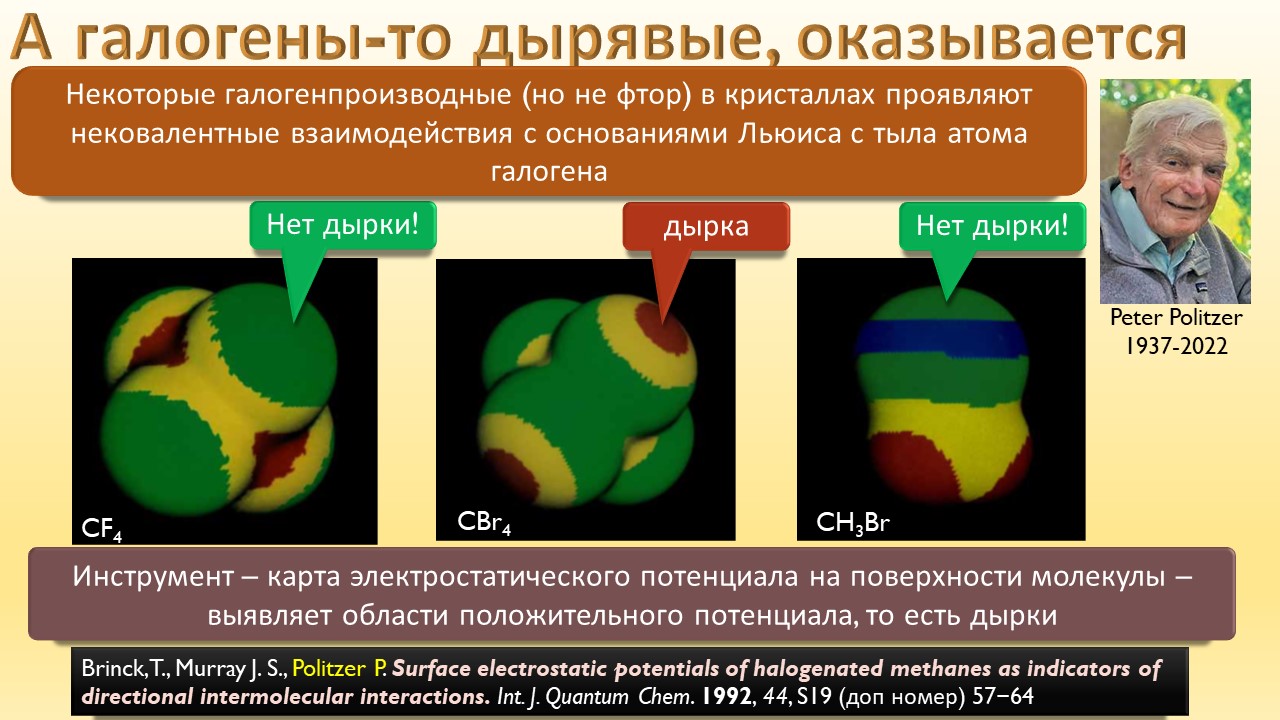
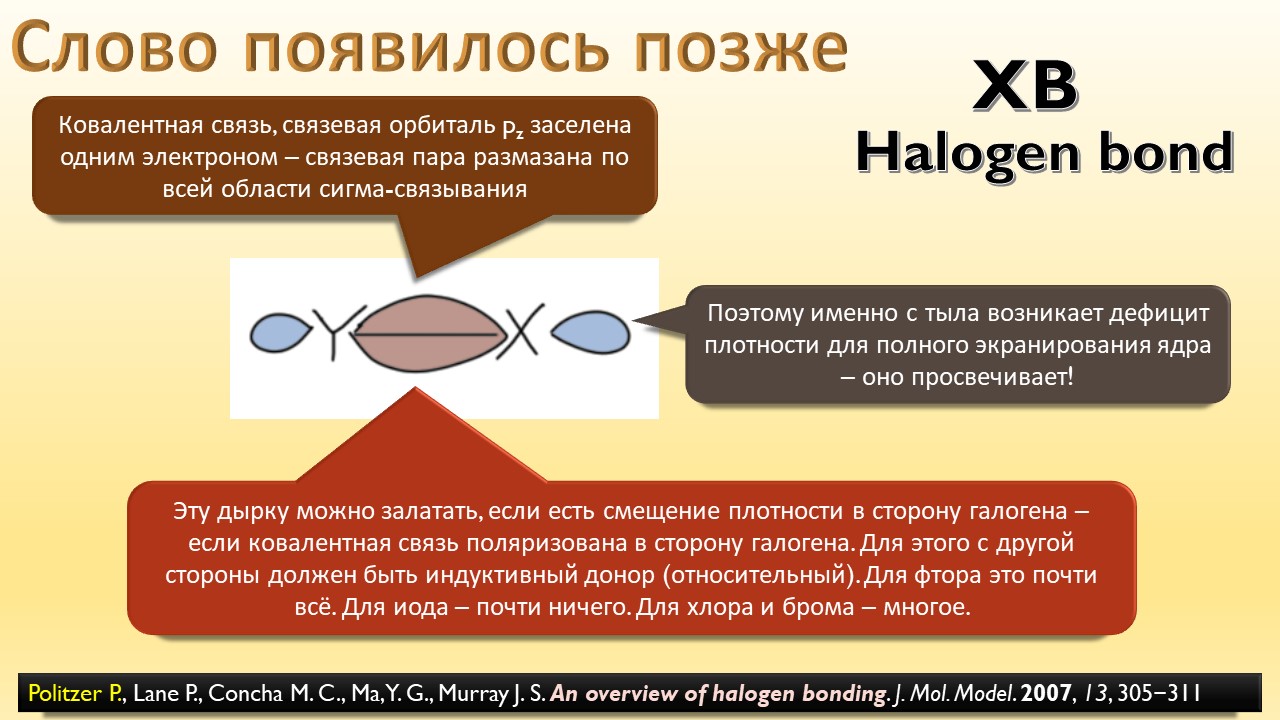
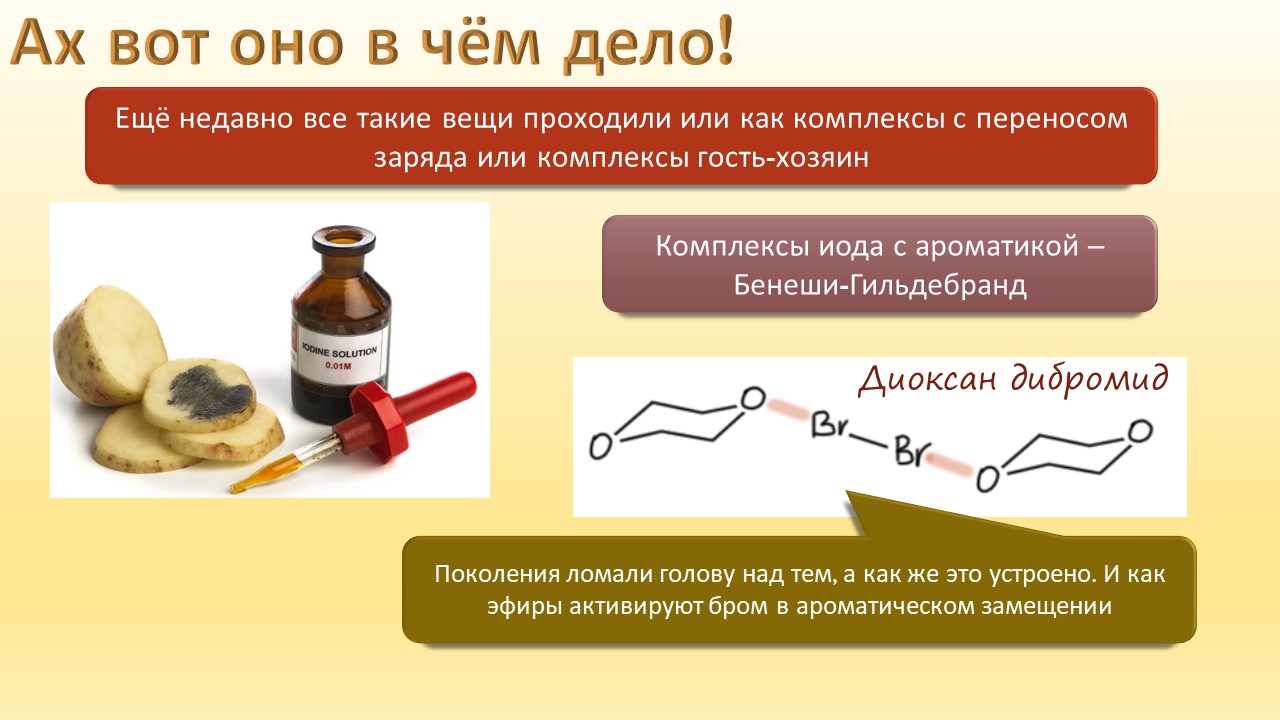
Без галогенов как без соли – химия пресна
Христос учил (Мф. 5:13): Если же соль потеряет силу, то чем сделаешь ее солёною? Она уже ни к чему негодна, как разве выбросить ее вон на попрание людям. В химии знают ответ на это: галогены рождают соли, и родят новые, если старые станут несолоны или протухнут иным способом, так что всё что останется это приспособить их под противогололёдные реагенты – выбросить вон на попрание людям. Были бы галогены, иными словами, и соли будут. Это потрясающее качество всей группы элементов не имеет больше прецедентов во всей Таблице – единственная группа, движение вниз по которой не приводит от неметаллов к металлоидам: мы отлично это понимаем, потому что ни у кого не повернётся язык усомниться в том, что даже иод это безусловный неметалл, а не непонятный металлоид. Аллену, электроотрицательности которого рекомендованы ИЮПАКом, удалось унизить иод, выдав ему электроотрицательность меньше чем у углерода: но ведь и углерод – безусловный неметалл и не последний – так что даже в этом случае всё в порядке, поменялись местами, не переставая отнимать электроны у других, ведь в этом призвание неметаллов. Сравним хоть с соседней группой и даже не поедем совсем вниз к висмуту в тот период, где нет ни нормального галогена, ни нормального халькогена, но и теллур разительно отличается от своего ближайшего соседа иода: теллур это типичный металлоид и в соединениях охотнее всего едет в сторону больших степеней окисления, разбрасывая свои электроны во все стороны – налетай. Кто-то скажет – ну какие проблемы, у халькогенов тоже есть халькогениды и соответствующие халькогеноводородные кислоты. Ха, видели вы эти кислоты и соли, там ветер дунет – всё накроется, особенно внизу всё настолько хлипкое, что то ли есть, то ли нет, никто толком сказать не может. Да уже селен скорее металлоид, а у кого повернётся язык обозвать металлоидом бром, того надо бромом и напоить (прим. это не призыв к жестокой расправе, а воспоминание о том, как при советской власти широко ходили легенды о том, что в столовых разных детских и юношеских учреждений в чай добавляют бромид калия, который и называли “бромом” – почему-то верили, что он успокаивает детские и юношеские страсти, “младая кровь играет” и надо смирять бромом, а додуматься о том, что нужно “смирять её молитвой и постом” тогда было равнозначно “партбилету на стол” и прочим грустным последствиям).
Это качество галогенов делает их, на первый взгляд, одинаковыми – одни и те же свойства, разница только количественная – больше-меньше. Противоионы, уходящие группы, нуклеофилы, типичные лиганды – всё одно и то же, так что в большинстве случаев мы пишем просто X, говоря тем самым: ну, галоген какой-то, какая разница. Фтор, безусловно очень особенный элемент, ему и положено, – большую электроотрицательность можно найти только у лёгких благородных газов, но они с рождения итак имеют полные комплексты валентных электронов и чужих им не надобно. Так что удел фтора – сидеть на вершине, выше ничего нет, а ниже все остальные, по первому зову готовые отдать свои валентные электроны царю неметаллов. Но статус этот, как и статус царя зверей, имеет обратную сторону – никто кроме горстки безбашенных последователей Анри Муассана не хочет связываться, страшно, поэтому химия фтора так сильно задержалась в развитии, во всяком случае в том, что касается органики. В последние десятилетия она наконец набрала неплохую скорость и основательно попёрла во все стороны, решая одну за другой задачи, которые считались нерешаемыми.
Но в этой лекции мы не будем её касаться вообще – остановимся на трёх других галогенах: хлоре, броме и йоде – и вот уж у них точно, кажется, различия только количественные, как будто это не три элемента, а – уж раз тронули божественное, то трудно удержаться – три ипостаси одного элемента, такого обобщённого галогена на все случаи жизни: хотите посильнее и покапризнее, обернёмся хлором. Хотите послабее и попокладистее, обернёмся иодом. Сами не знаете, чего хотите, так вот вам бром и успокойтесь наконец. Исключительно удобно для подбора реагентов под конкретную задачу.
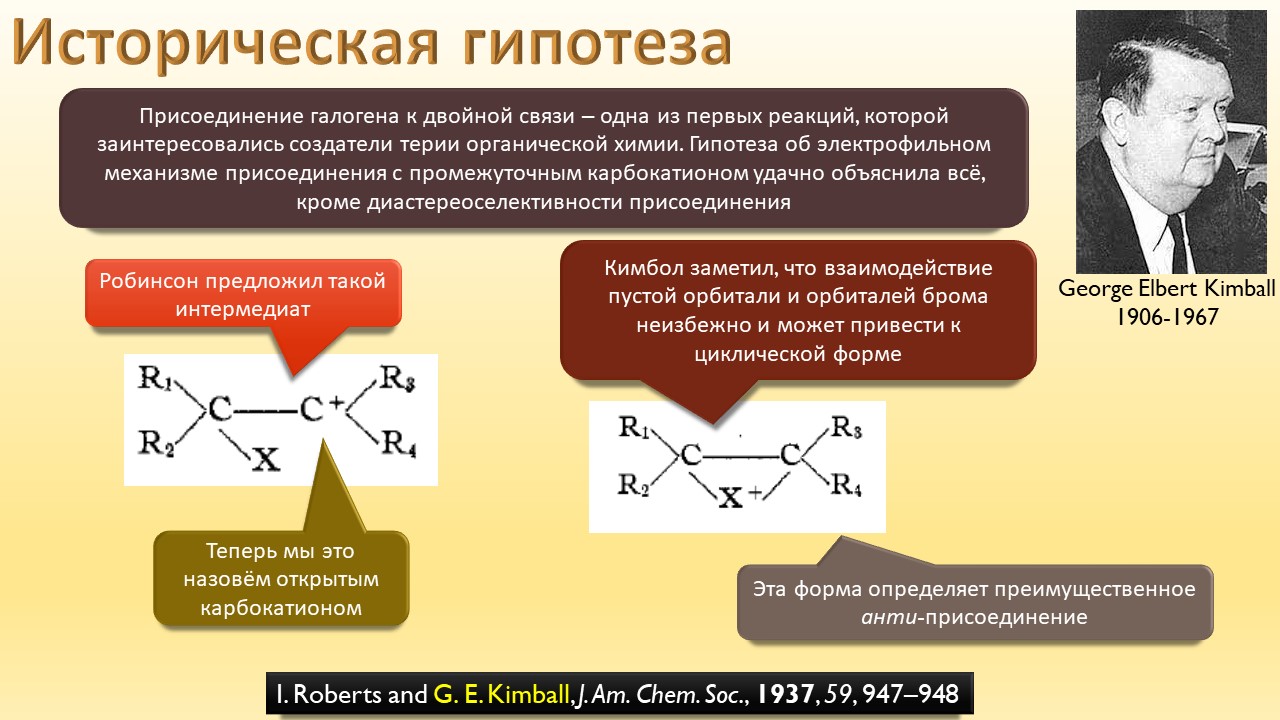
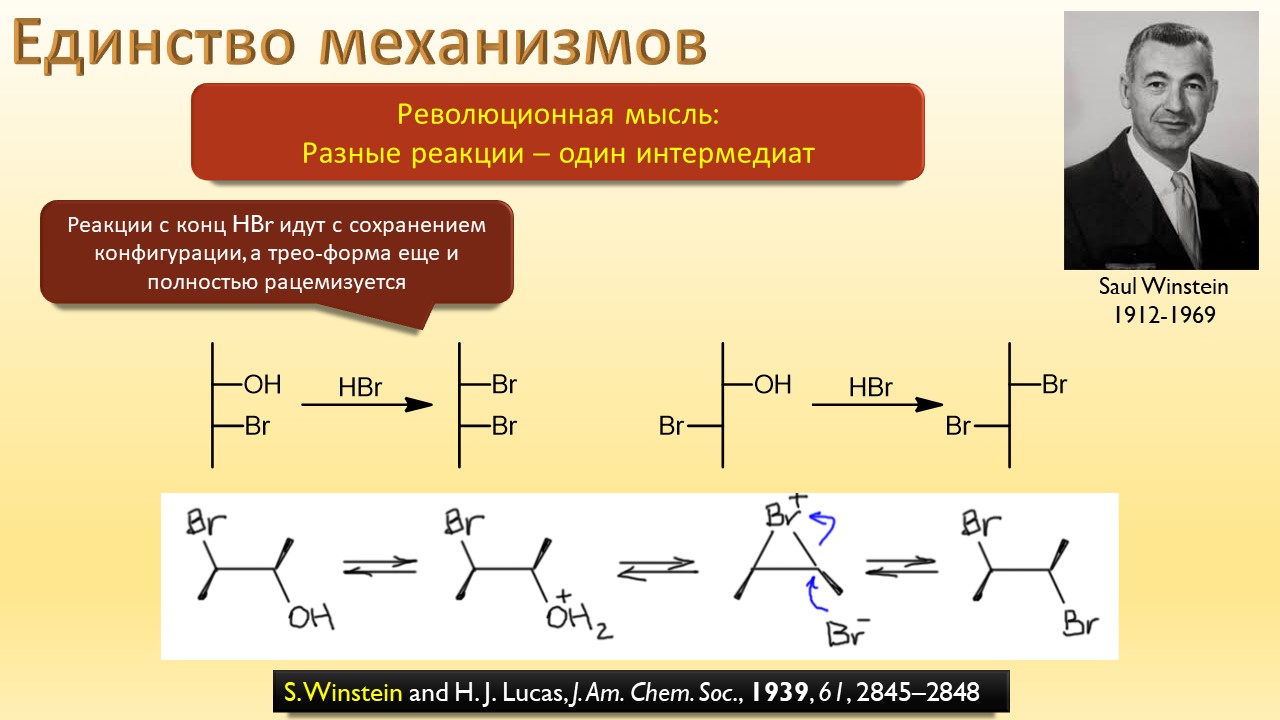
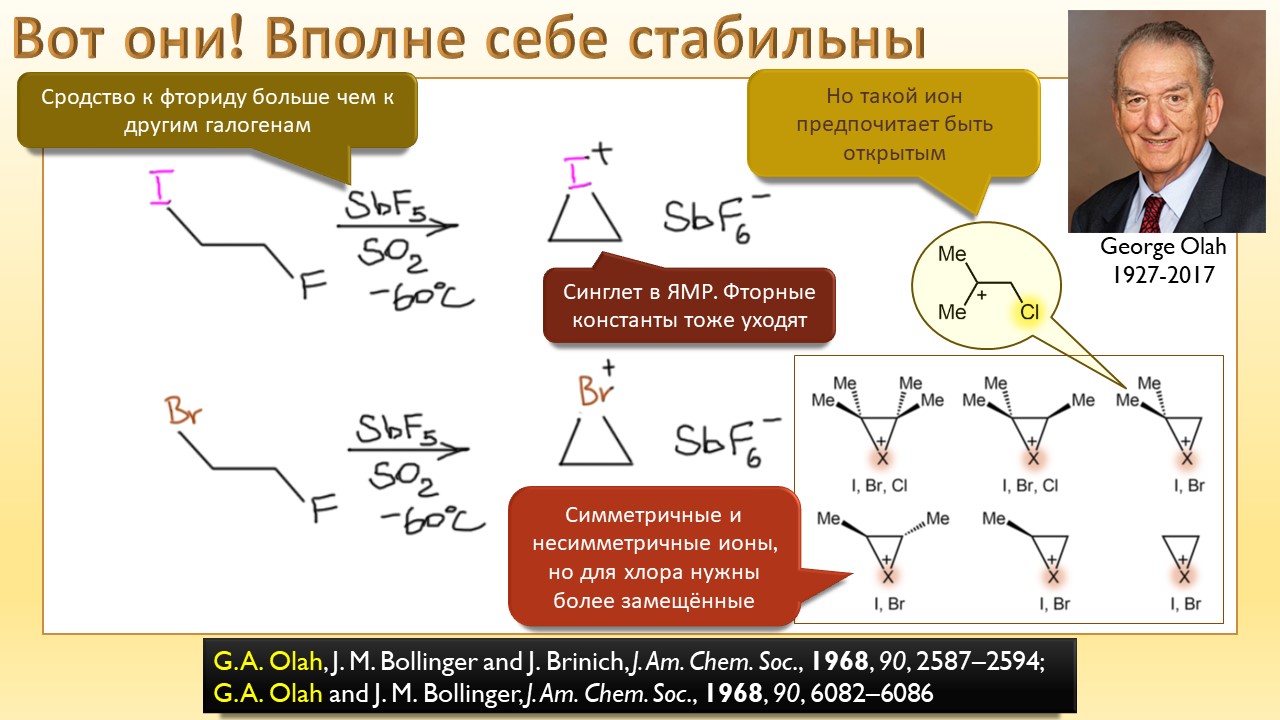
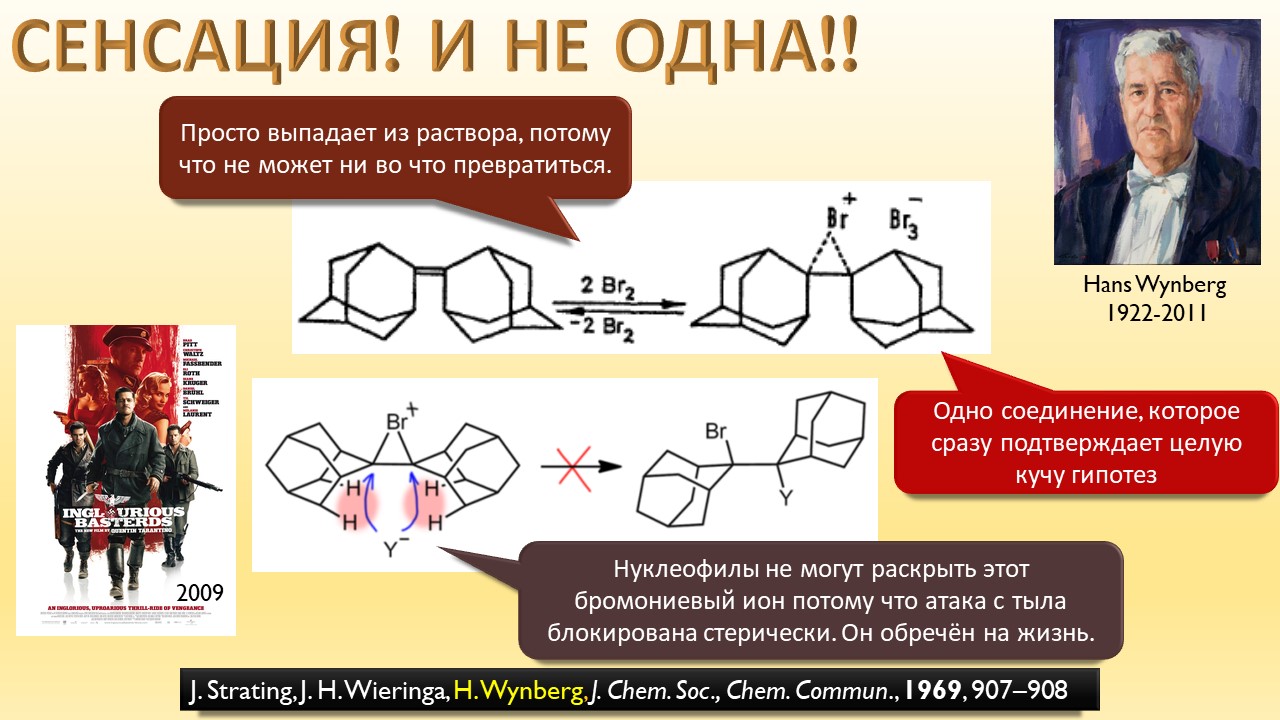
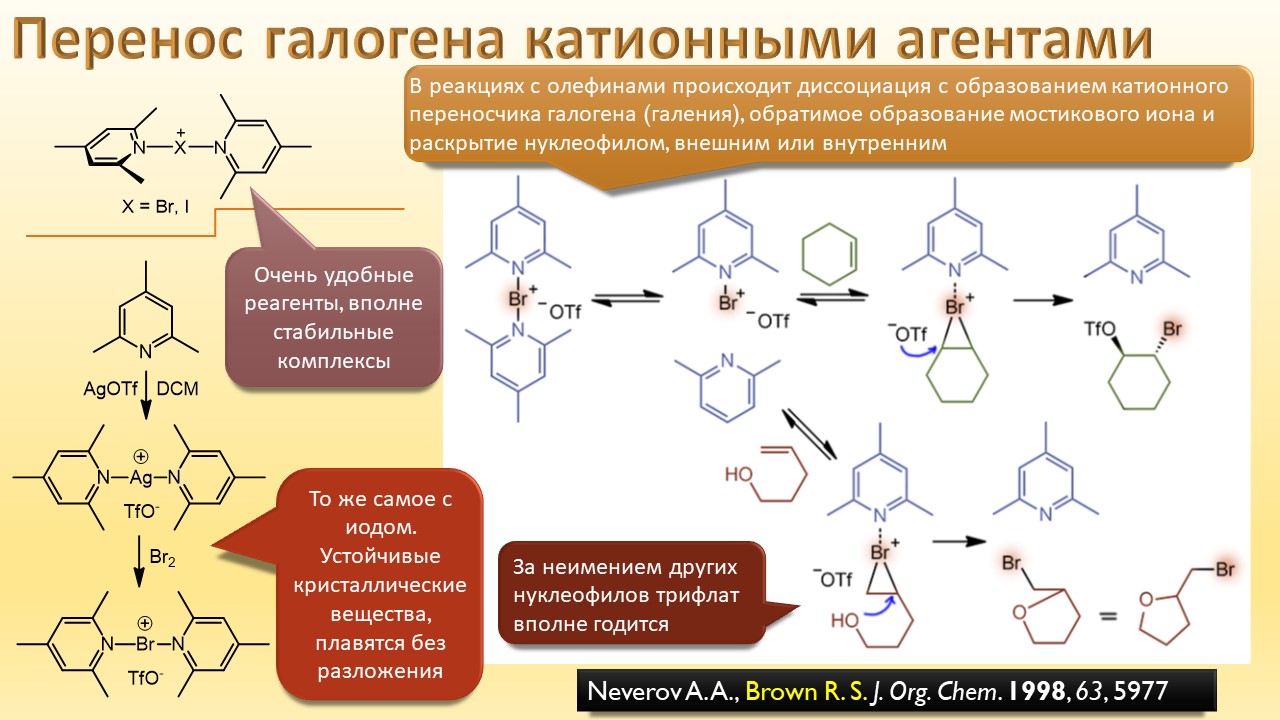
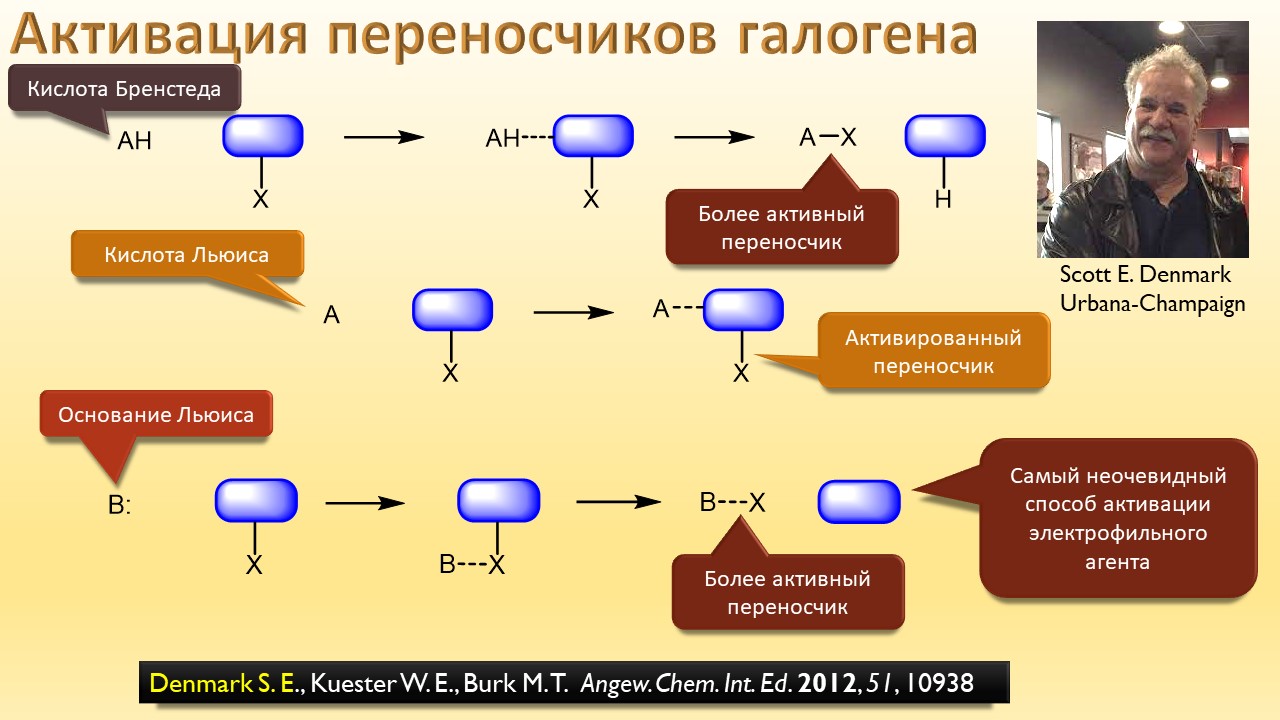
В этой лекции мы затронем две большие области исследований. Во-первых, посмотрим на то, как в современной химии умеют настраивать электрофильность. Самая хрестоматийная реакция, присоединение галогена к двойной связи, оказывается бездонной бочкой всяких трюков, с помощью которых реакции присоединения заставляют идти точно туда, куда нужно (в химии, конечно, всегда есть такая отмазка, что если вы куда-то случайно попали, нужно сделать торжествующее лицо и громко возгласить, что это то самое место, куда и вы, и всё прогрессивное человечество мечтало попасть со времен Второго Интернационала), а нужно в современной химии, чтобы получился именно желаемый продукт, с минимумом отходов, с высокой селективностью, и так далее. Такая гибкость электрофильной химии галогенов в первую очередь связана с высокой стеенью уверенности в механизм присоединения, главной боевой лошадью которого стали те самые мостиковые ионы, с которыми у нас в основном курсе органики были изрядные непонятки – то они есть, то их нет, прямо какие-то интермедиаты по вызову. Ну успокоимся: наконец нам точно говорят, что они есть, и что есть понимание того, как они устроены и в этом случае все противоречия можно примирить не прибегая к беспардонному вранью, а только к милым безобидным натяжкам и подтяжкам.
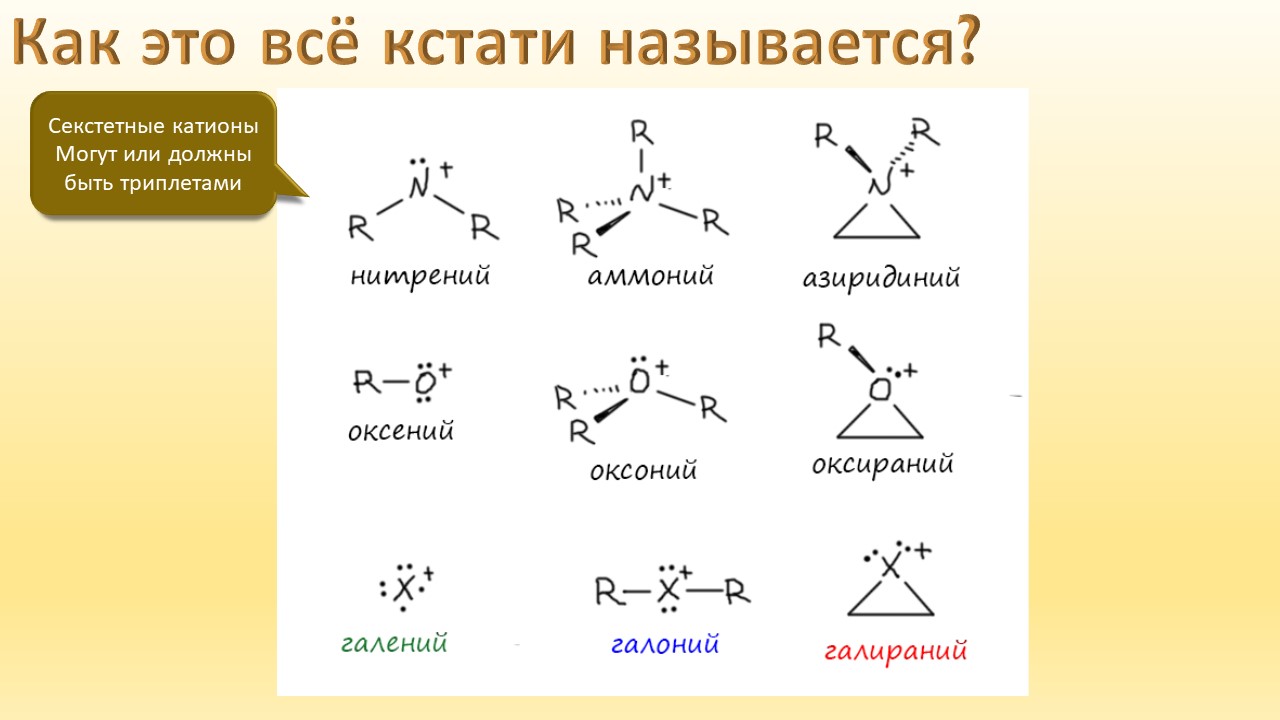
А ещё мы узнаем, что в химии оказывается есть ещё один тип связи, обусловленный тем, что в галогенах иногда бывают забавные дырки, привлекающие другие молекулы. И как только мы узнаем про эти дырки, откровения повалятся как дешёвые подделки на распродаже, и у нас возникнет перманентное чувство узнавания всего, что не удалось узнать раньше. Мы даже наконец узнаем, почему крахмал синеет при действии йода, и это одно, на мой взгляд, достаточно для того, чтобы бросить всё и погрузиться в лекцию про рождающие соли и всяческие загадки элементы.
У этой лекции есть текстовая версия: это не транскрипт устной лекции, выложенной на злобно нарушающем российские законы ютубе, а именно альтернативная версия для чтения. И боги пишутся с маленькой буквы, клянусь Юпитером!