Методы и задачи в химии алициклических соединений
Алициклические соединения – просто разновидность алифатических соединений, насыщенных или ненасыщенных. И, в принципе, все свойства и реакционная способность алициклических соединений мало отличается от соответствующих алифатических: циклогексанол – это просто вторичный спирт, циклопентен – дизамещенный олефин, циклогепт-2-енон – непредельный сопряженный кетон (енон) и т.п. И на этом можно было бы поставить точку, если бы не два обстоятельства:
- циклопропан и его производные – совершенно особенные органические соединения, не похожие ни на другие циклоалканы, ни на алифатические соединения; химия циклопропана и его производных настолько своеобразна, что общим советом здесь может быть только одно – либо потрудитесь в ней разобраться, либо просто держитесь от нее подальше, так как все, что вы будете делать “из общих соображений” будет с гарантией неверно;
- стереохимия циклоалканов несколько отличается от стереохимии нециклических алифатических соединений, и это приходится учитывать. хотя мы ограничимся только циклогексаном.
Новые C-C связи
Синтез циклопропанов
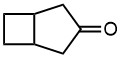
Встречаются а) диазометан; б) диазоуксусный эфир; в) диазокетоны (те самые, из реакции Арндта-Эйстерта). Обратите внимание на стереохимию – если алкен был замещенным, мы не можем предсказать взаимное расположение заместителей из олефиа и из диазоалкана. Корректности ради нужно писать неопределенную стереохимию.
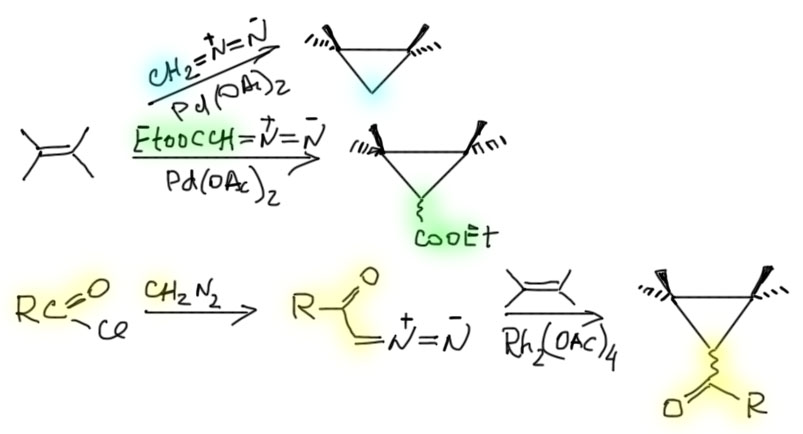
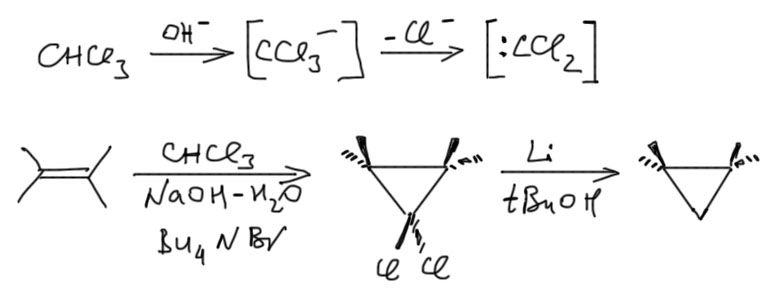
Кроме диазоалканов, встречается и другой источник карбена, точнее, одного дихлоркарбена. Он очень легко генерируется из хлороформа действием щелочи в присутствии межфазного переносчика. Это очень простой и дешевый метод. При желании хлоры с циклопропана можно ободрать литием в спиртах. Получится то же самое, что из диазометана, но без рисков работы с этим отвратительным веществом.

Самый известные пример этого метода это синтез циклопропанкарбоновой кислоты из дибромэтана и малонового эфира, когда нужный фрагмент генерируют прямо на месте. Реально реакцию проводят, сразу взяв два эквивалента этилата. Продукт, как обычно в малоновом синтезе, лишают одной из карбоксильных групп.

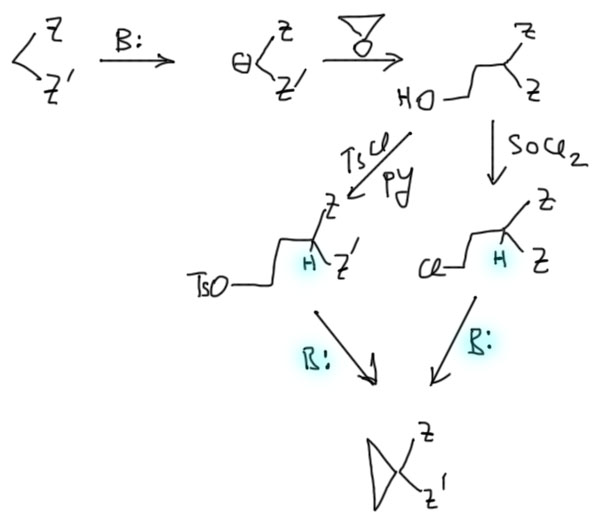
Более сложные замыкания можно делать с почти любым источником карбанионов, нацепив на него фрагмент CH2CH2X. Один из очевидных способов это сделать – нуклеофильное раскрытие оксирана. Дальше меняем гидроксид на уходящую группу и добавляет основание, подобрав его по оценке CH-кислотности оставшегося протона.
Шестичленные циклы
Распил 1

К сожалению, в каждом случае существует и альтернативный способ распила. И нужно пробовать оба, подбирая годный под имеющиеся реактивы. Во втором способе пилят тоже по двойной связи, но простую связь выбирают более близкую. И в этом случае карбонил остается в непредельном кетоне (альдегид в этом распиле не работает).
Распил 2

Реакцию, независимо от способа распила проводят в условиях равновесного основного катализа (щелочь или алкоголят в спирте) и ни в коем случае – не в условиях предварительного получения енолята, то есть LDA – в топку! Стадии разрисовывать не нужно. Например,

И последнее: непредельный компонент можно еще раз распилить, так как большинство енонов получаются кротоновой конденсацией. Но это делается отдельно, так, как мы это делали в теме Альдегиды/кетоны. Придется вспомнить про направленную и ненаправленную конденсации. Вот как это выглядит на уже рассмотренном примере. Обратите внимание, что когда мы допилились до конца, оба способа распила приводят к одним и тем же исходным, только они комбинируются по разному.
Стереоселективные реакции
- Выбираем...
- Как правильно рисовать конформации циклогексанов
- Стереохимия E2-элиминирования из производных циклогексана
Во-первых, нужно научиться рисовать кресло, лучше всего в двух проекциях: прямой и вывернутой, хотя можно обойтись и одной. В любом случае нужно правильно обозначать аксиальные и экваториальные связи, учитывая, что при обходе кольца на каждом следующем углероде направление связей меняется на противоположное. Для аксиальных связей это изображается очевидным образом.
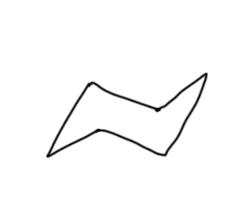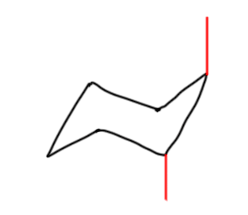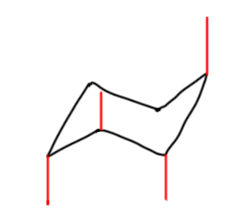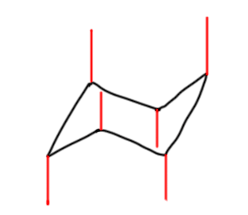
После добавляются экваториальные, каждая под приблизительно тетраэдрическим углом (только, пожалуйста, без транспортира, на глазок).
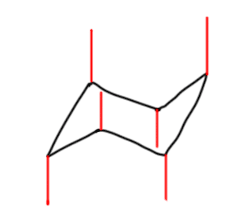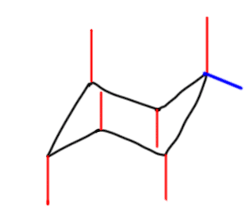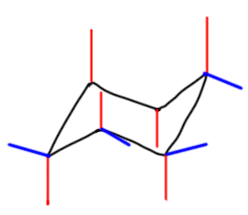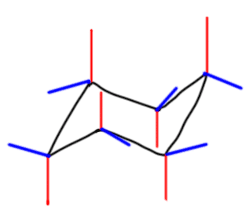
После этого привыкаем к тому, что для реальных молекул не нужно рисовать все связи, но только те, которые идут к заместителям. Удобнее всего располагать первый заместитель (если заместителей несколько, то наверняка выбор первого можно сделать так, чтобы это был какой-то важный заместитель) в самом верхнем или самом нижнем углу, а все остальные располагать относительно этого заместителя. Если заместителя только два, то их взаимное расположение обозначают словами цис или транс. Если заместителей больше, тогда рисуют шестиугольник и показывают взаимное расположение заместителей обычными клином-зеброй. Преобразуем такую формулу в кресло. Попробуем на примере:

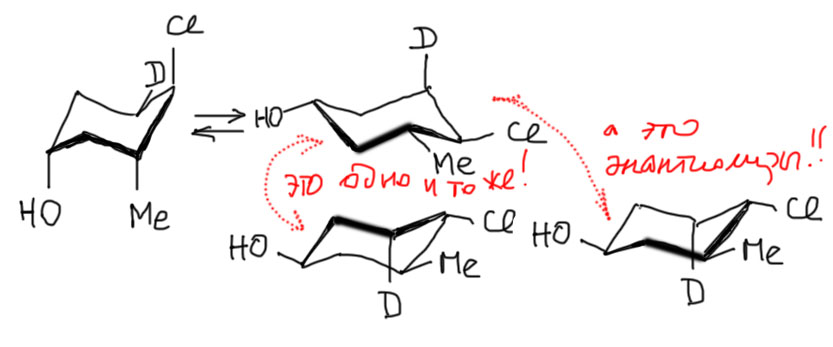
Берем хлор. Он вверх (клин), значит помещаем его в верхний угол кресла в аксиальное положение. Метил относительно хлора вниз (зебра) – то есть тоже аксиальный, так как на соседнем углероде направление переворачивается. Дейтерий относительно хлора цис – значит он экваториальный, так как аксиальный был бы транс. И последний гидроксил – транс относительно хлора, но он на четвертом углероде, и придется либо мысленно (по аксиальным от хлора – транс-цис-транс) либо по рисунку найти, что транс на 4 атома тоже аксиальный. Все – первая конформация готова. Теперь рисуем вторую, которая получается из первой выворачиванием (инверсией) и находится с первой в равновесии. Рисуем вывернутое кресло и на нем все заместители меняются с аксиального на экваториальный и обратно. Будьте внимательны: все!! Если хоть один оставите без изменения, получите другую молекулу. Обратите внимание, что если вы честно нарисовали второе кресло вывернутым, расположение заместителей в пространстве (в смысле верх-низ) остается без изменения – все что было вверх, останется вверх. И это правильно. Но довольно часто “кресло-наоборот” нарисовать не получается – вон, и у меня видно, что первое кресло поровнее будет. Наддо либо долго тренироваться, что выглядит довольно комически, либо наплевать и рисовать всегда кресло в одной проекции, а для того, чтобы показать вторую конформацию, просто рисовать на каждом углероде вывернутую связь. Получится то, что нарисовано внизу. И это нормально и для большинтсва целей годится без вопросов.
На этом месте можно поставить точку, но для особо внимательных добавим, что формула внизу выглядит так, как будто это отражение в зеркале (зеркало стоит как раз на месте “Одно и то же!”), а значит это не совсем одно и то же, а энантиомер. Поскольку мы не будем заниматься синтезом энантиомерно чистых молекул, мы можем этим пренебречь. К тому же, это не обязательно энантиомер. Строго говоря, в нарисованных креслах не задана одна важная вещь – какая часть кресла ближе к наблюдателю спереди. И добавить это мы можем двумя разными способами. В одном способе действительно получится энантиомер, но в другом – та же молекула. Просто для корректности нарисуем все совсем правильно.
Предполагается, что элиминирование в циклогексанах всегда имеет анти-стереохимию. Это связано с тем, что в конформациях кресла не бывает заслоненных расположений уходящая группа-протон, необходимых для син-элиминирования. В реальной жизни это правило жстко не соблюдается, но в задачах рассматривайте только анти-элиминирование.
Для анти-элиминирования уходящая группа должна быть в аксиальном расположении. И на соседенем атоме должен быть аксиальный протон или дейтерий. Могут быть разные случаи
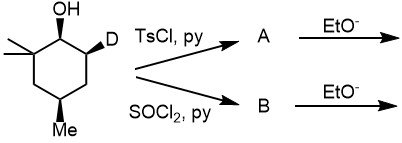
1. Смотрим направление элиминирования при условии свободной инверсии кольца. Получите тозилат и напишите продукт элиминирования.
Рисуем сразу тозилат по исходной стереохимии, как мы это делали на соседней вкладке. Рисуем две конформации, в одной тозилат будет аксиальным. Находим на соседних атомах аксиальные водороды. Там, где метил, нет аксиального водорода. На другом атоме аксиальным оказывается обычный водород. Его и отщепляем. Продукт рисуем шестиугольником – конформации циклогексенов рисовать не нужно, они непростые в рисовании и ничего не дают. При двойной связи все плоское – не нужно рисовать там зебр и клиньев. А вот на атоме, оставшемся незатронутым, стереохимию рисуем как в исходной молекуле.

2. В молекуле присутствует “замораживающий” заместитель.
Очень большие группы, например, трет-бутил и другие третичные алкилы, фенил и замещенные фенилы, нафтил и т.п. предпочитают находиться в экваториальном положении, и фактически “вымораживают” конформацию с таким привилегирванным расположением. В этом случае сразу рисуем кресло с экваториальной группой этого типа, а все остальное определяем относительно нее. Вторую конформацию рисовать не нужно – она будет представлена в равновесии очень малой долей, и реакцией через нее можно пренебречь. Поэтому ищем уходящую группу, и если она оказывается аксиальной. ищем подходящие водороды или дейтерии. Если она экваториальная, элиминирование не идет или идет очень медленно через невыгодную конформацию.
Пример: Какой из возможных диастереомеров даст единственный продукт элиминирования без дейтерия?
Рисуем четыре возможных диастереомера при заданном расположении большой и уходящей групп. В каждом находим водороды или дейтерии на соседних атомах. Видим, что только из первого диастереомера продукт получается один и без дейтерия. Из двух диастереомеров продуктов будет по два, но первый продукт в каждой паре преобладает, потому что он соотвествует правилу Зайцева (при прочих равных условиях образуется более замещенный олефин), которое тоже не стоит забывать.

Стереохимия элиминирования и конформационный анализ
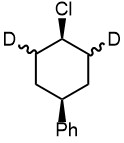
2. Напишите элиминирование для всех возможных диастереомеров приведенного хлорциклогексана. В каком случае в продуктах останется весь дейтерий, и в каком будет максимальная потеря дейтерия.
Синтез циклопропанов
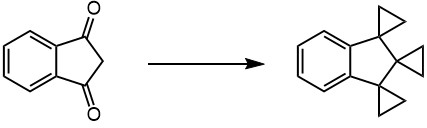
2. Из малонового эфира, дибромэтана и днр получите трициклопропилкарбинол (карбинол – это распрстраненный синоним слова метанол).
Аннелирование по Робинсону
1. Распилите каждый из трех циклогексенонов двумя способами на три части, и соберите молекулы обратно
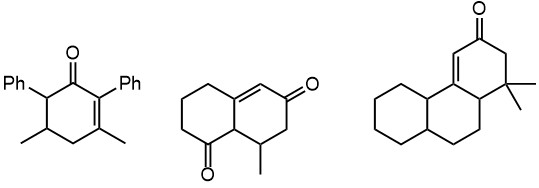
2. Изофорон (тривиальное название 3,5,5-триметилциклогекс-2-ен-1-она) – дешевое вещество, получаемое в промышленности в больших количествах. Проанализируйте синтез изофорона по Робинсону всеми способами, и определите, почему и из чего это не самое простое соединение так легко получается.
Синтез больших циклов
- Из циклогексена, малонового эфира и днр изготовьте транс-циклотетрадецен (это 14-членный цикл, если забыли по-гречески).
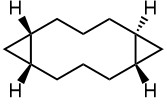
- Из малеиновой кислоты, малонового эфира и диазометана сделайте вот такой трициклический углеводород. Не потеряйте из виду стереохимию соединения колец.
Реакция Дильса-Альдера и все остальное
- Из 1,3-бутадиена, малеинового ангидрида и днр получите бициклический кетон