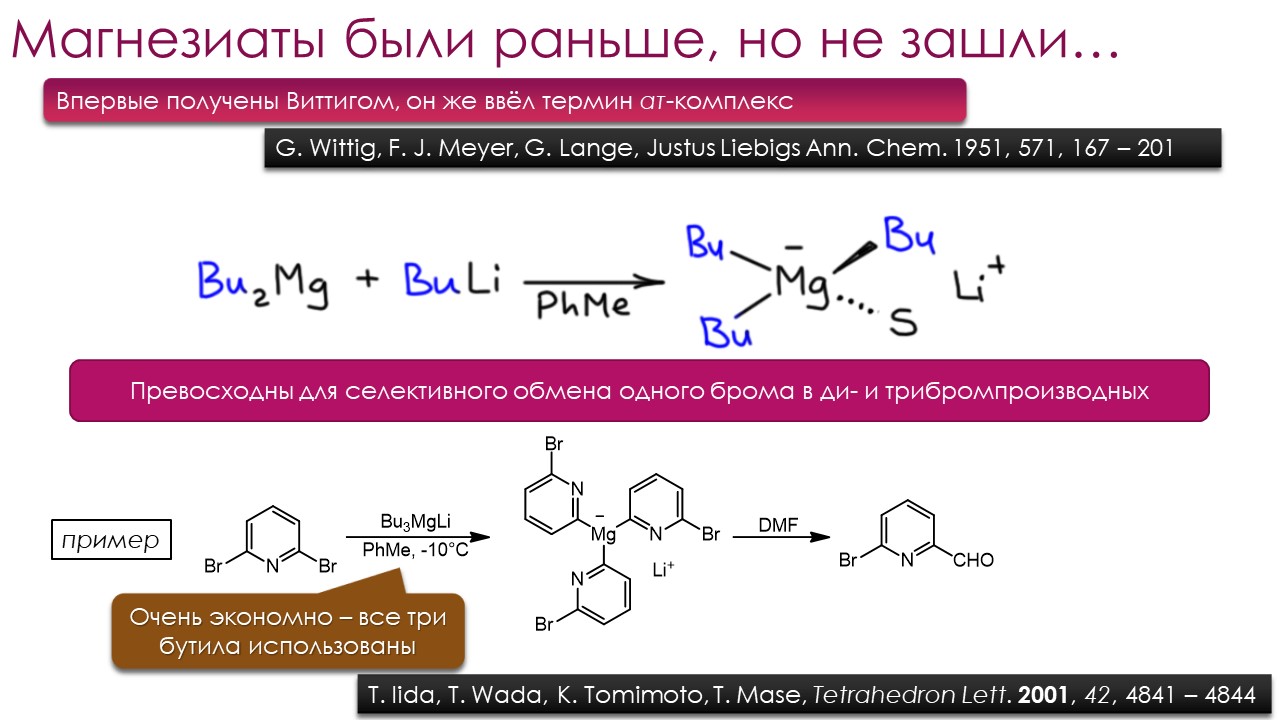
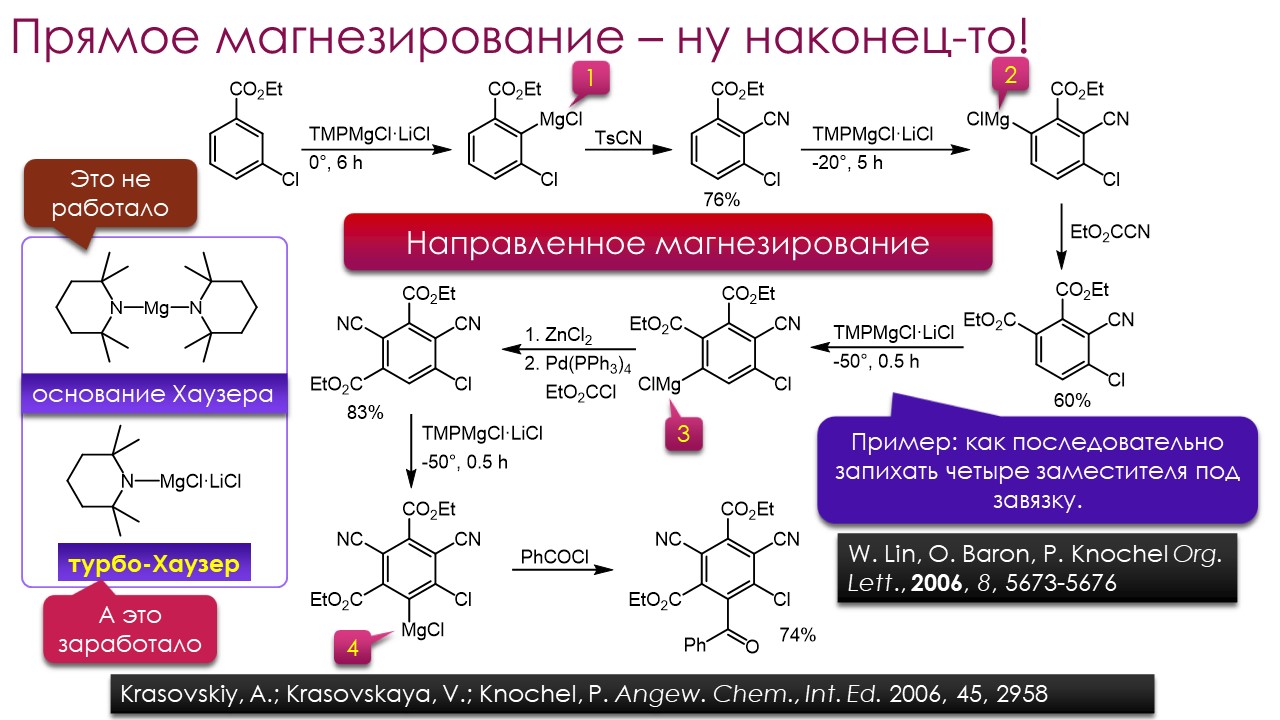
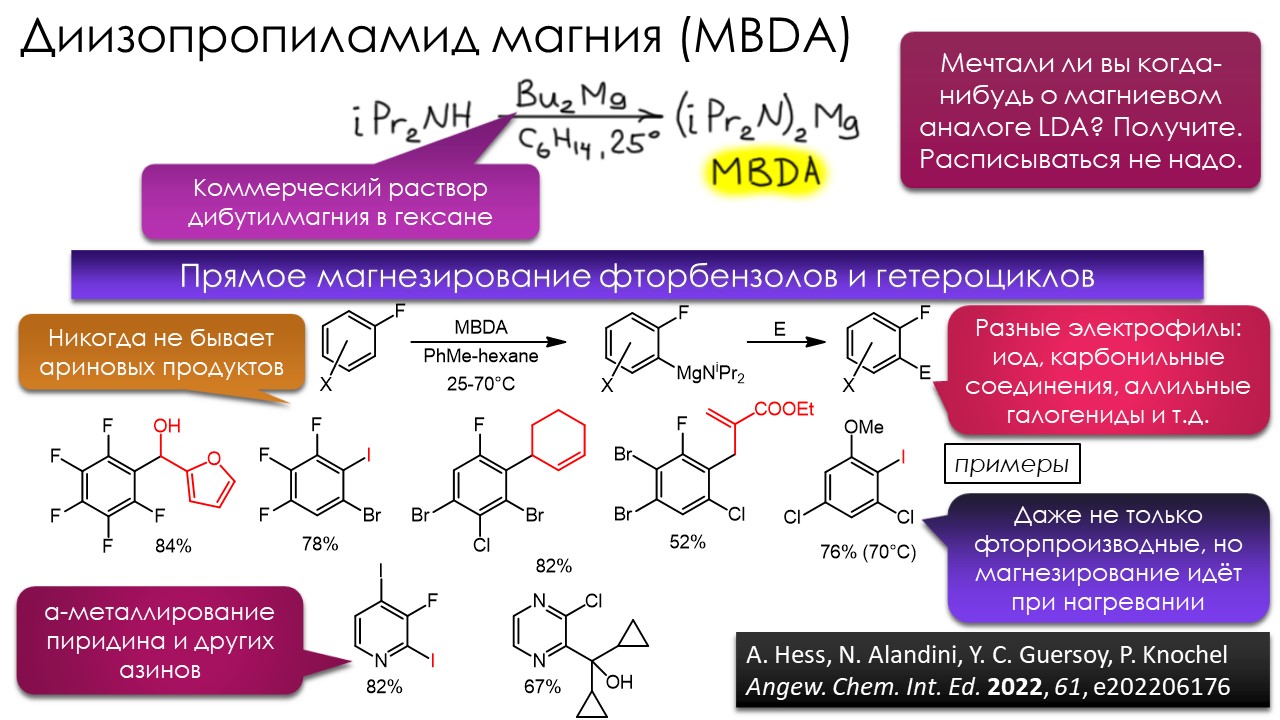
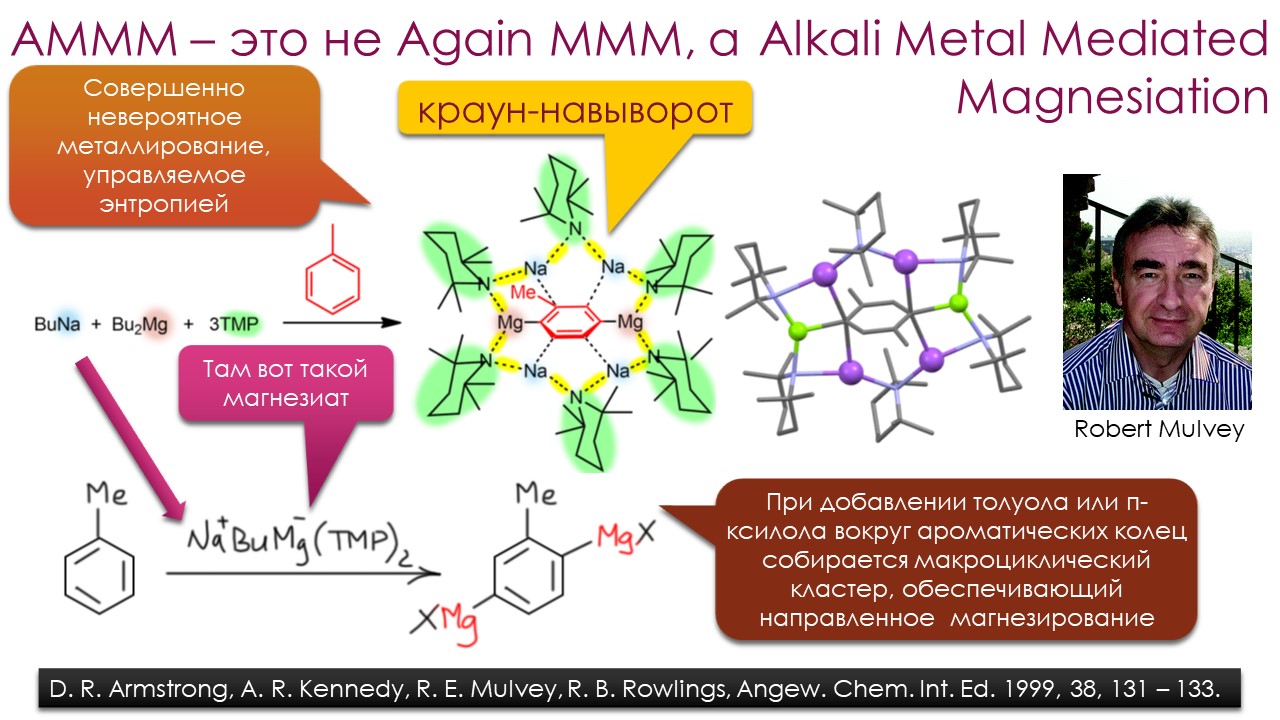
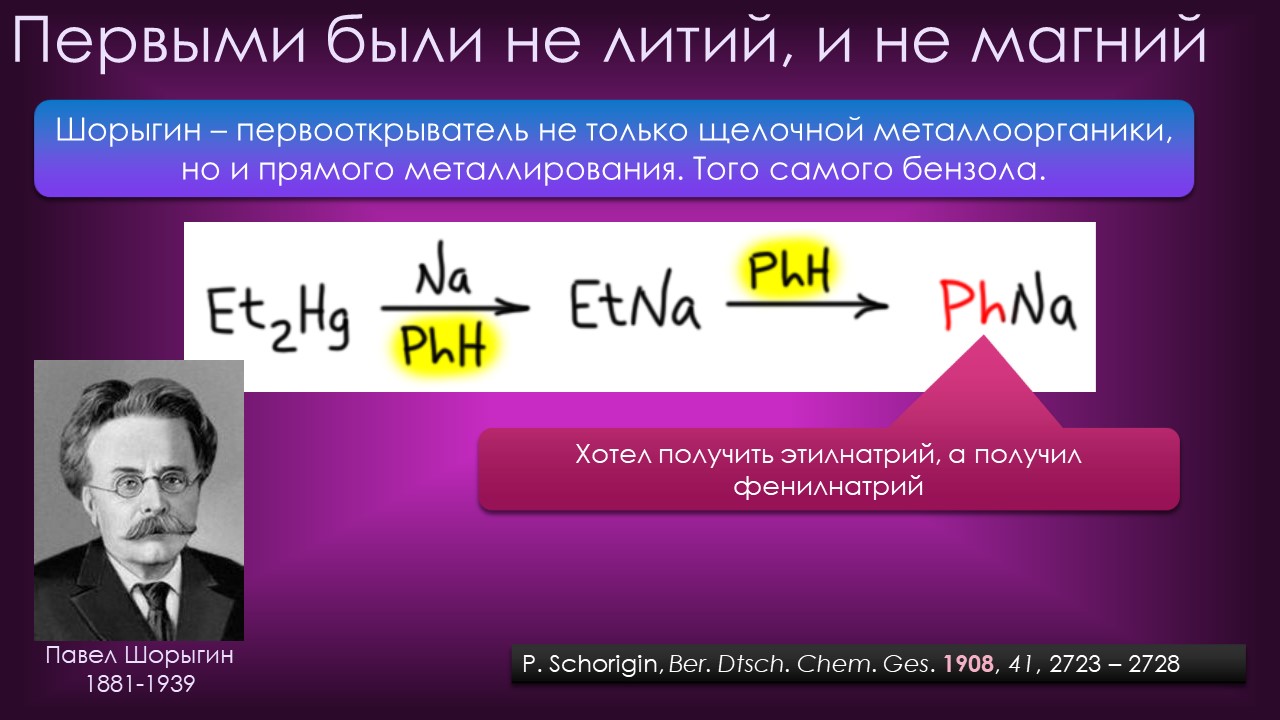
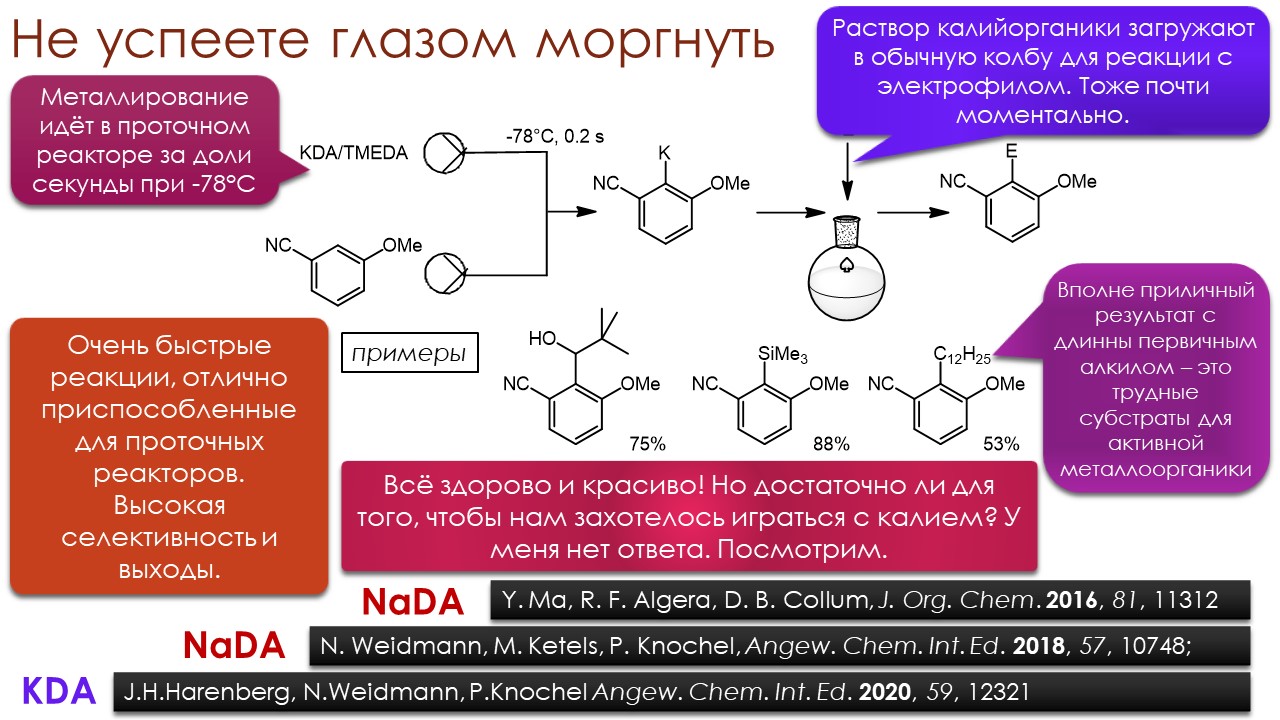
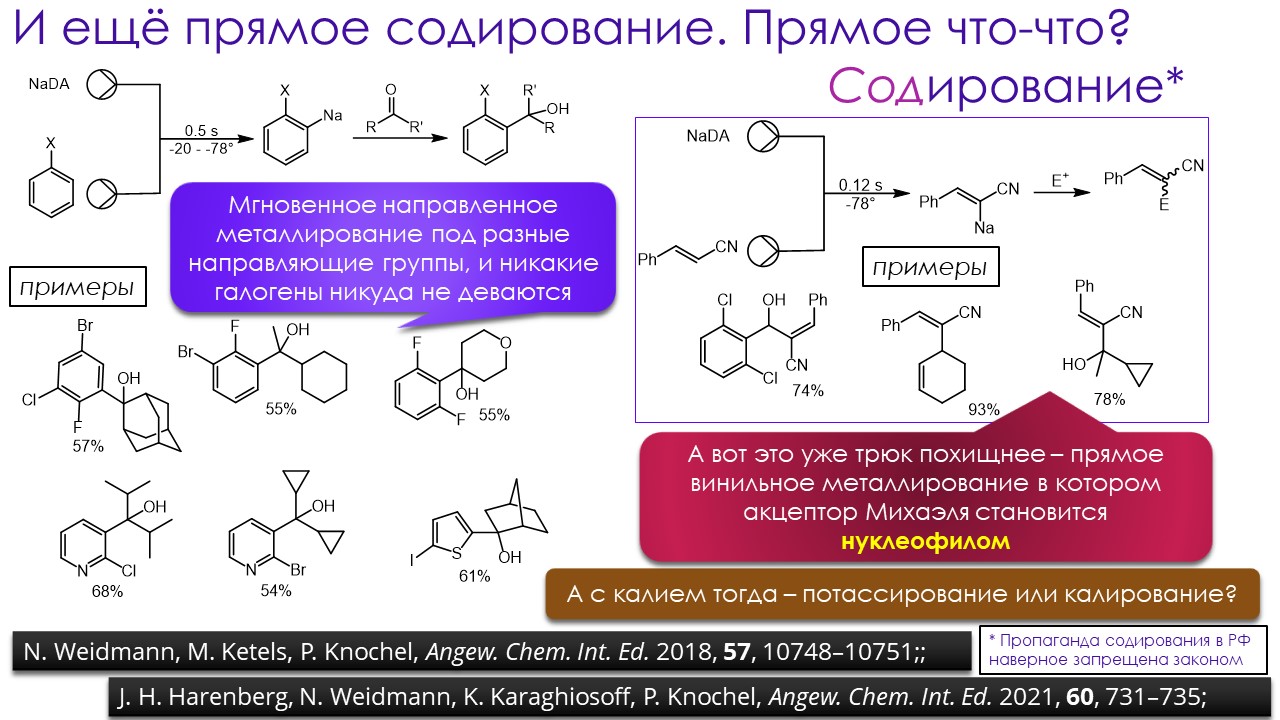
Ниже некуда?
Немного разобравшись с кислотами, займёмся противоположным свойством – основностью. Кислотность – способность молекулы (молекулярного агрегата) или среды отдавать протоны. Чем выше способность, тем сильнее кислота, всё понятно. И даже понятно, что у кислотности есть очевидный потолок – это там, где свободные протоны. К счастью в конденсированных средах, с которым имеют дело обычные химики, в основном жидкостях, никаких свободных протонов нет и быть не может. Это делает шкалы кислотности устремляющимися в буквальном смысле в небо – в какой-то протонный газ, в общем в некую абстракцию.
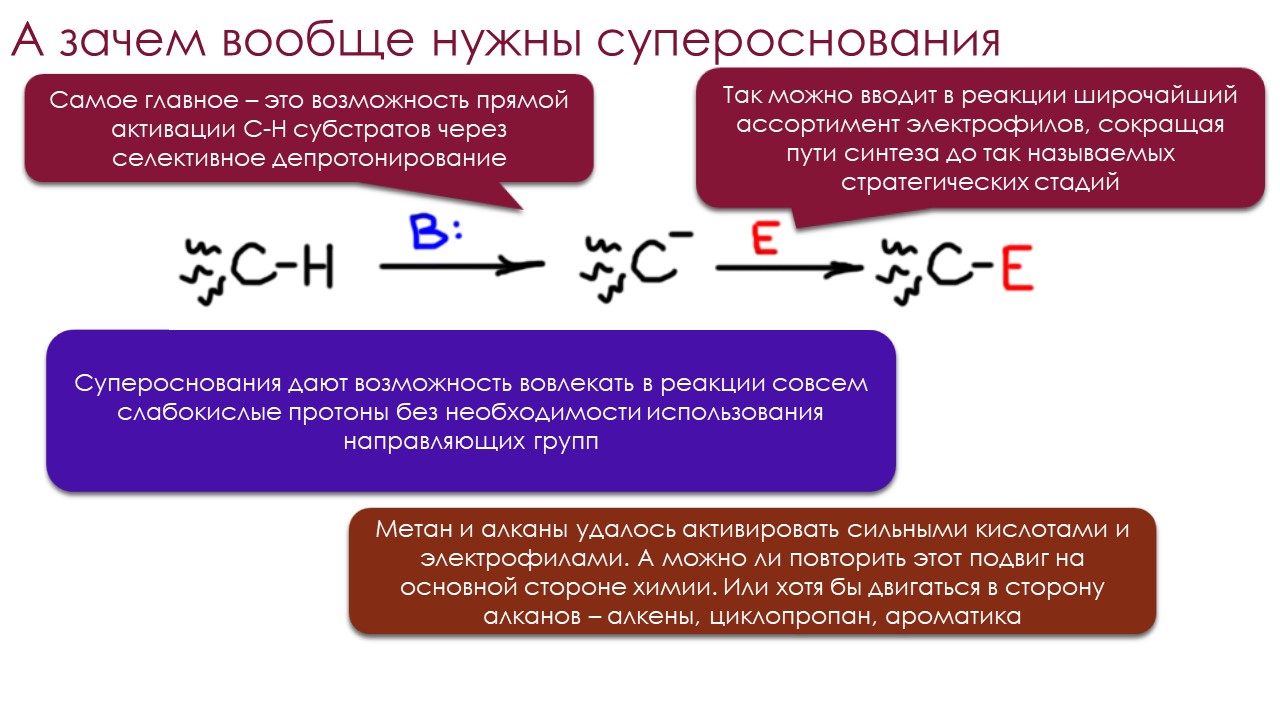
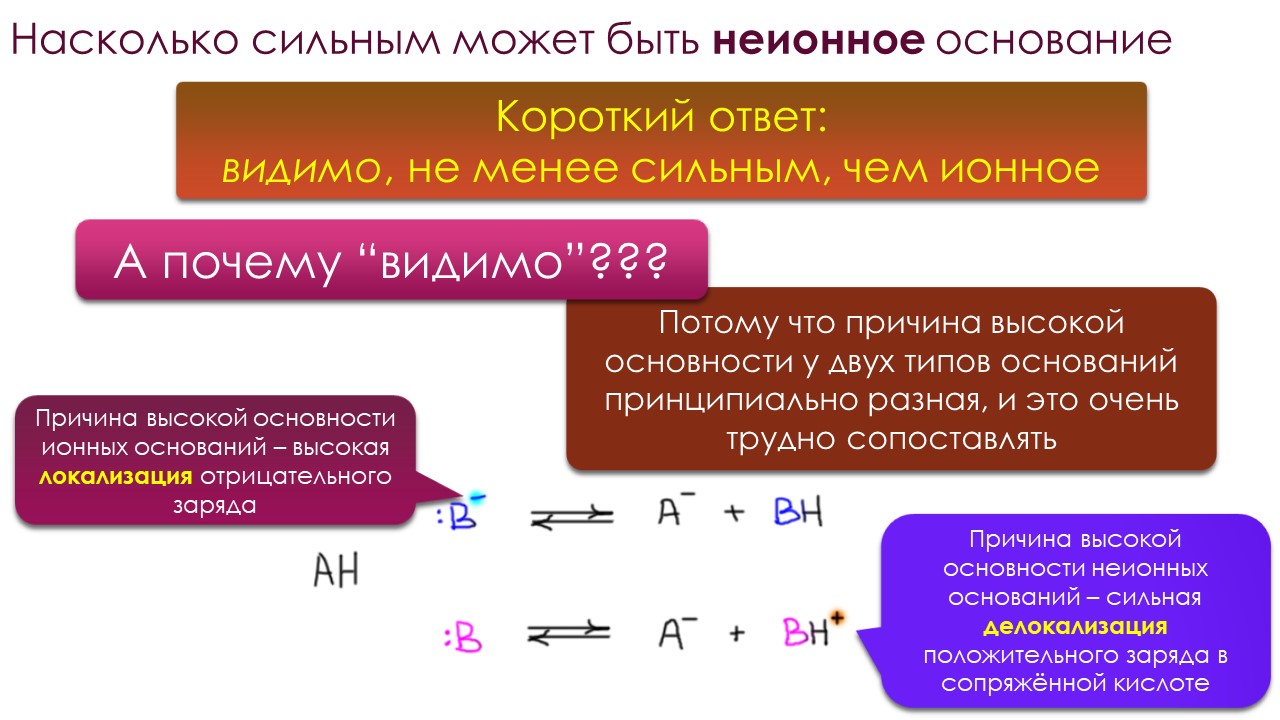
Но когда дело доходит до оснований, всё становится намного солиднее и практичнее. Полной симметрии в отношении кислота-основание нет. Основание это то, что может принять протон, а принять протон может практически всё, ведь если бы это было не так, мы взяли бы это непринимающее протон, сделали бы из него среду, пустили бы туда протоны, и получили бы кислотную среду невероятной силы (я надеюсь вы заметили подвох в этом рассуждении). И тогда подумаем немного реалистичнее – что такое самое сильное основание, не абстрактно, а так, что мы сможем это доказать. Ну, это проще некуда – это должно быть такое основание, сопряженную кислоту которого не получится депротонировать ни одним известным основанием. Другими словами, это будет самая слабая кислота из всех существующих. Знаем мы водородсодержащее соединение, которое не удается депротонировать ничем? Нейтральное конечно, а то мы уперлись бы в ионные гидриды, водородсодержащие соединения, которые точно нельзя депротонировать никак. Знаем конечно, и не одно, а множество, но поскольку мы органической химией занимаемся, возьмём просто метан. Или любой алкан. У нас нет возможностей взять какое-то основание и превратить алкан в алкильный карбанион с каким-то противоионом (при этом протон от метана и других алканов в равновесном режиме всё же отрывается, как не раз показывал Эндрю Стрейтвизер с коллегами, изучая обмен протона в алканах на дейтерий или тритий под действием циклогексиламида цезия, но мы очень хорошо знаем, что малые равновесные концентрации каких-то короткоживущих интермедиатов можно получить и при очень малых значения констант равновесия).
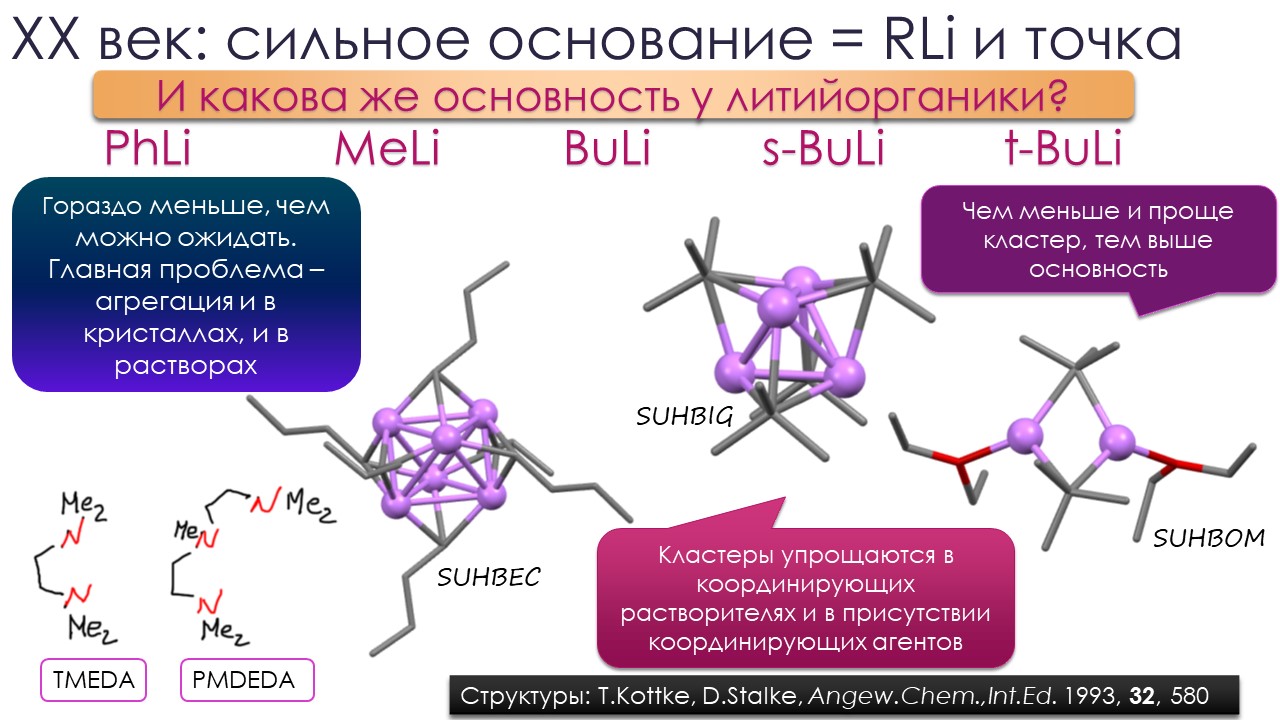
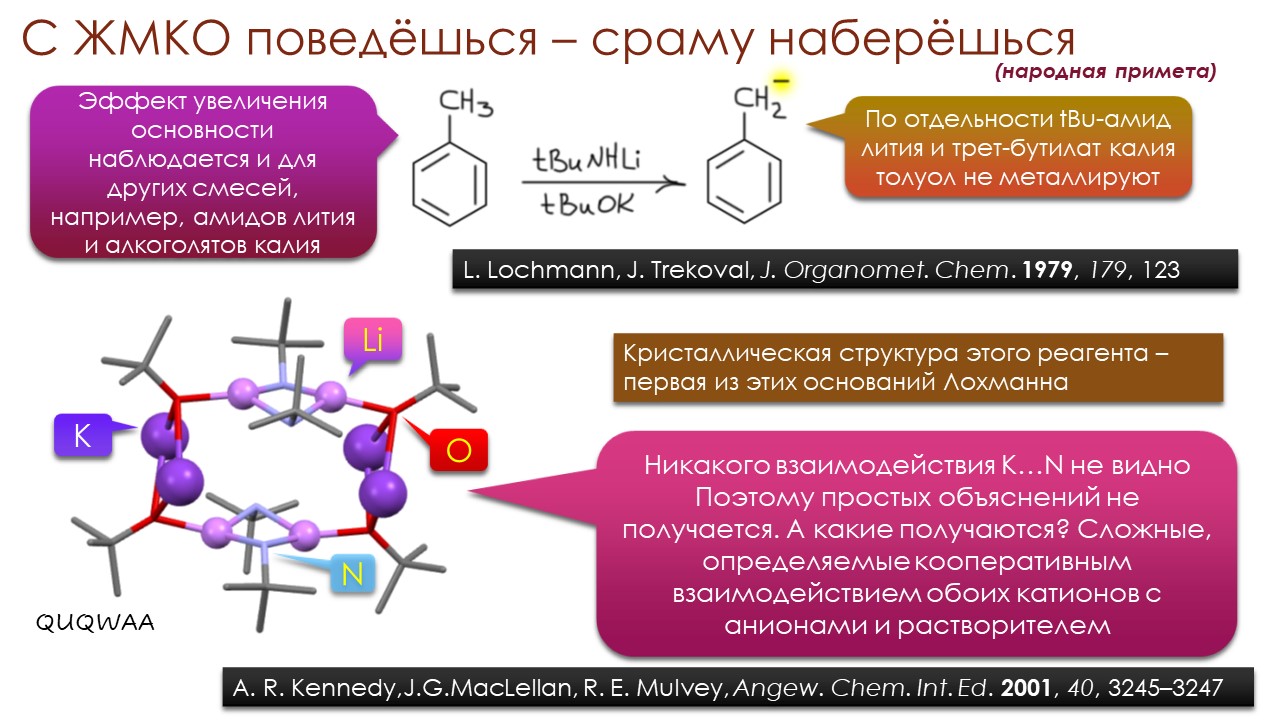
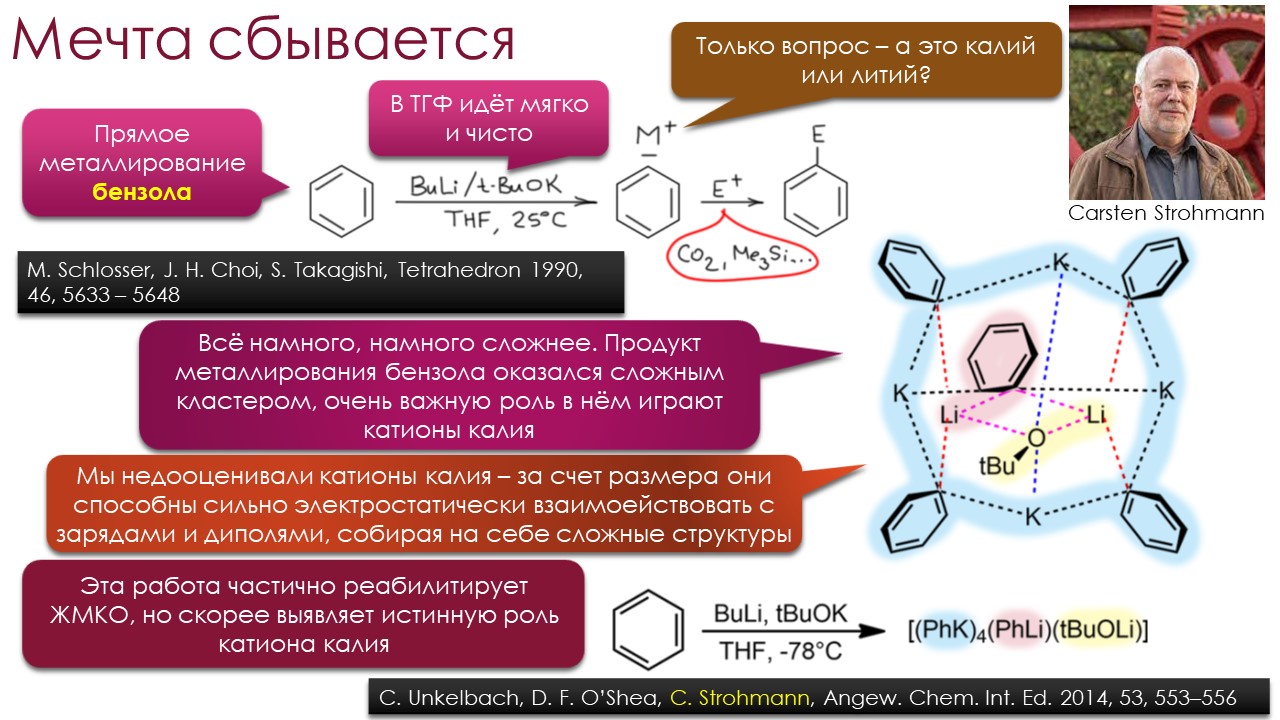
Это наблюдение вооружает нас начальным тезисом для этой лекции – самые сильные основания надо искать среди алкильных карбанионов, и тех реальных соединений, которые представляют их не на бумаге, а в колбе – литийорганических соединений типа метиллития и бутиллития. Разбираясь с тем, почему реальная основность этих незаменимых веществ явно сильно отстаёт от того, что мы ожидали бы от метильного или бутильного карбанионов, мы попадём в самый центр исследований и дискуссий о том, где в органической химии надо искать самые сильные основания и зачем это нужно делать. И немало удивимся тому, насколько сильно изменились представления о том, что определяет реальную основность.
В органической химии поиск сильных оснований почти неизменно крутился вокруг металлорганики s-элементов, щелочных металлов и магния. Магния – значит опять Гриньяр и гриньяры. Настаиваю на том, что реактивы Гриньяра давно пора сделать нарицательным и сократить до гриньяров с маленькой буквы, потому что нет органической химии без гриньяров. И с удовольствием обнаружим, что гриньяры не только не потеряли актуальности, но и прямо засияли заново, даже и заставлять не надо было, настолько много важного и интересного нашли про эти соединения, и настолько дальше уехала их химия. Не забывайте про гриньяры – теперь их можно делать из таких соединений, про которые еще недавно и не подумали бы, а уж применений у этой металлоорганики меньше не становится.
И напоследок затронем еще одну интересную тему – обязательно ли искать очень сильные основания среди анионных частиц, то есть сопряжённых оснований очень слабых протонных кислот. А нейтральные молекулы? Мы давно упёрлись в амидины (типа ДБУ и метилированного гуанидина), которые сильны и очень полезны, но только не смогут депротонировать даже терминальные ацетилены. Или есть что-то нейтральное посильнее? Есть, есть, и это очень живая и перспективная химия, грозящая важными достижениями.
А почему лекция так называется? А потому что в отличие от кислот, где мы воспаряем в выси, основания как-то даже по названию не располагают к полёту. Это очень интересно, но так даже с точки зрения языка получилось, что здесь мы прочно стоим на основании, основание всегда внизу, на основание можно опираться, и оперевшись уже ворочать химию дальше. Само это слово придумали (опять французы) в самом начале 18-го века, когда только начало появляться нечто похожее на науку химию, когда стали понемногу разбираться в веществах, находить закономерности их образования, и обнаружили, что очень много веществ образуется при взамодействии кислых веществ (кислот, кислое легко опознать и не потерять, доставая откуда-нибудь) и разных твердых минеральных веществ, щелочей или других земель – поэтому ранним химикам и показалось, что эти вещества, соединяющиеся с кислотами есть основа, основание солей. И мы ведь и сейчас не очень будем с этим спорить.
Основа, основание всегда снизу. Чем основнее, тем получается не выше, а ниже. И как гласит сильно надоевшее высказывание знаменитого польского афориста Ежи Леца про дно, стоит нам найти самое нижнее, как снизу стучат. Видимо, ещё более сильное основание там нашли, решили предложить. Ну не будем отказываться. Химия едет дальше. Так ведь и метан однажды сможем препаративно депротонировать.