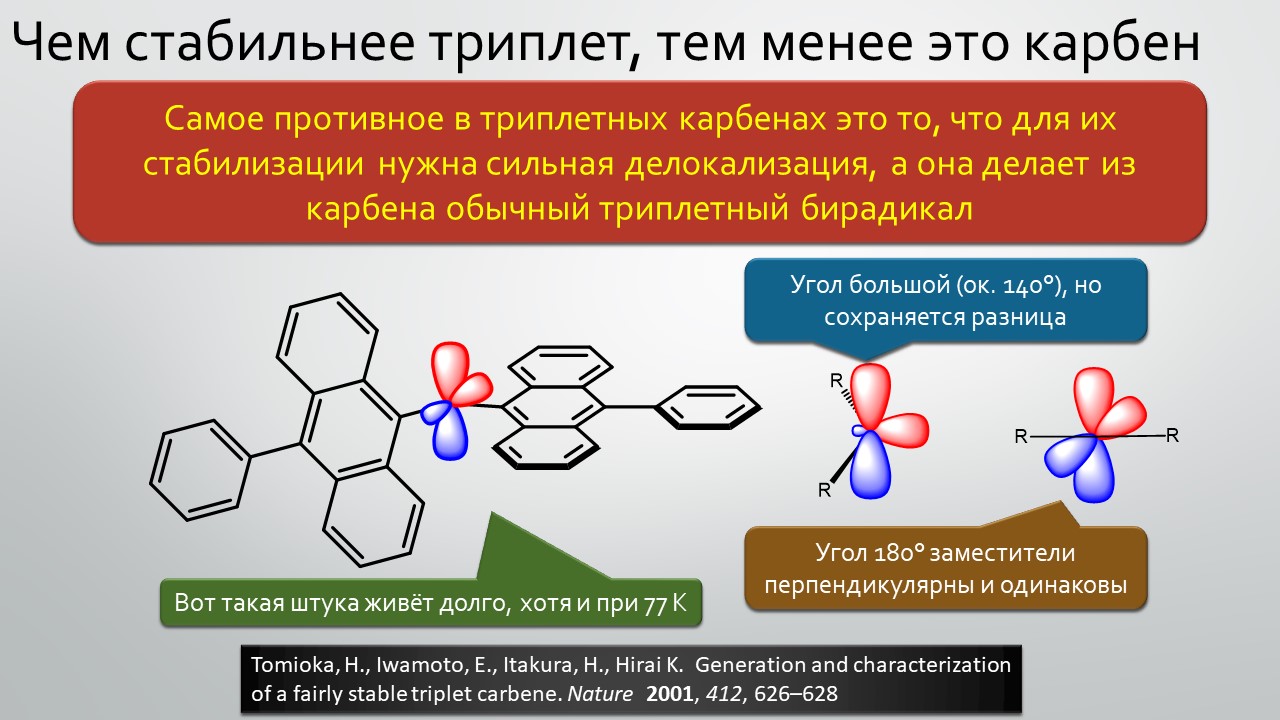
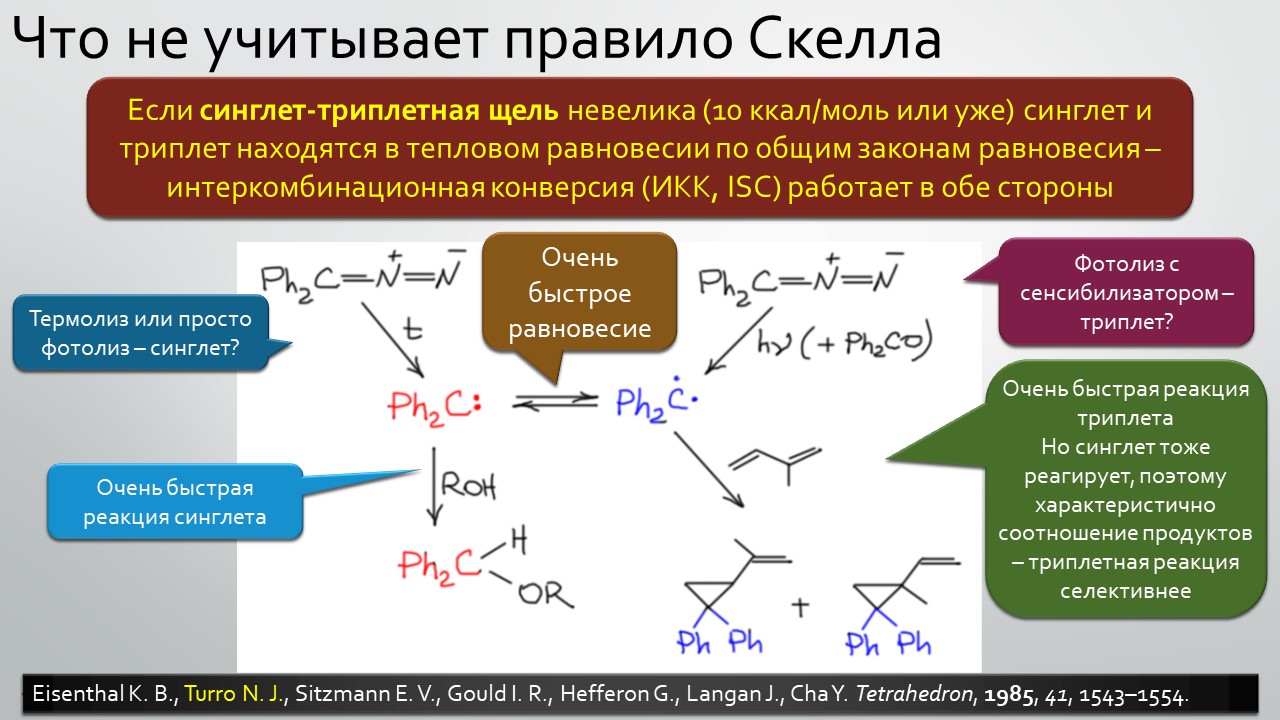
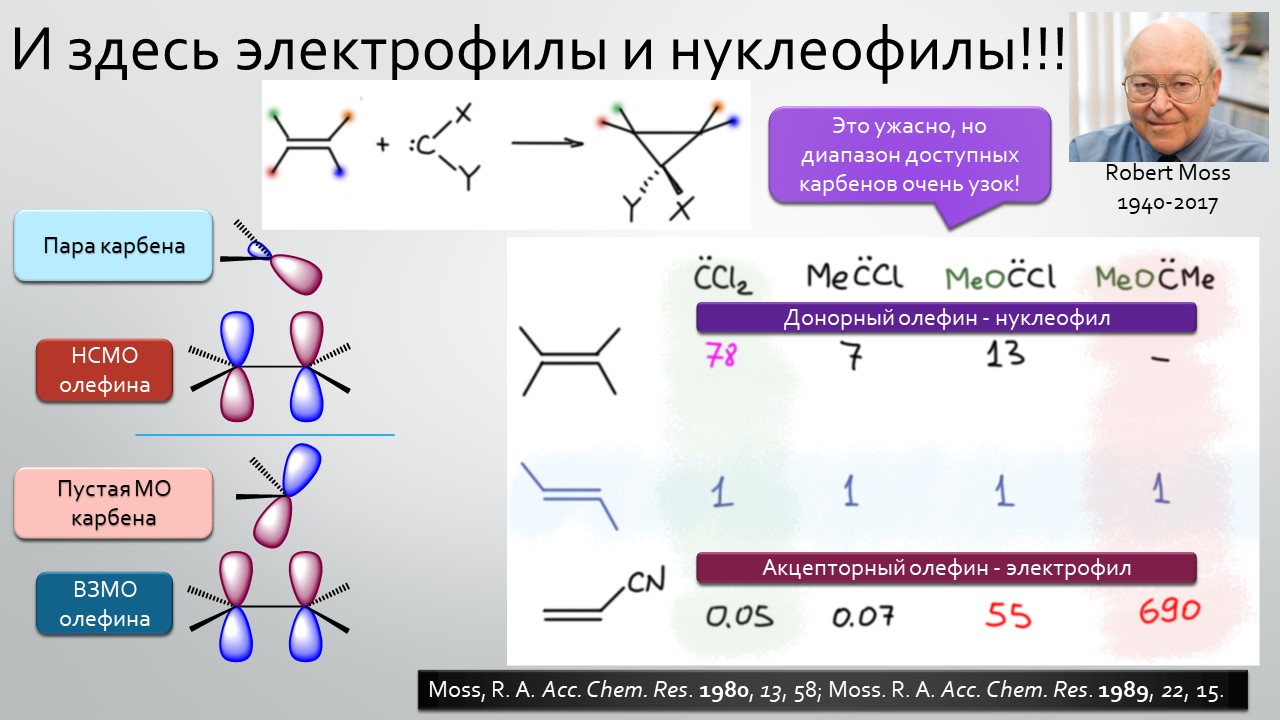
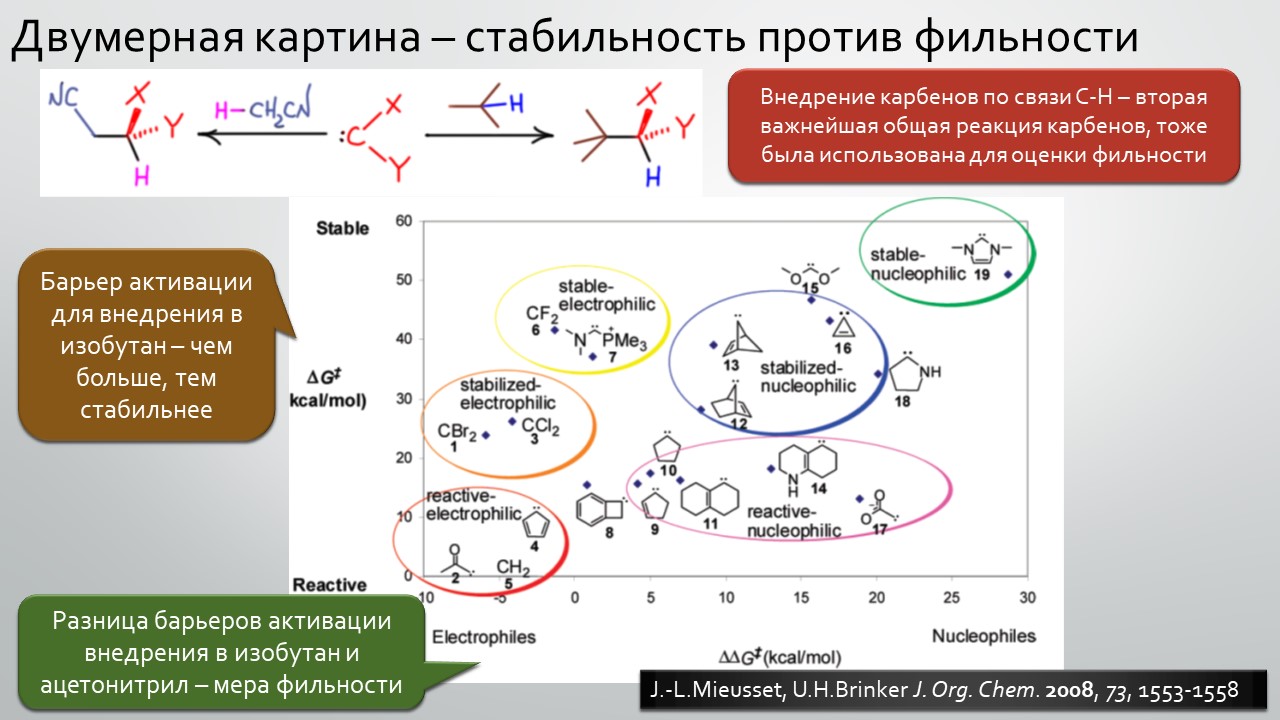
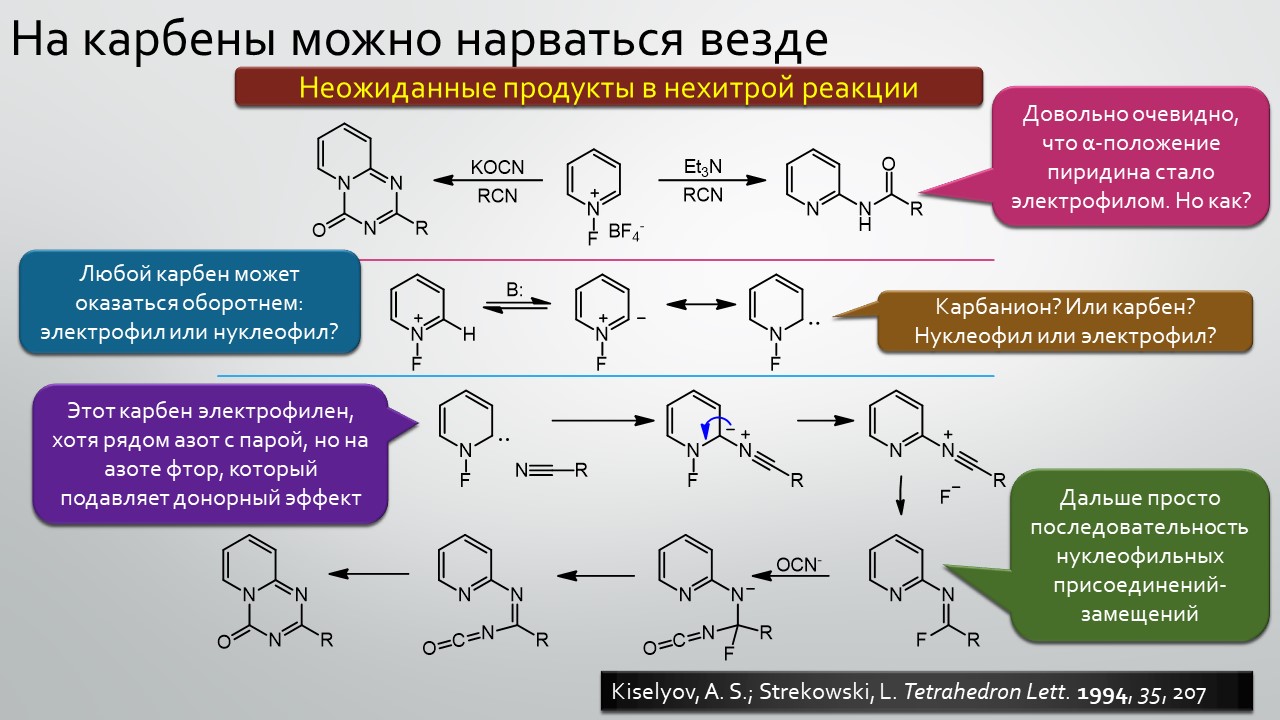
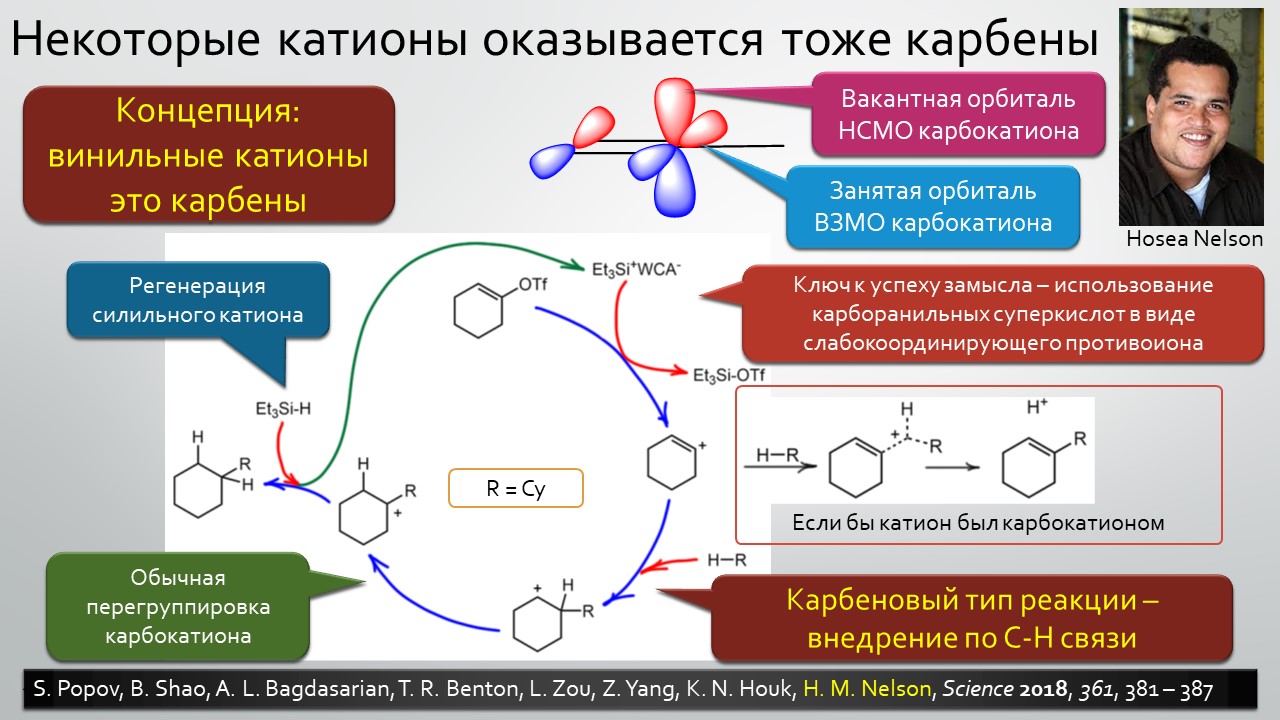
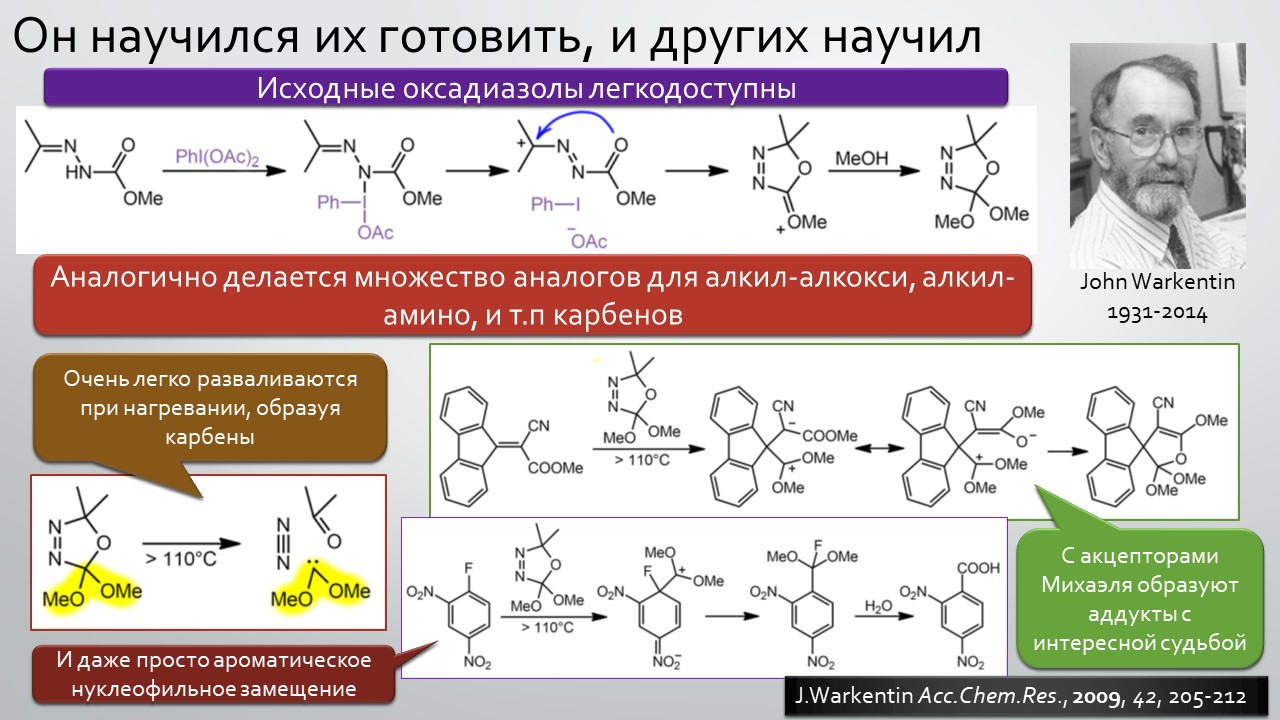
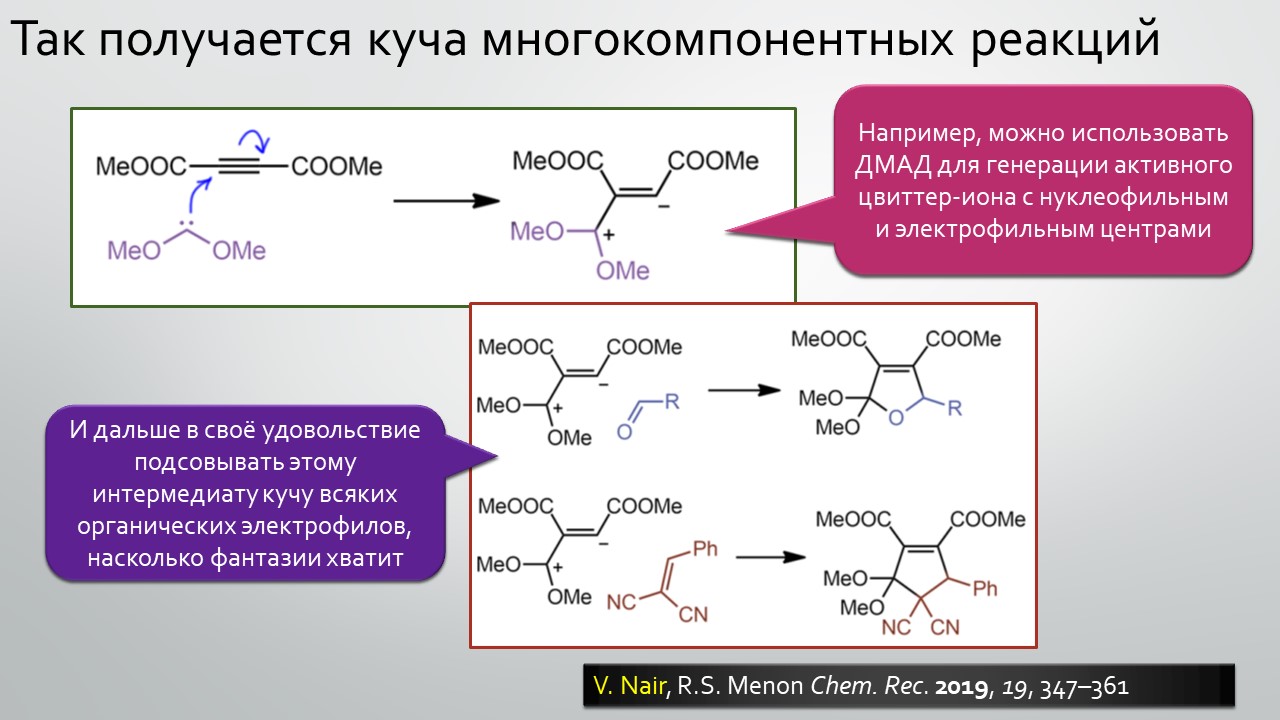
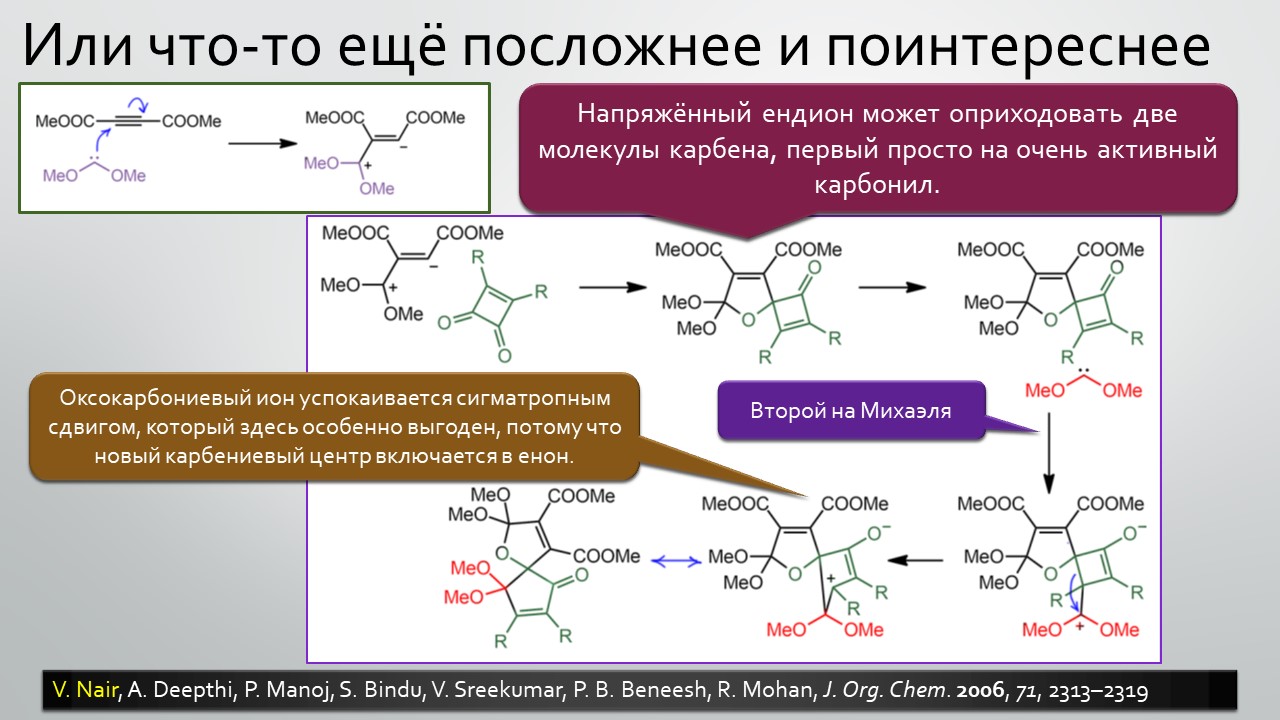
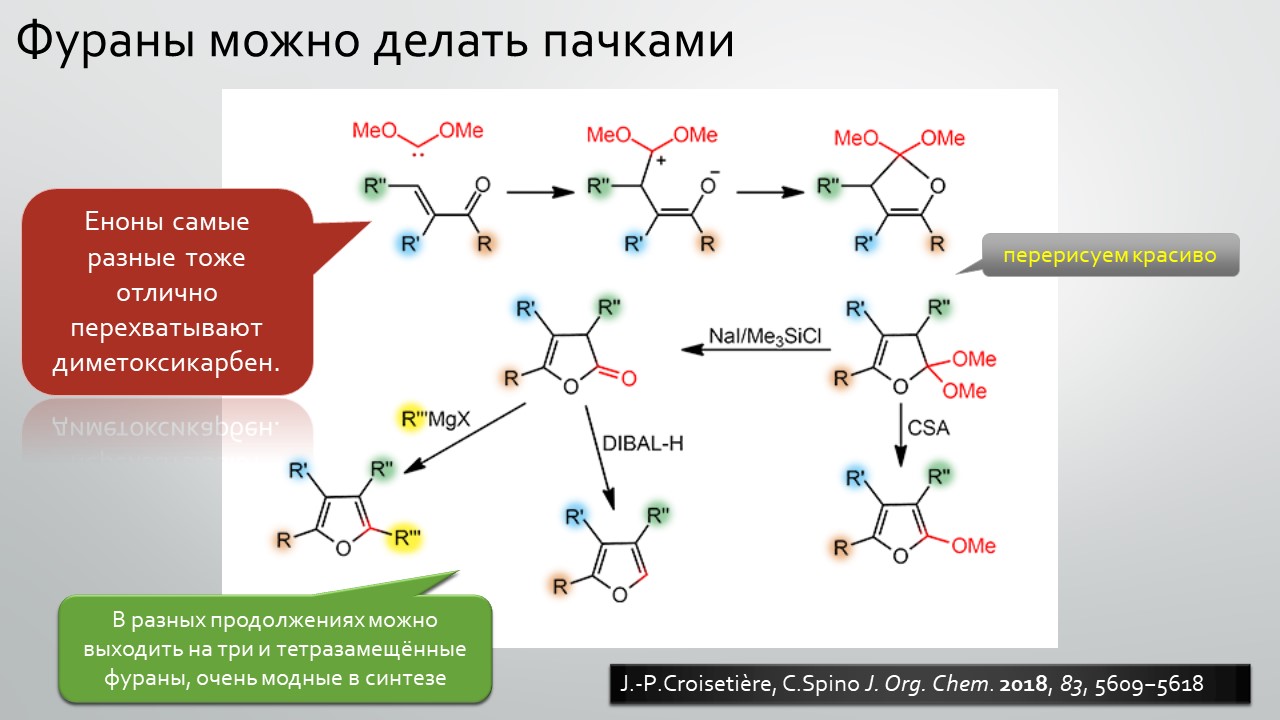
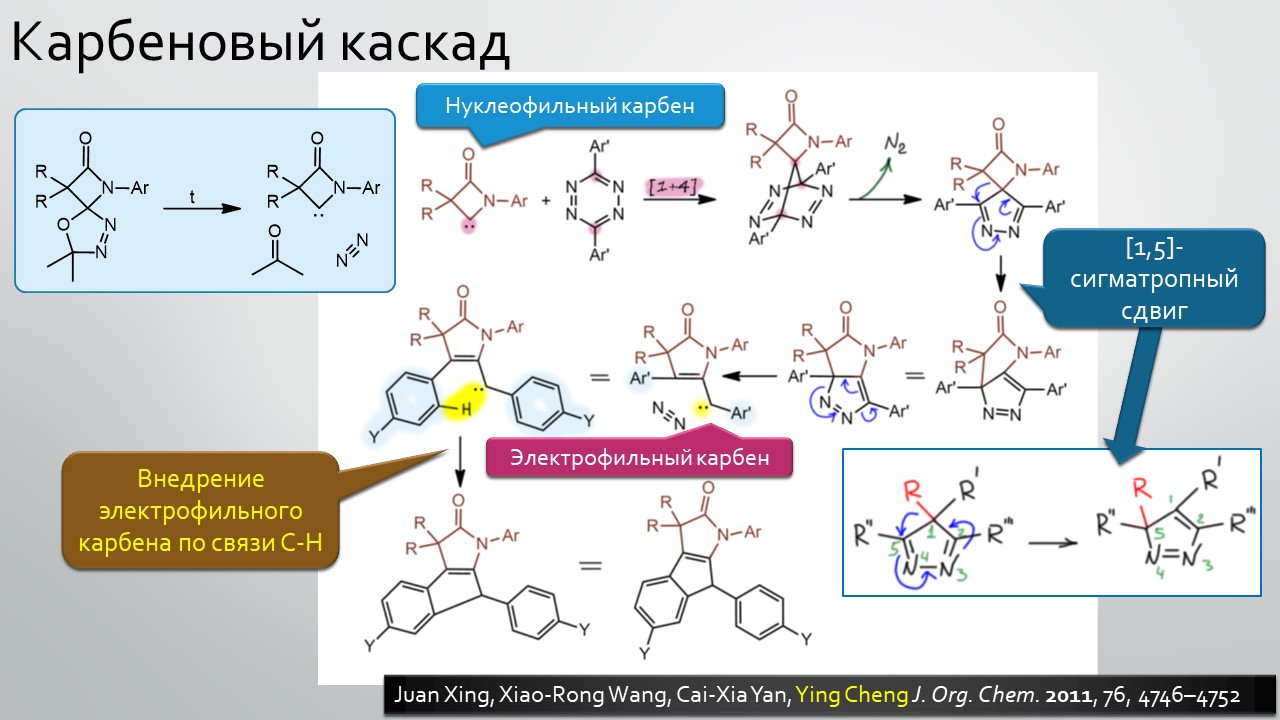
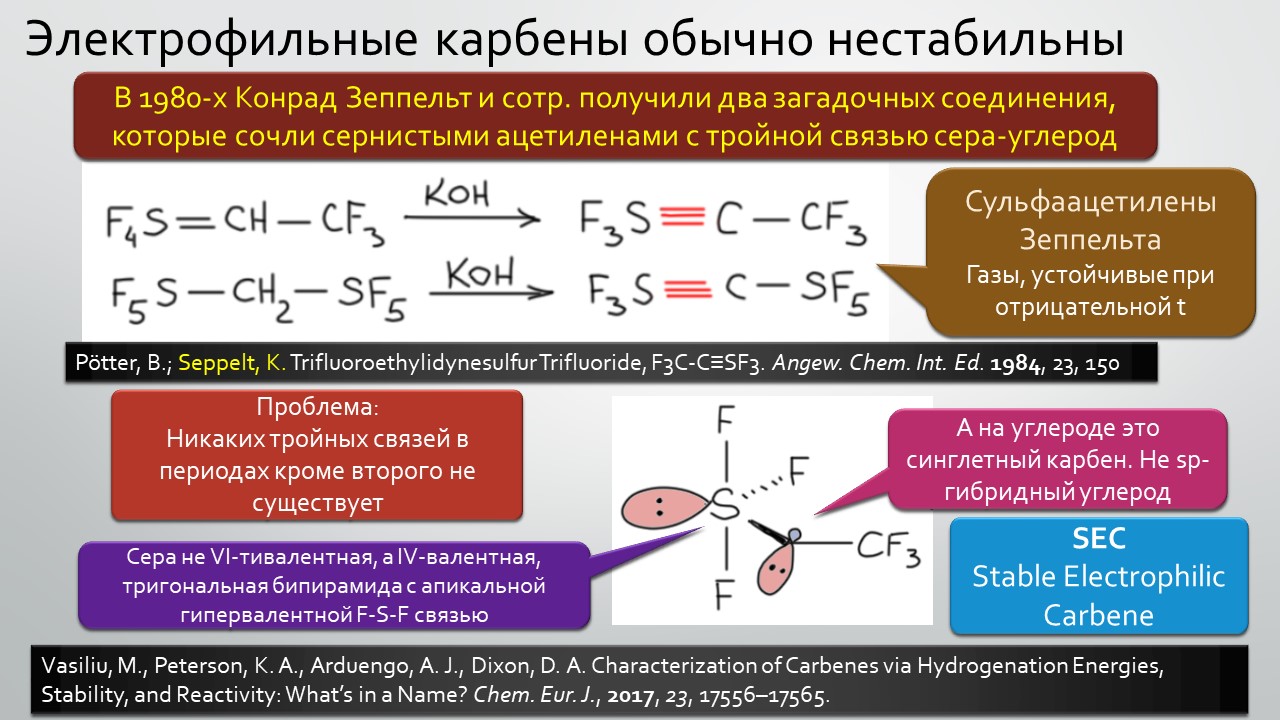
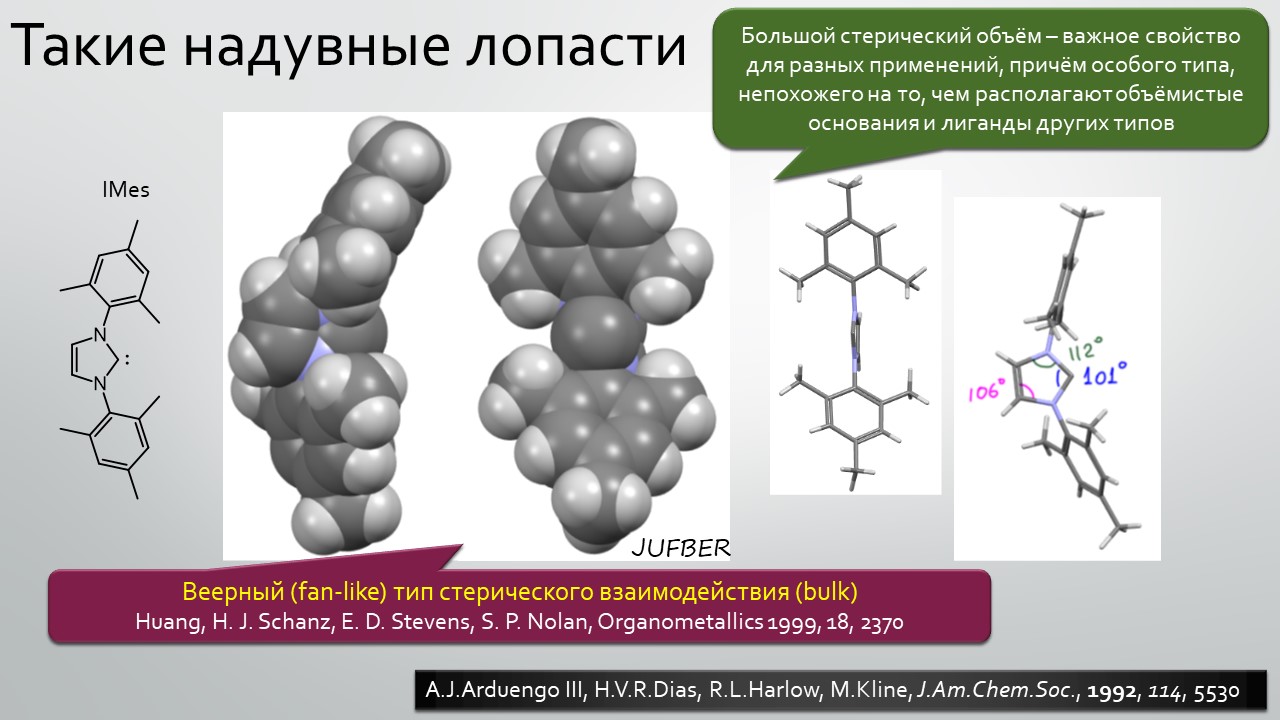
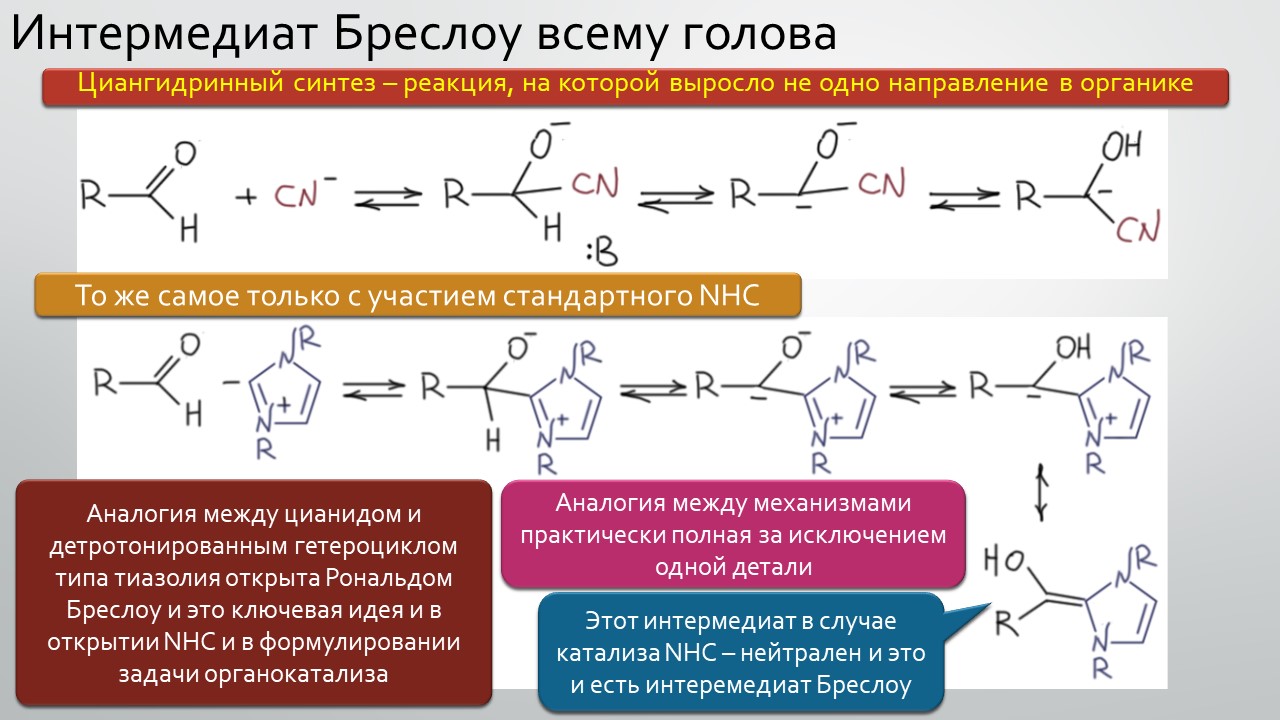
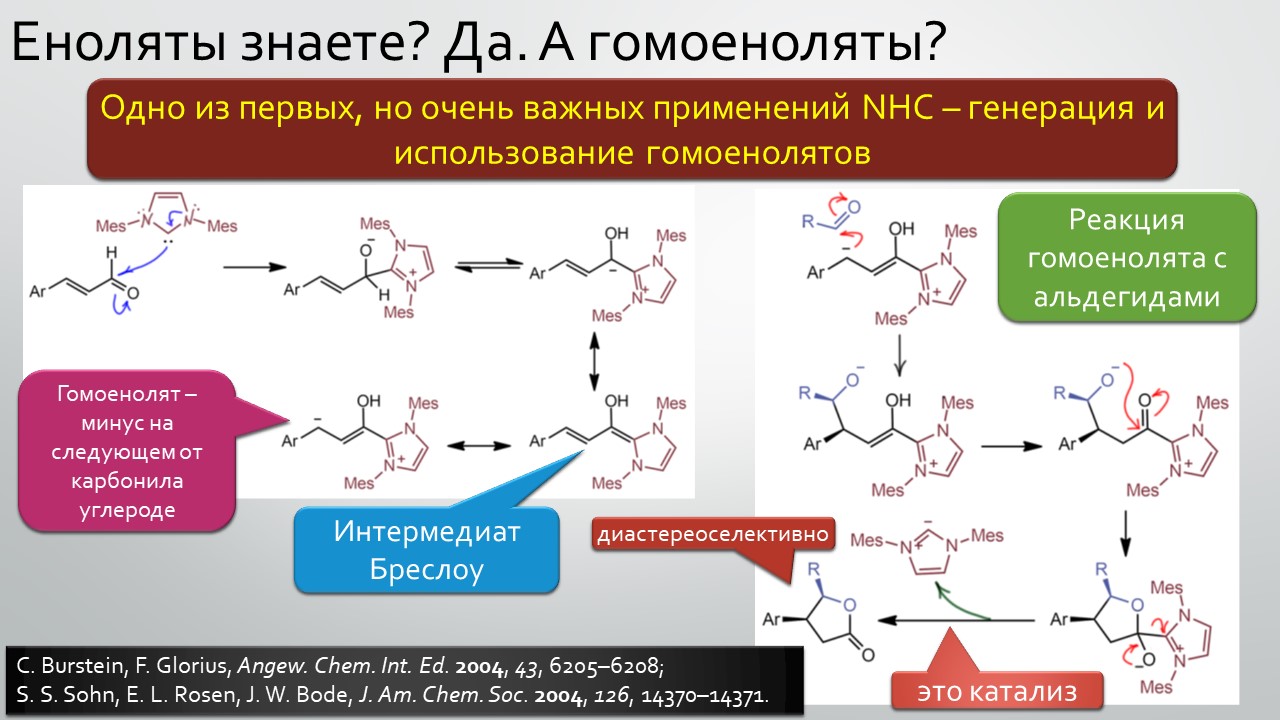
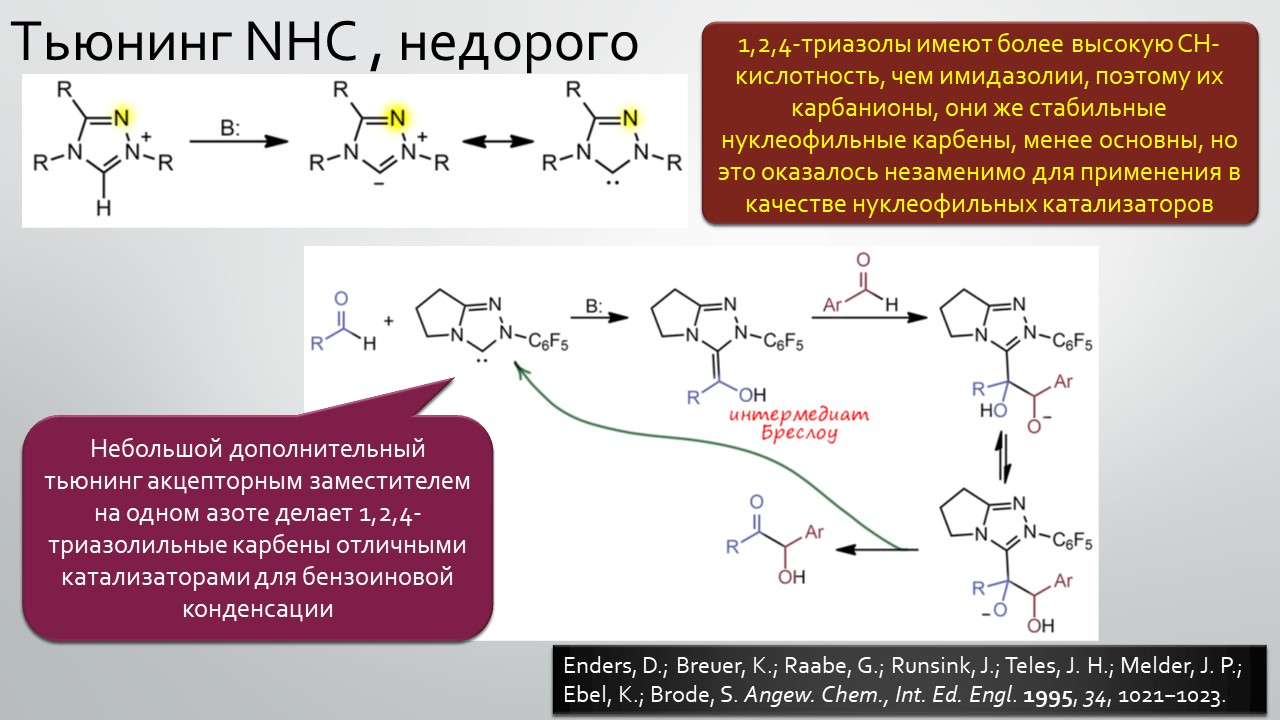
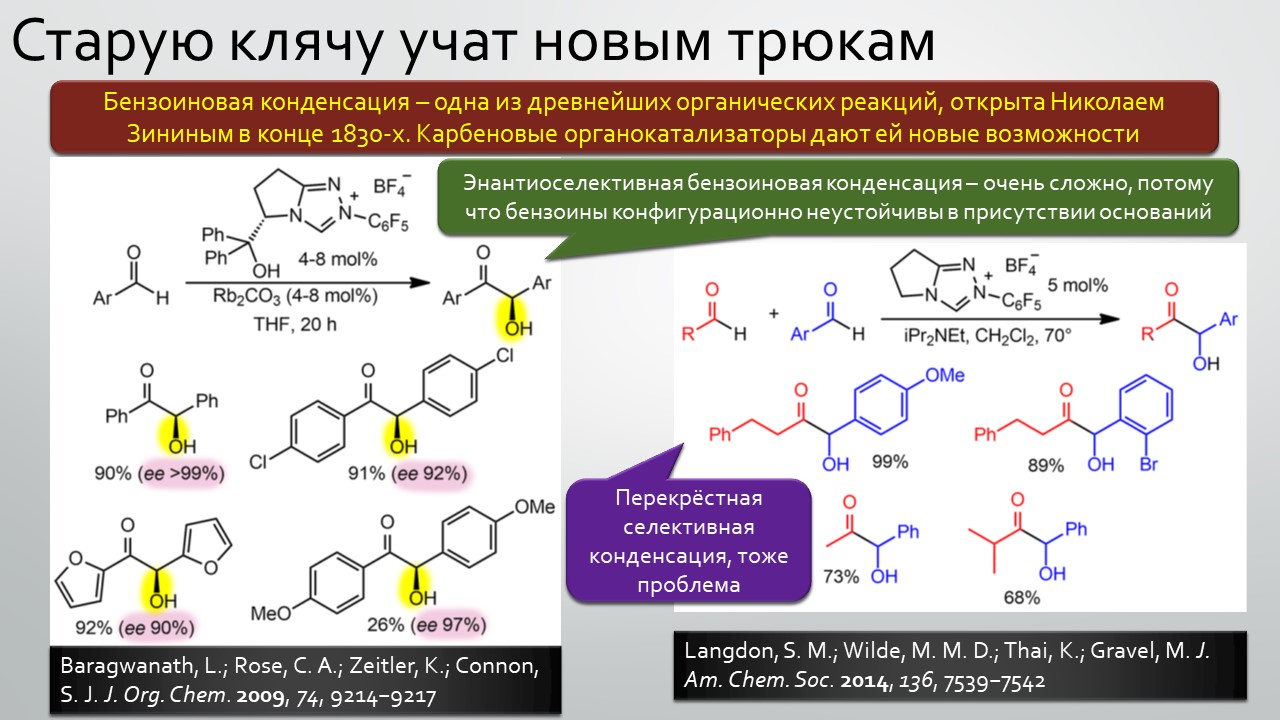
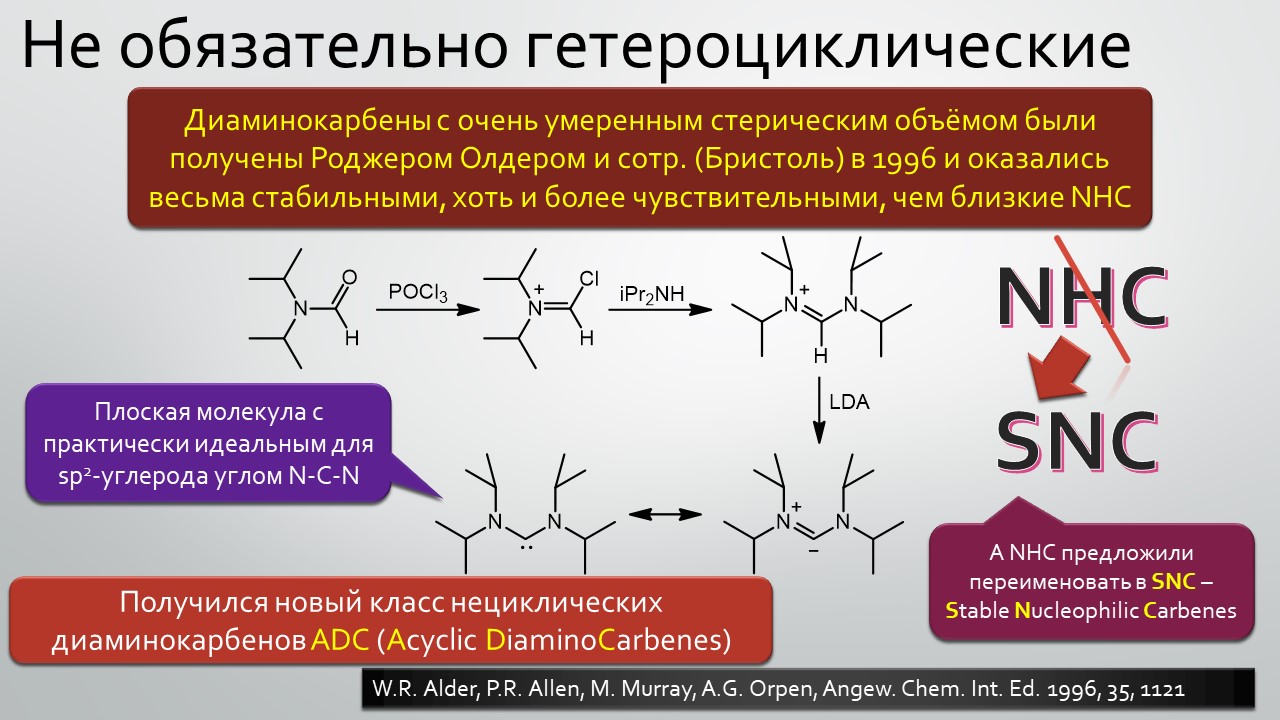
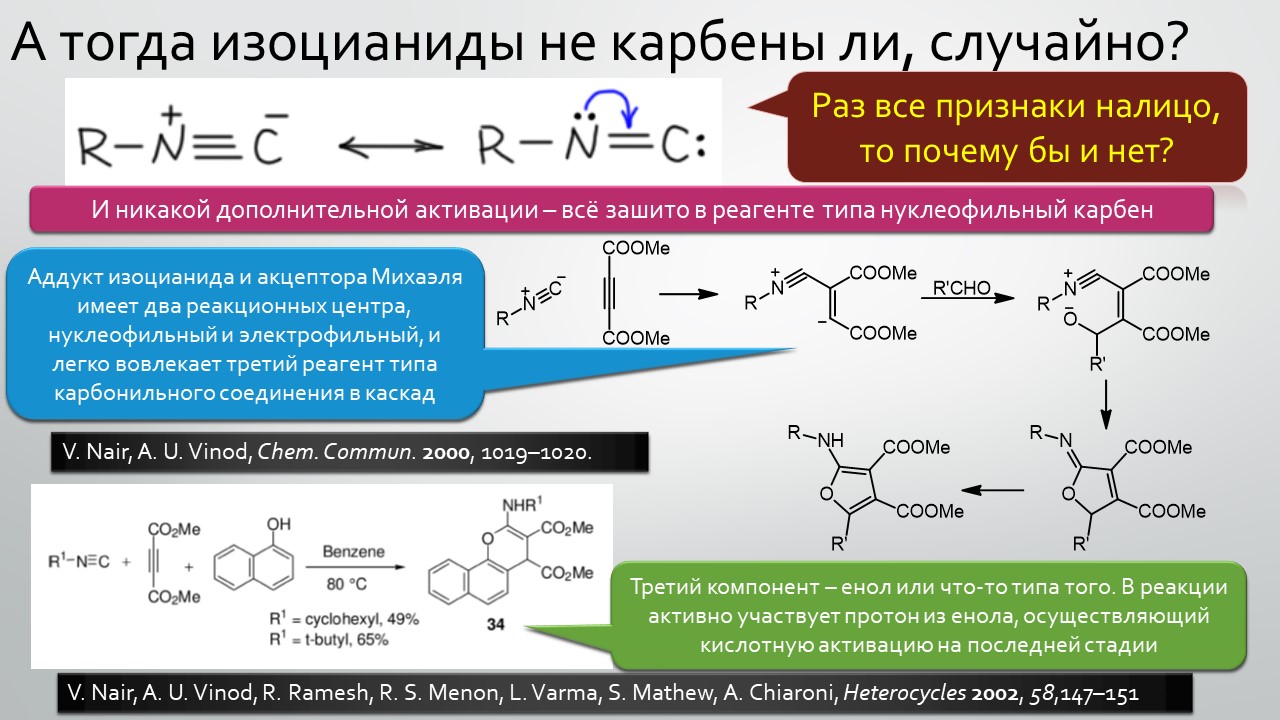
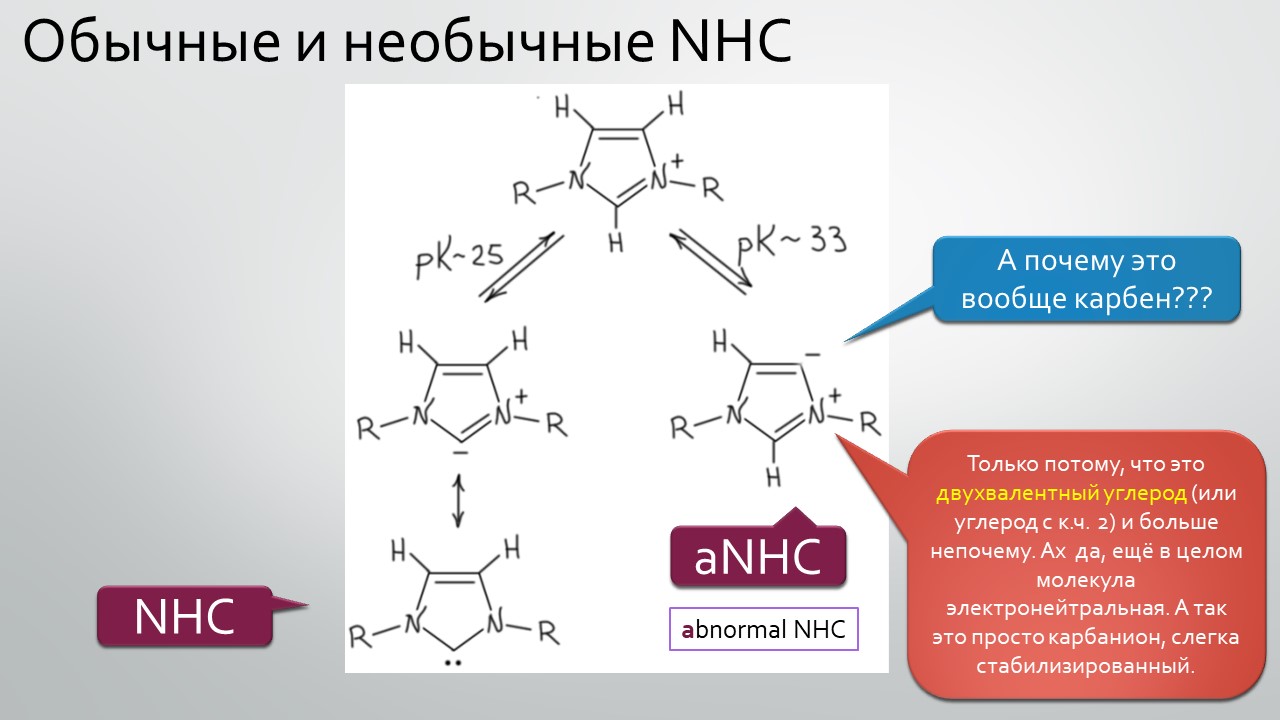
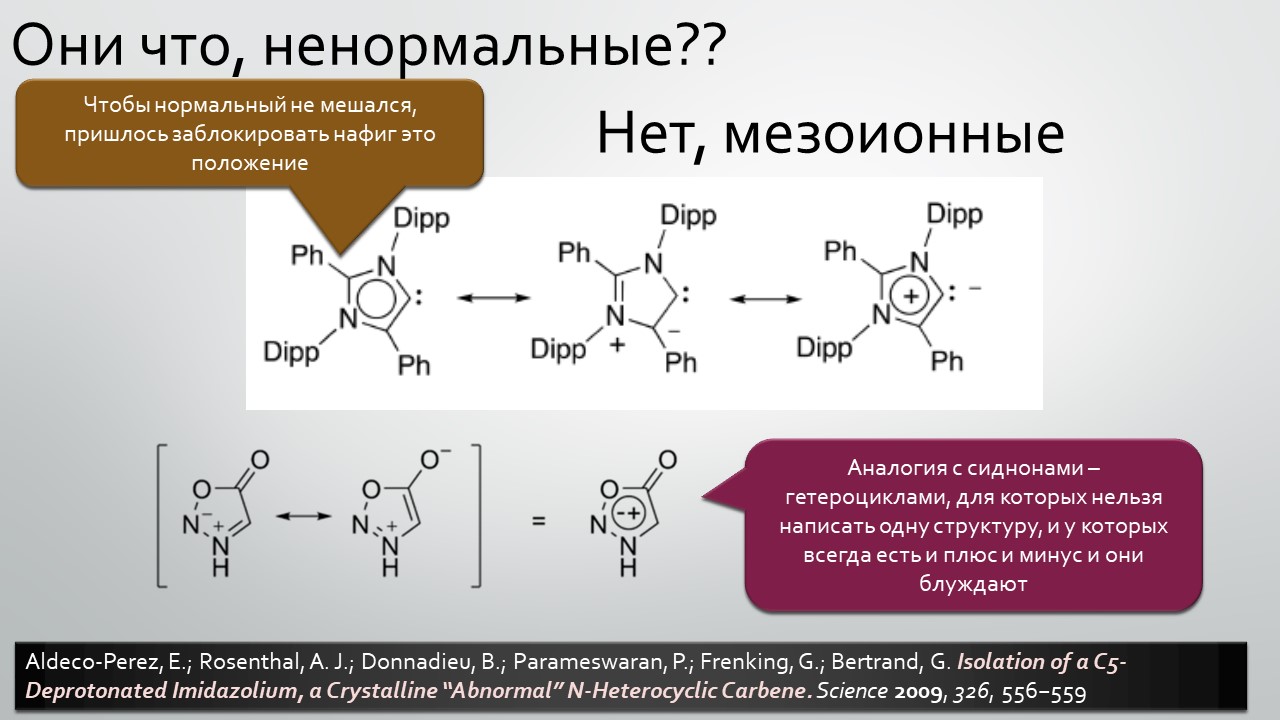
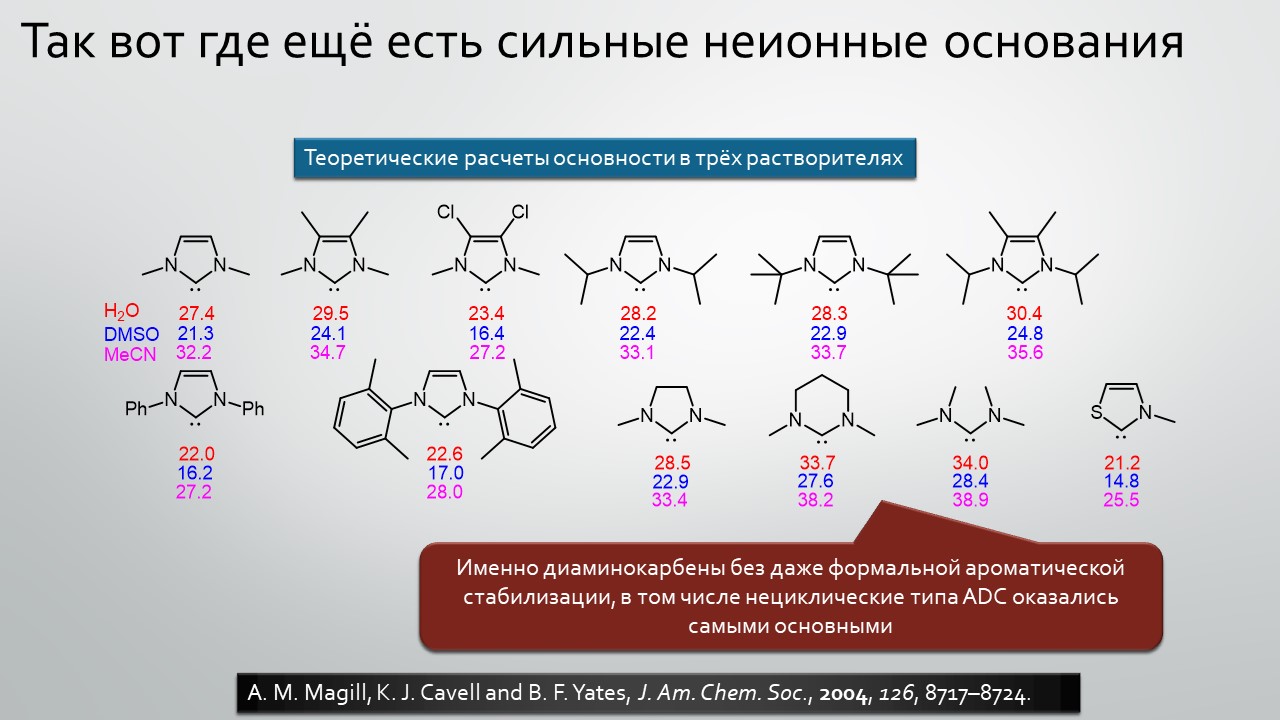
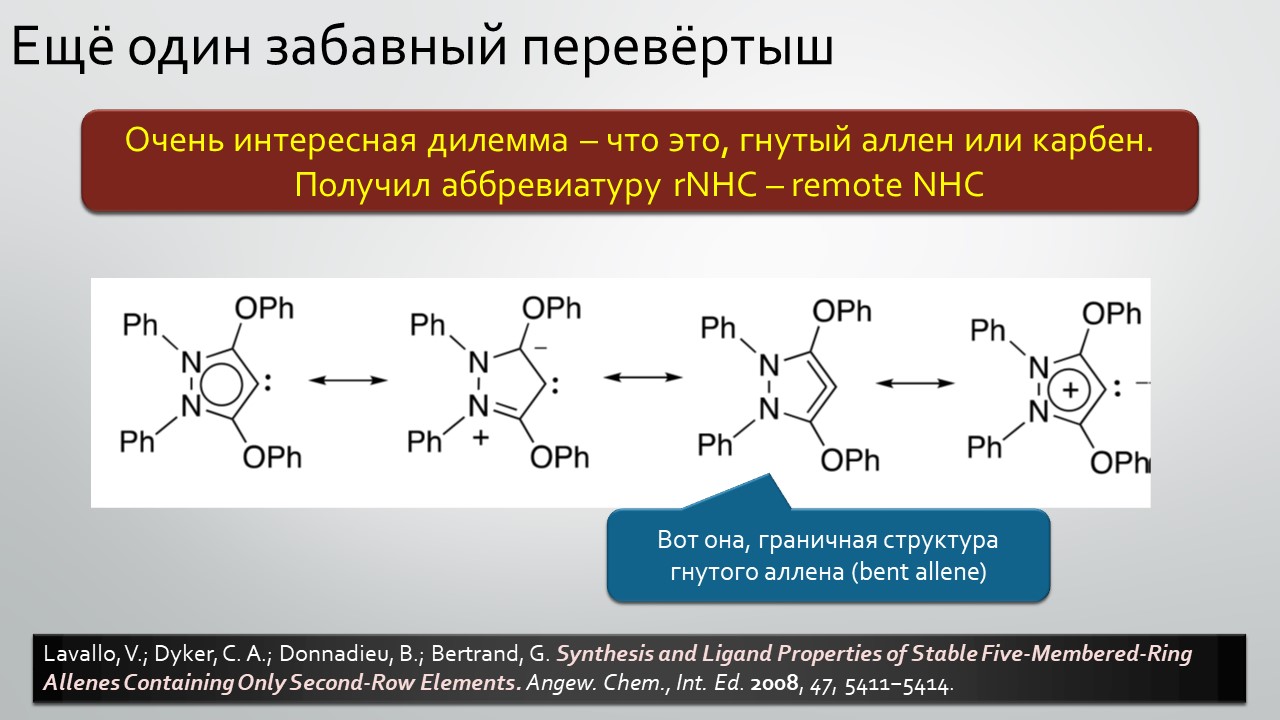
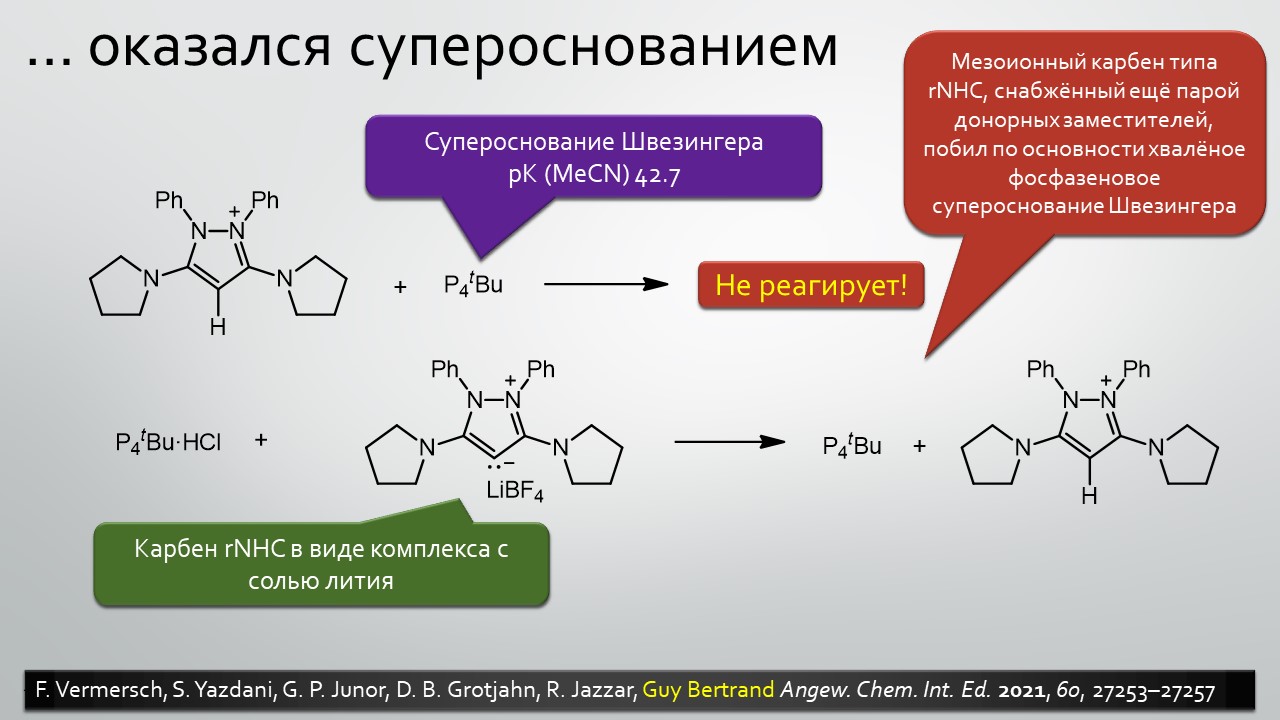
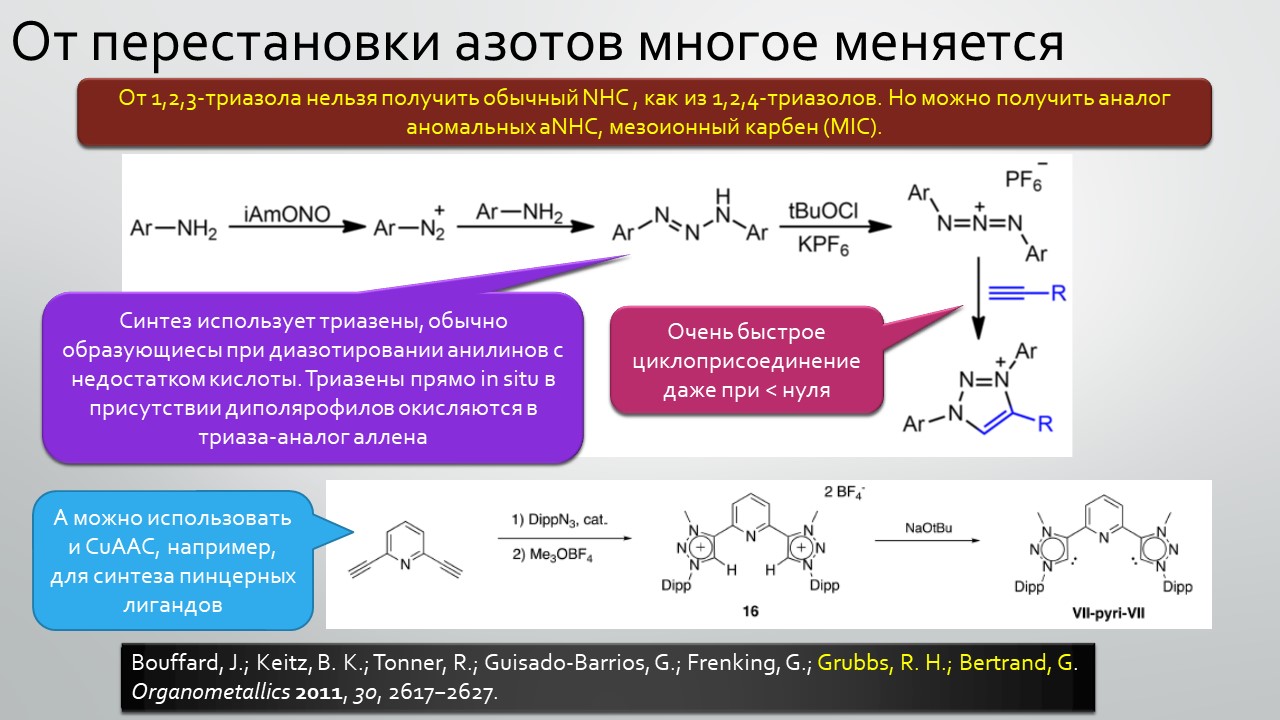
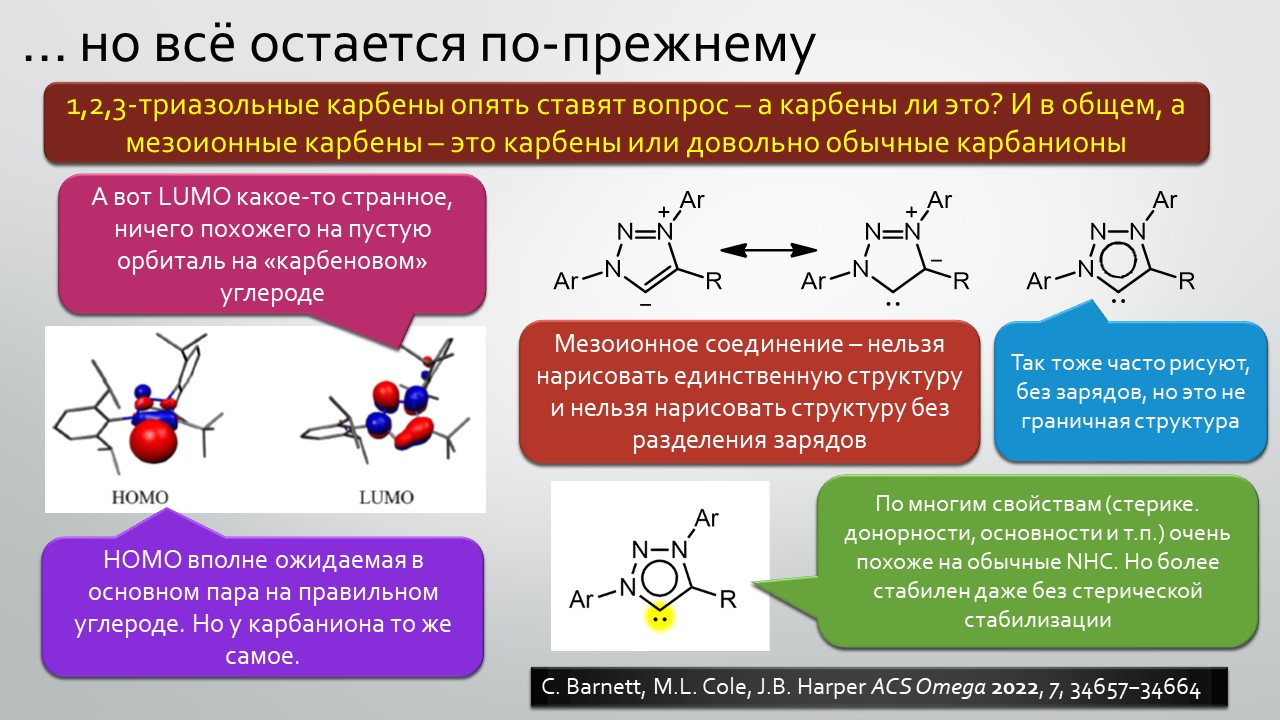
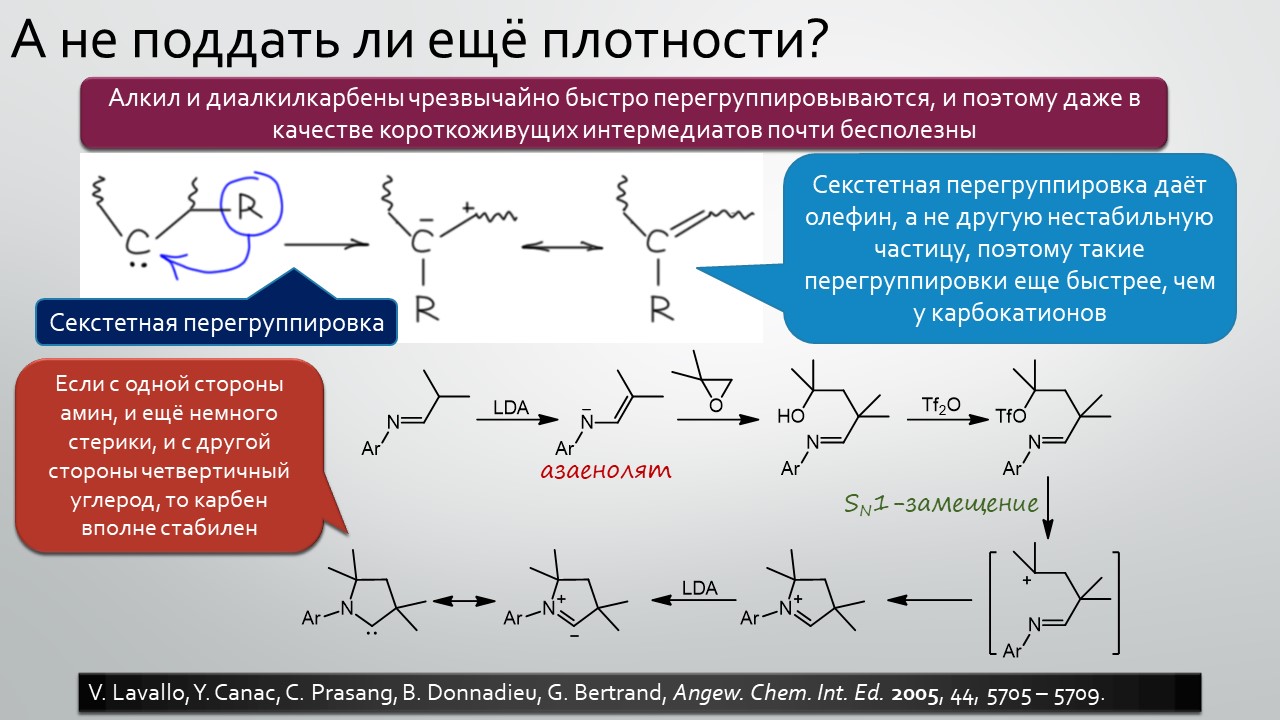
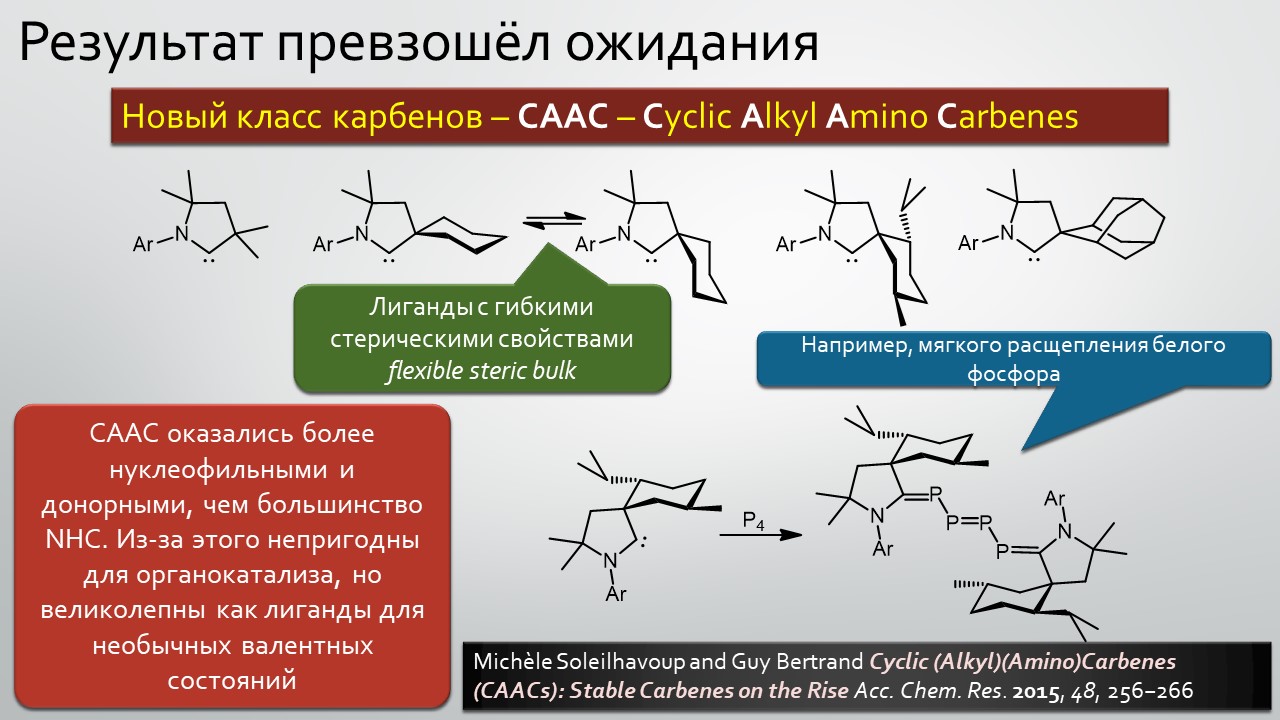
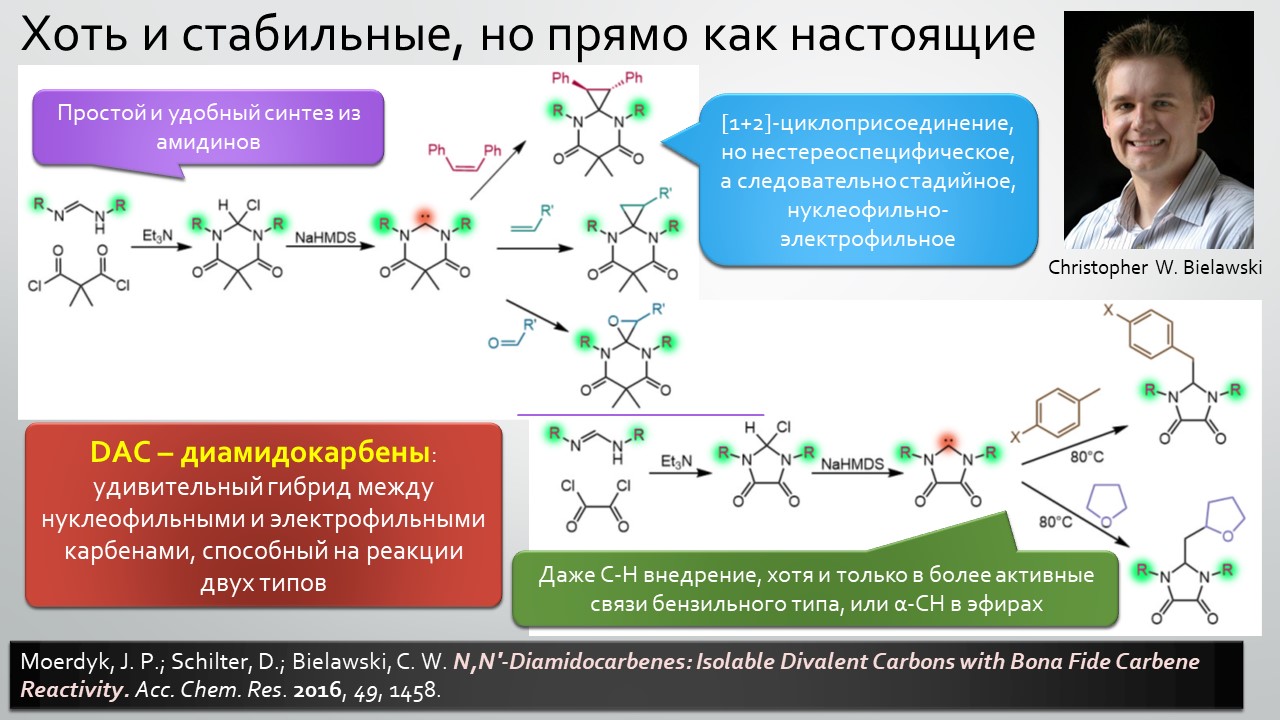
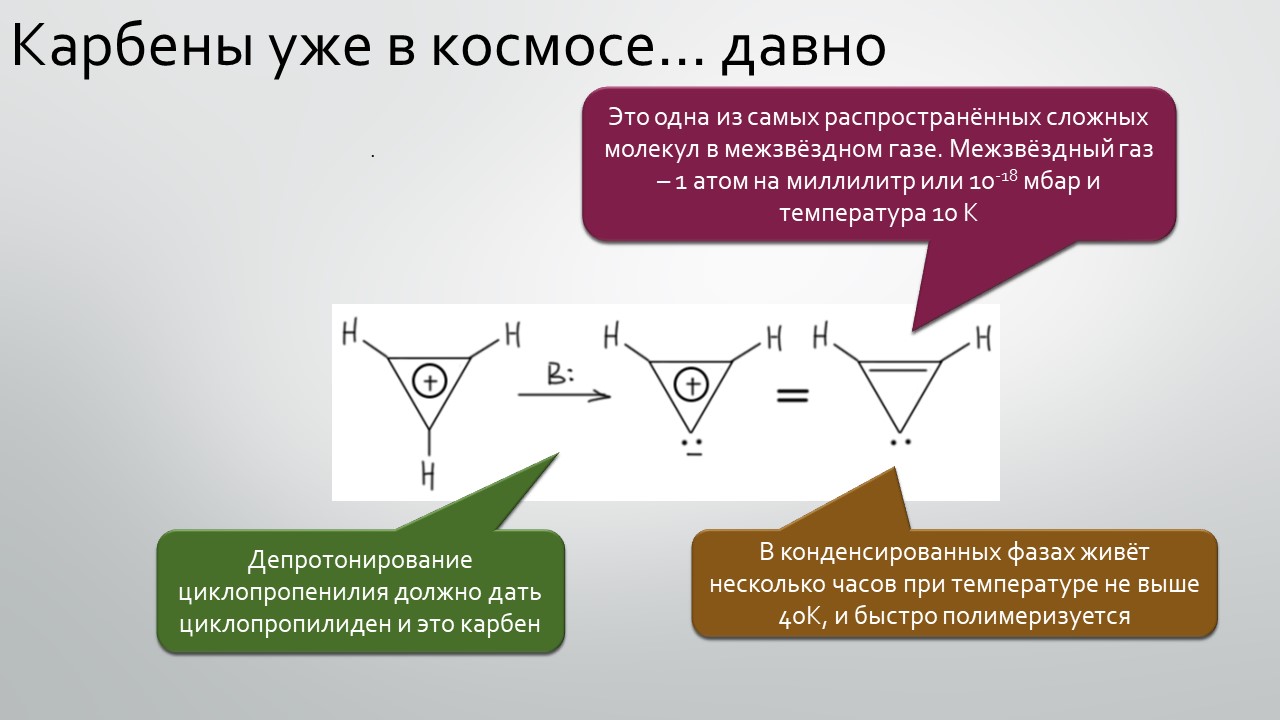
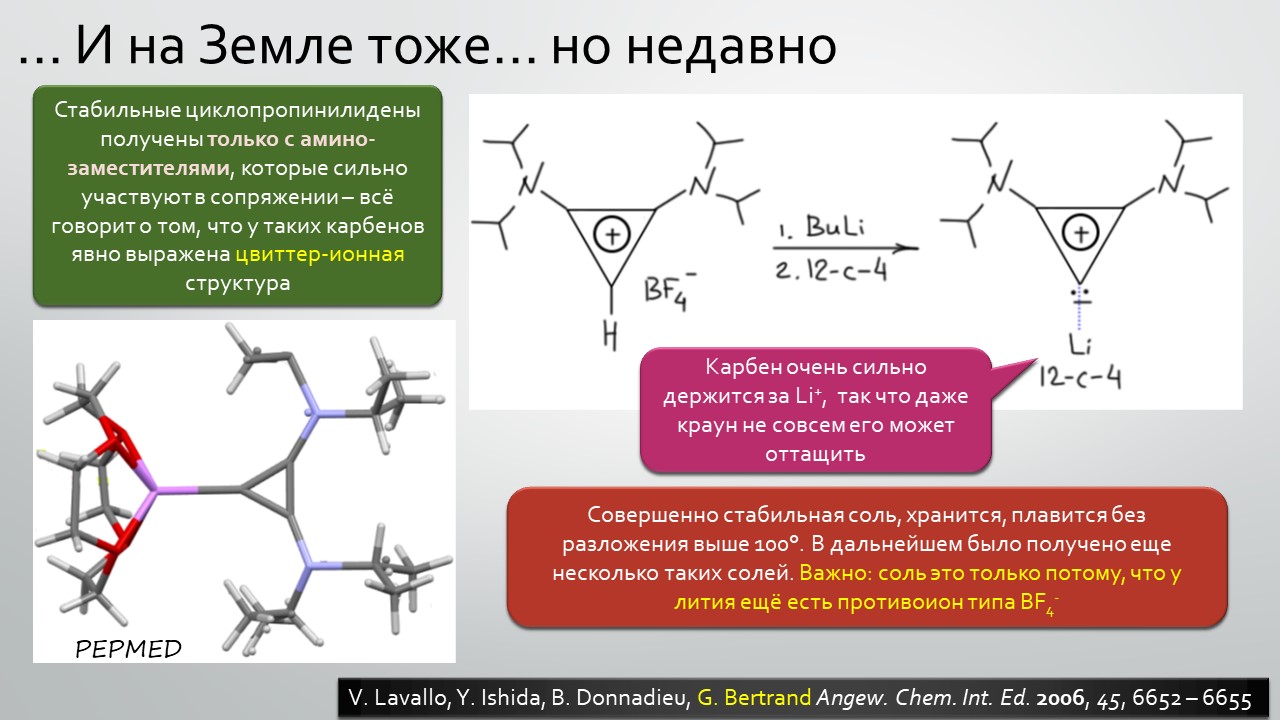
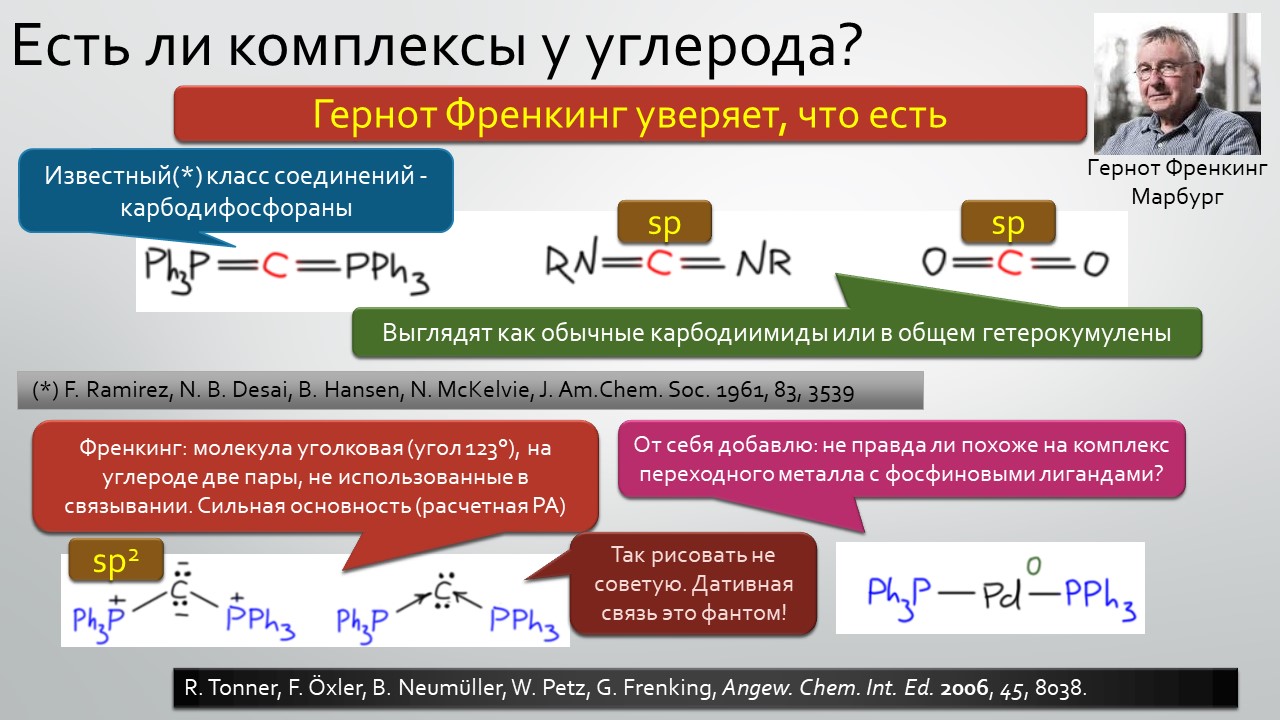
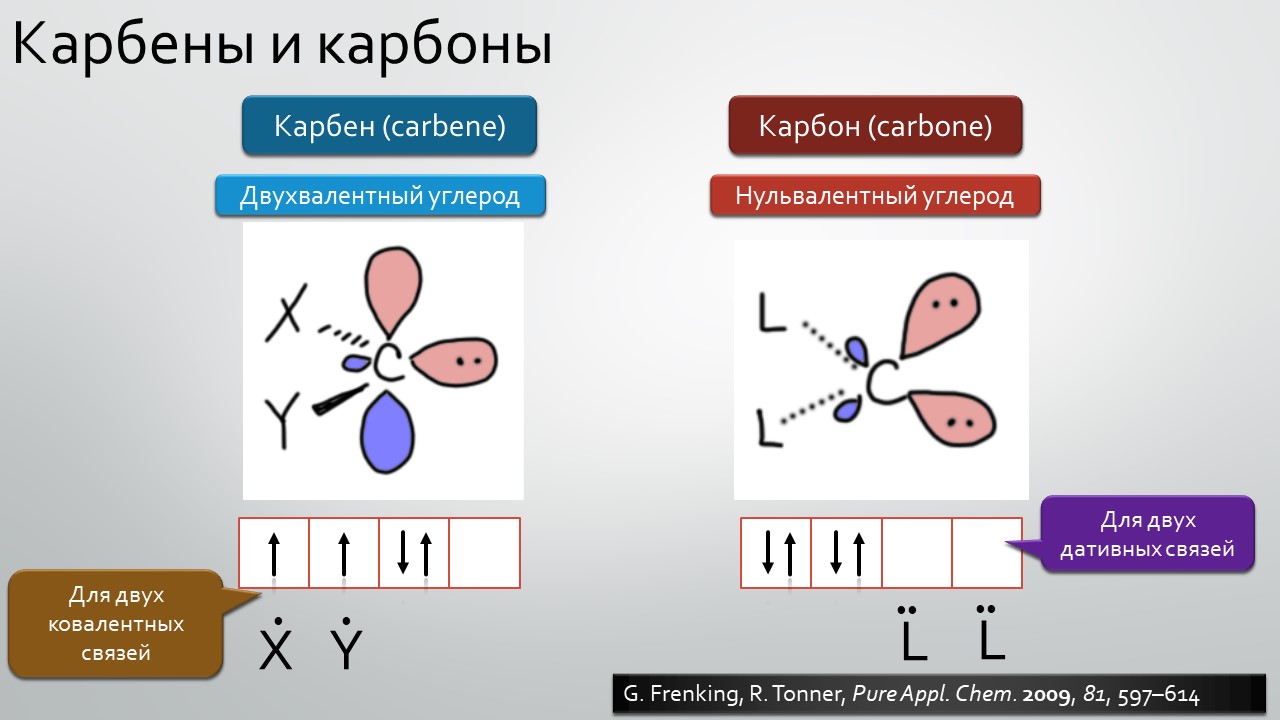
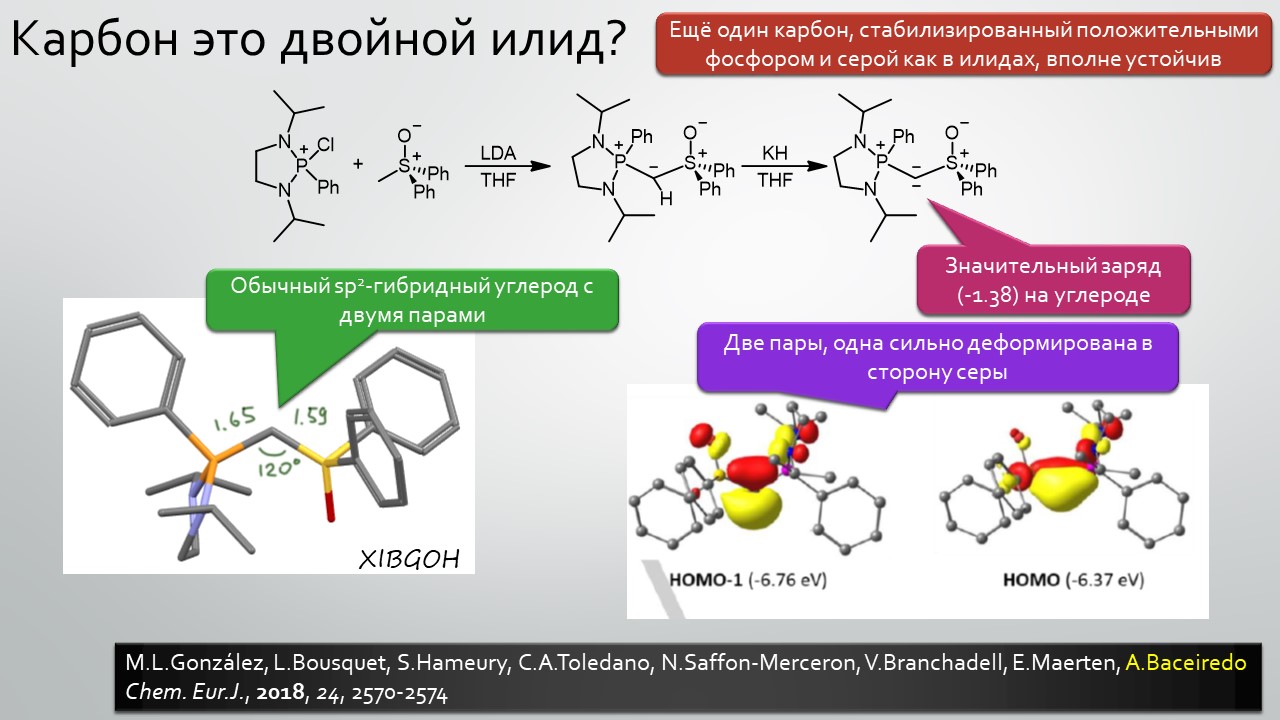
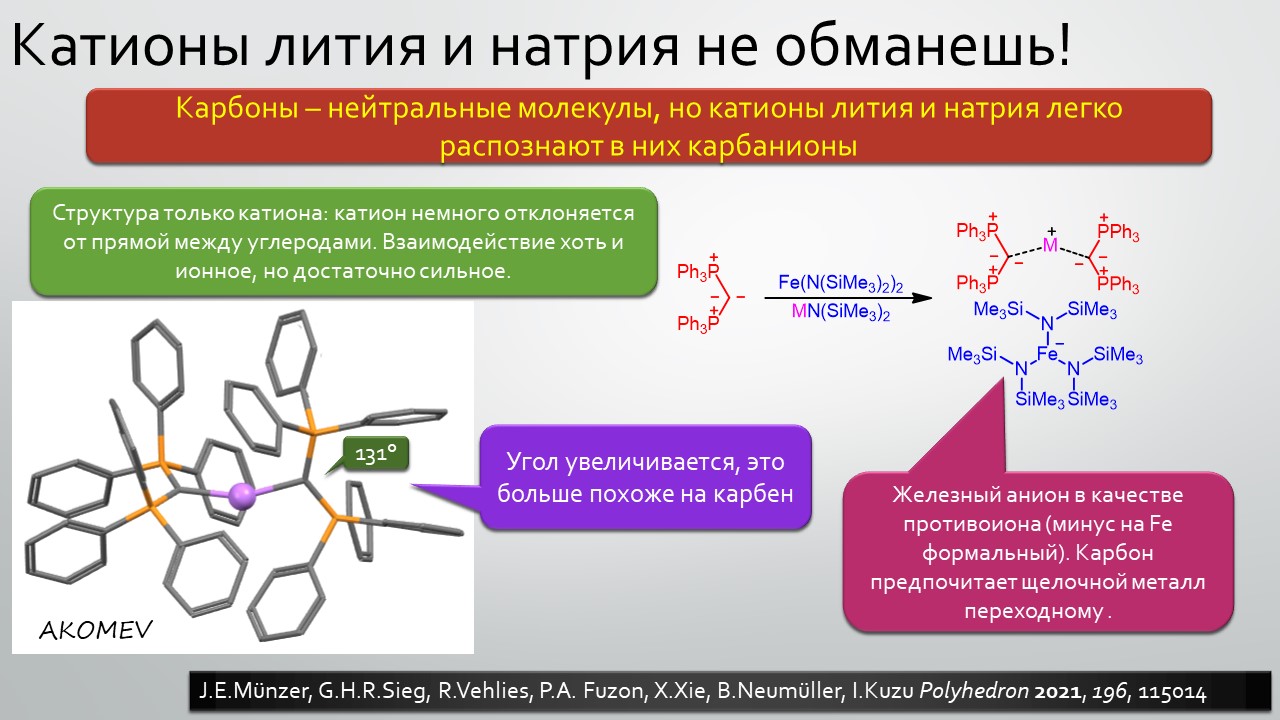
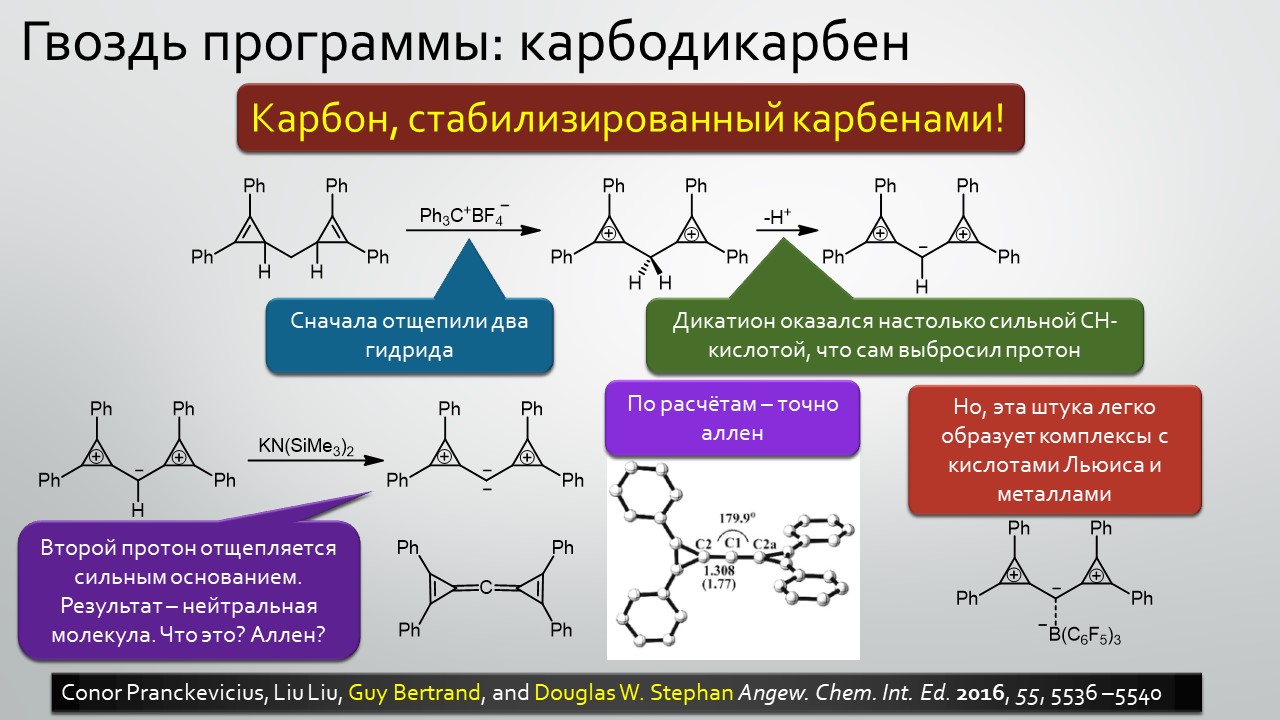
Последние станут первыми?
Среди четырёх основных типов реакционноспособных интермедиатов в химии углерода карбены – последние. Не по значению, а по времени появления на свет. Хотя ещё во времена Бутлерова и Франкланда химики искали простые производные двухвалентного углерода кроме угарного газа, и пытались найти начало ряда олефинов в метилене, безуспешно пытаясь получить или это соединение или дихлорпроизводное, из этого ничего не вышло, гидрид и галогениды двухвалентного углерода остались неизвестными. Поиски немного взбодрились после открытия диазометана и переоткрытия этого страшного соединения великим немецким химиком Штаудингером, рядом с которым мы уже не первый раз оказываемся. Штаудингер тяготился временем, в которое ему пыпало судьбой работать и постоянно хотел убежать вперёд, лет на 50 хотя бы. Он очень верно понял, где надо искать свободный метилен, и фактически доказал его образование, но увы, в начале 20 века превратить блестящий по замыслу эксперимент в более твердое знание было невозможно. Штаудингеру повезло прожить долгую жизнь, хоть это и было связано с крайним неудобством быть свидетелем безумия собственной страны и нации, но он всё пережил, дожил до настоящего открытия карбенов и как раз тогда и получил свою нобелевскую премию как основоположник и пророк химии высокомолекулярных соединений, ну и за коллег порадовался, доделавших его дело.
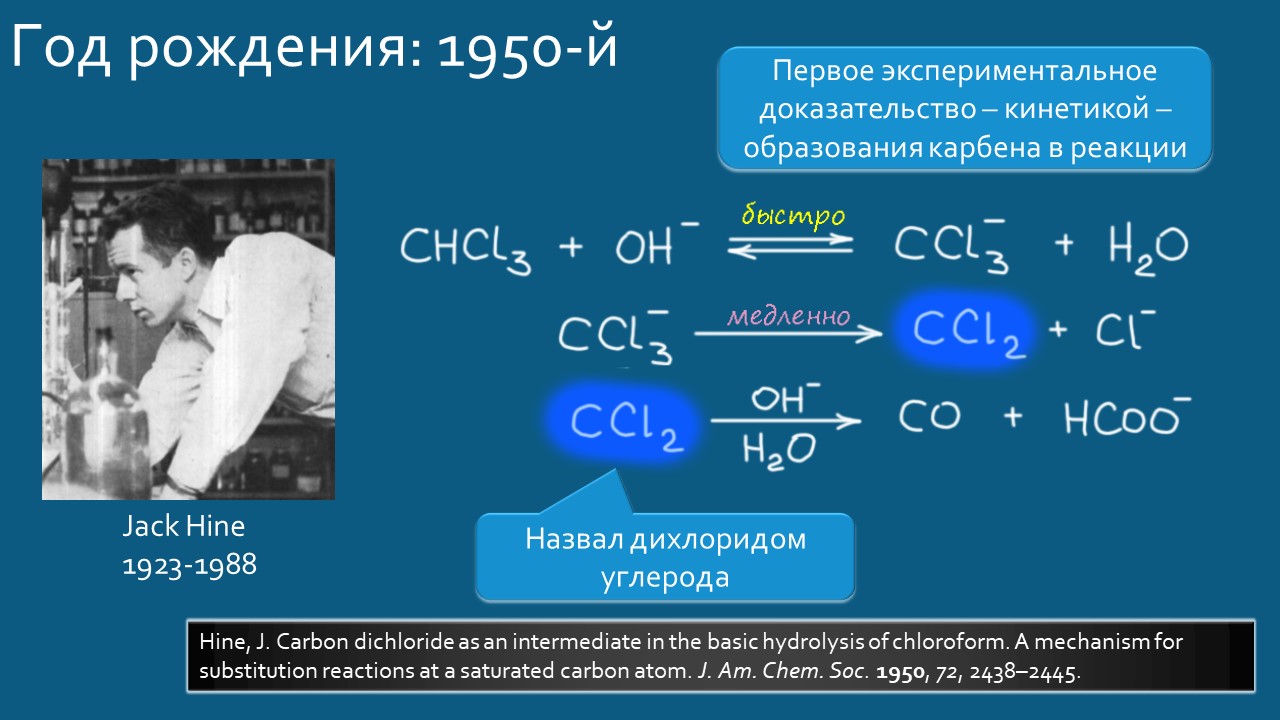
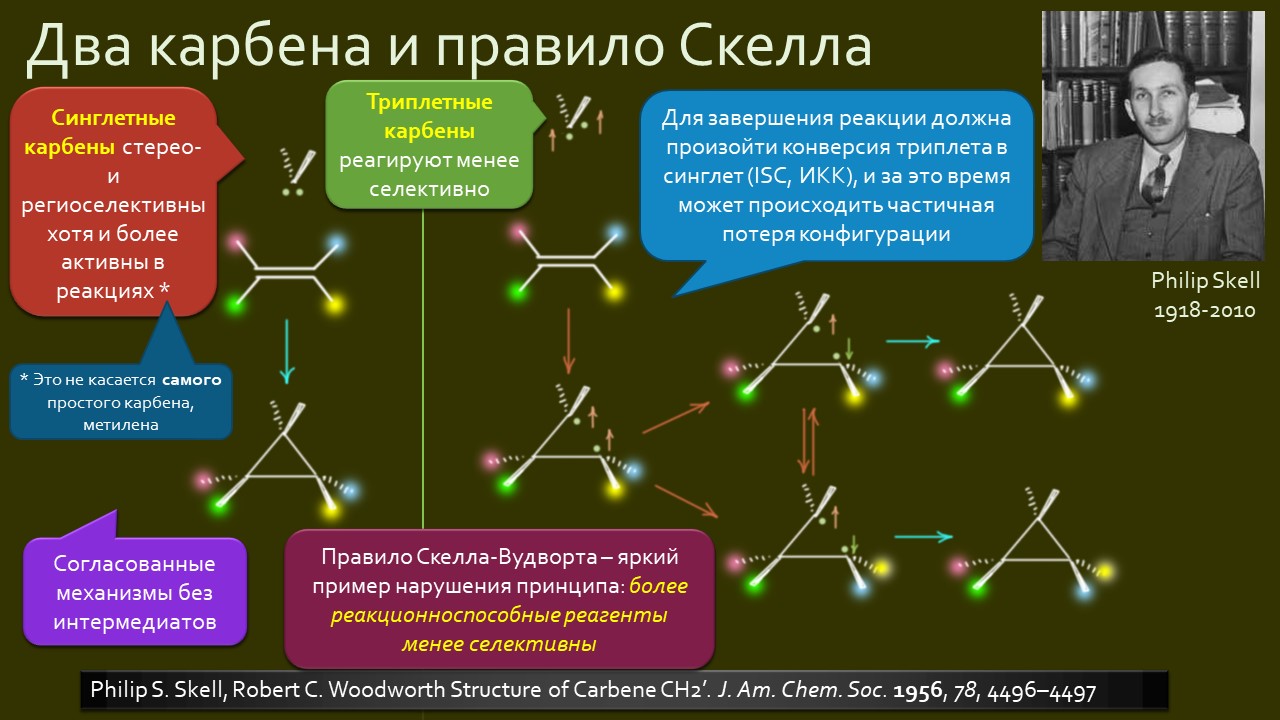
По-настоящему, с доказателствами, не предоставляющими возможности других толкований, карбены были открыты в начале 1950-х и тогда же получили это имя. И как только это случилось, исследования закрытились с бешеной силой – через 10 лет уже можно было писать книги про эти частицы. В начале своего пути карбены считались короткоживущими высокореакционноспособными интермедиатами орнганических реакций, а их главным предназаначением стало открытое Уильямом Дёрингом в 1954 году циклопропанирование олефинов, сделавшая циклопропаны легкодоступными не только для исследований, но и для использования в структурах разных полезных и особенно бесполезных соединений. Обаяние реакции циклопропанирования – кому не понравится забавное занятие, превращающее черточки двойных связей в забавные маленькие треугольнички – настолько велико, что карбены могли так и остаться интеремедиатами одной реакции, по крайней мере пока во Вселенной оставалась бы хоть одна двойная связь, которую можно было бы циклопропанировать.
К счастью, а счастье всегда в том, чтобы не сидеть на одном месте, в те же годы, когда молекулы ощетинивались треугольничками и самые рьяные уже собирались заправлять циклопропанами ракеты, чтобы побыстрее вылететь в трубу в направлении ближайших галактик, в других химиях исподволь зрела измена, и однажды заинтересованное человечество узнало, что карбены это больше не интермедиаты, а модные лиганды. И вместо того, чтобы превращать двойные связи в треугольнички, карбены в такой роли умеют еще более прикольно переставлять кусочки олефинов с места на место в безумном танце метатезиса. Метатезис первым довёз карбены до нобелевской премии, до которой оказалось намного ближе, чем до ближних галактик, и ракетное топливо не понадобилось.
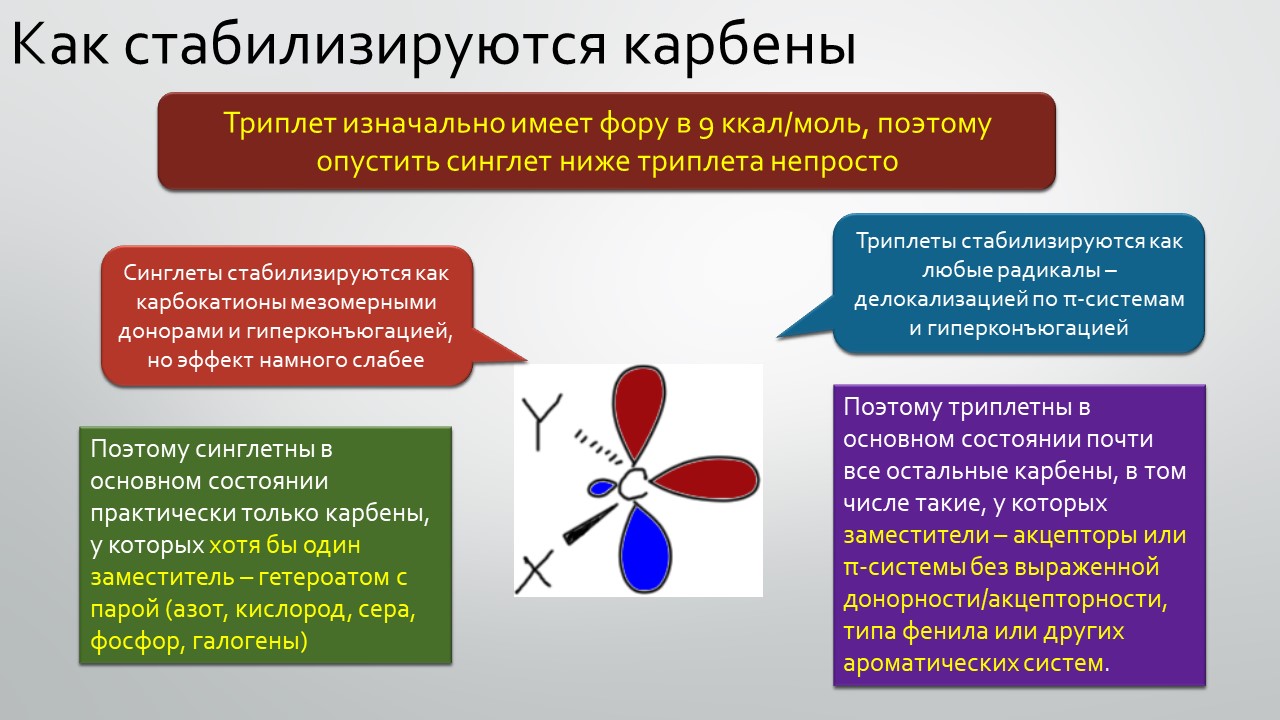
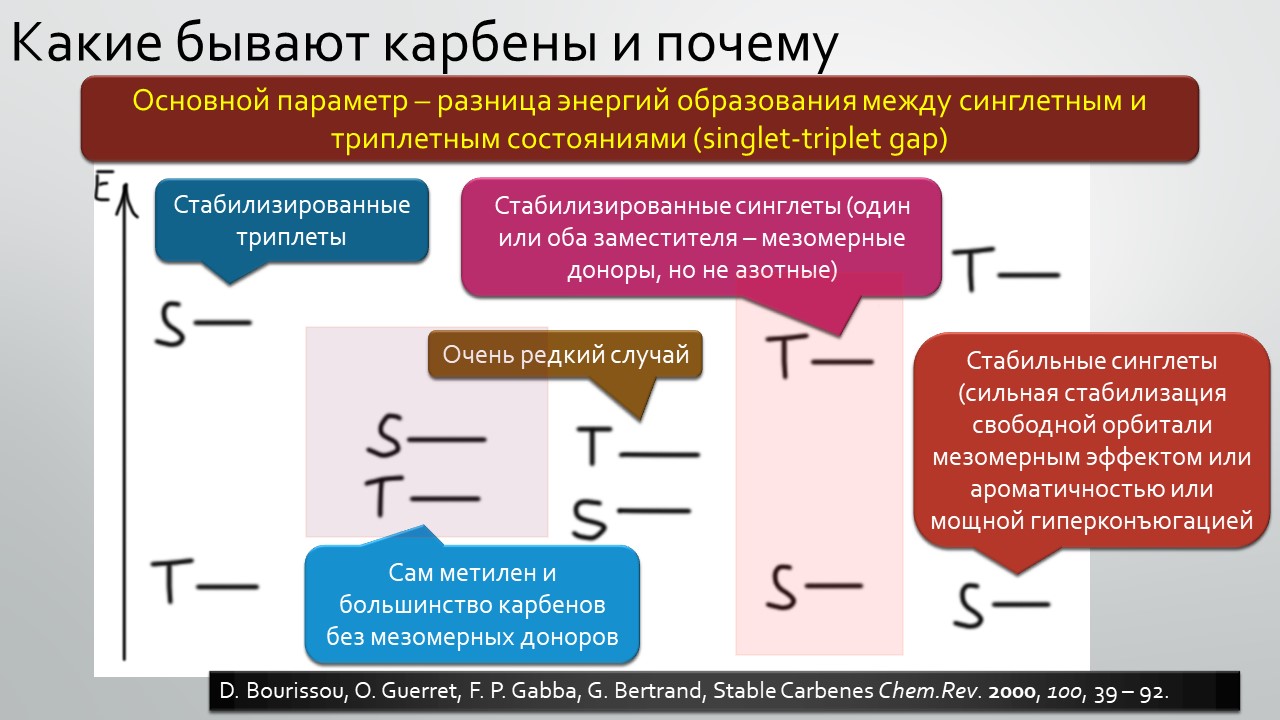
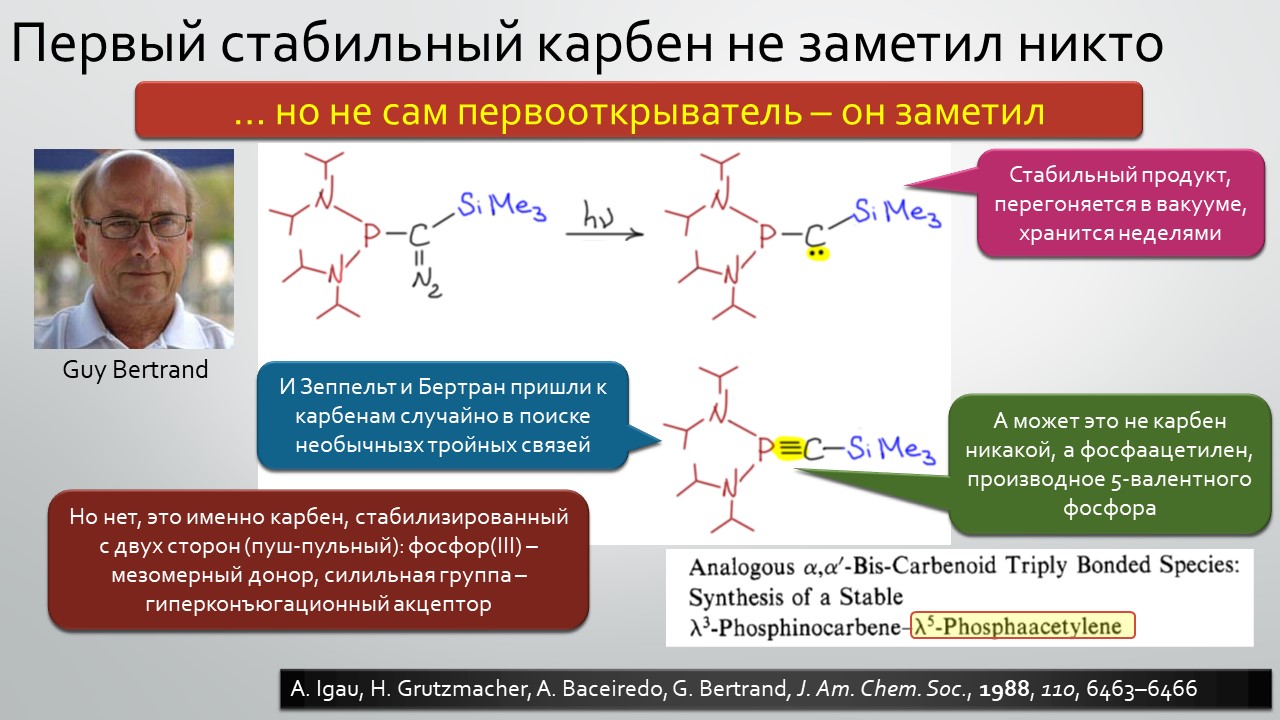
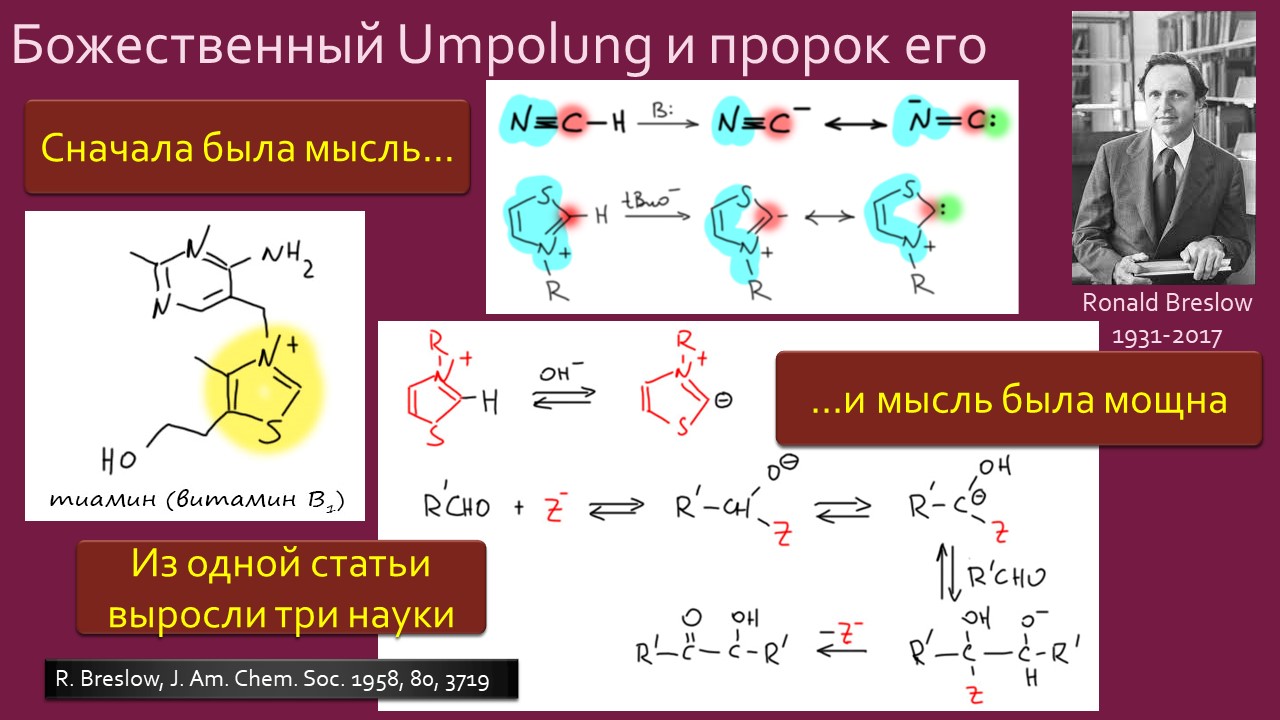
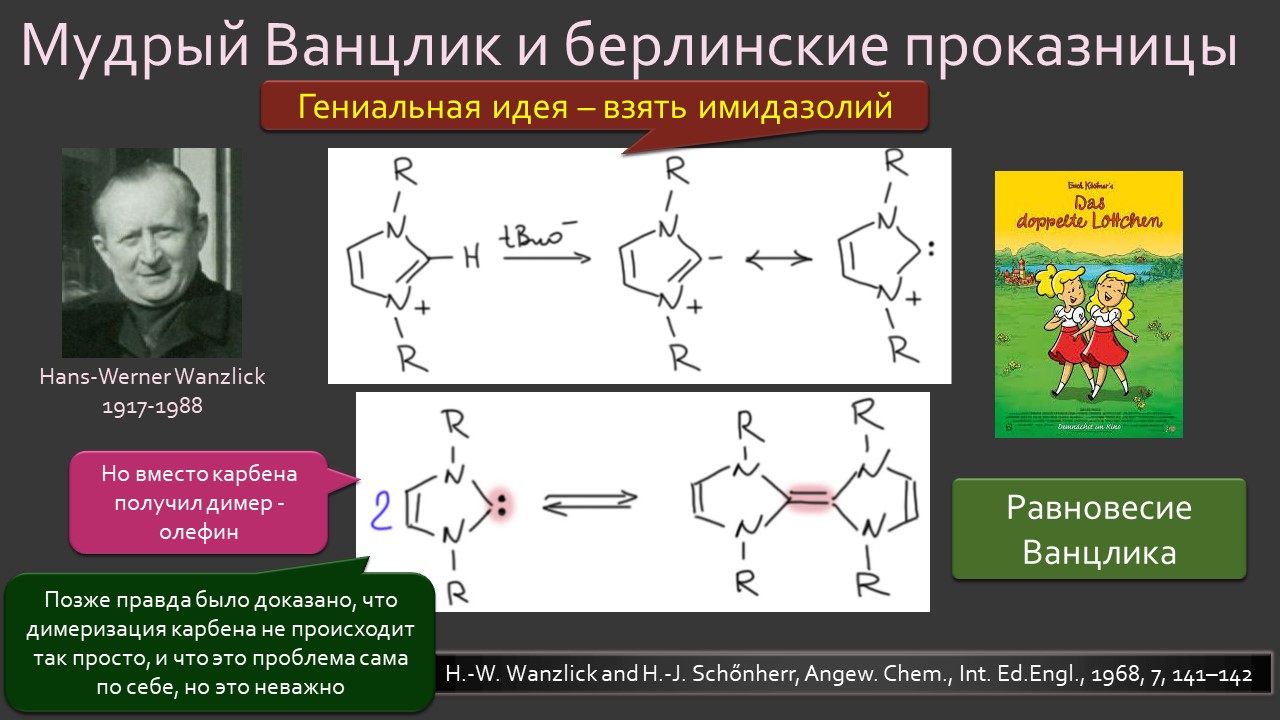
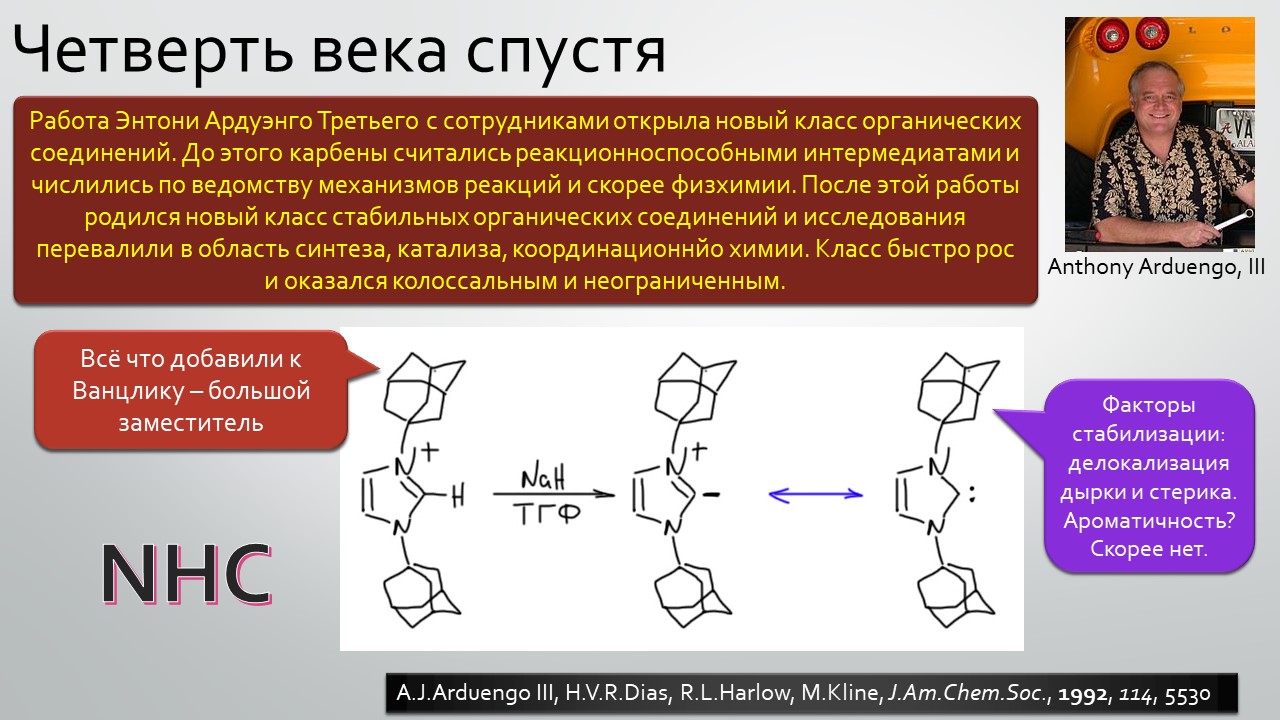
Параллельно и столь же неспешно зрела и вторая идея – бывают ли стабильные карбены, и если бывают, то где их искать и зачем они нужны. Идея эта неожидано вылезла из размышлений о том, что такое… цианид-ион. Что в цианид-ионе карбенового? А вот это с какой стороны посмотреть, и ещё – умище надо иметь совсем неординарный, чтобы разглядеть в те же далёкие 1950-е аналогию между всем известной бензоиновой конденсацией, одной из самых старинных реакций в арсенале органического химика, и действием ферментов транскетолаз, выполняющих в живых организмах тот трюк, которые только ещё назовут немецким словом Umpolung – временным превращением карбонильного углерода в нуклеофил. Эта работа Роналда Бреслоу настолько опередила и своё время, и уровень органической химии того времени, что потребовался четверть века для того, чтобы эта идея была додумана и реализована в концепцию стабильных нуклеофильных карбенов. Сама идея, что карбены могут быть не только электрофильными и даже суперэлектрофильными, а ещё и нуклеофильными возникла немного ранее, но сразу упёрлась в естественные ограничения структуры карбенов, многие из которых принципиально неустойчивы из-за лёгкости перегрупировок в самые обычные стабильные молекулы. Собирали этот не хотевший сходиться пасьянс с большими трудами и заминками, и так незаметно и приехали в новый век. И вот только тогда как прорвало – карбены повалились отовсюду, стабильные и стабилизированные, свободные и связанные в комплексы переходных металлов. И многим тогда стало не по себе – что делать, если нет под руками ни одного карбена, не выдумывать же? А почему нет – выдумывайте, ищите карбены там, где раньше не увидел бы их никто: карбены везде, надо только уметь их обнаружить. Карбеномания? Что-то типа этого постигло органическую химию на рубеже первого и второго десятилетий нового века. Вы избежали этого недуга? Не скромничайте, вряд ли, просто стесняетесь признаться, что и сами пытались приладить какой-нибудь карбен к какой-нибудь своей реакции, но вот как-то ничего не вышло, бывает, не всем везёт, ангевандте хеми не резиновое.
Замечу только, что едва ли не львиная доля применений карбенов переехала в химию комплексов переходных металлов – там это и стабилизирующие лиганды, и активные лиганды, и интермедиаты, а количество реакций, в которых карбены участвуют в одной из своих ролей, уже скоро сравняется со всем множеством известных реакций. Но в этой лекции об этом не будет ни слова, мы оставляем переходные металлы за бортом. Но и того, что осталось более чем достаточно.
Ну и как? Помогли нам наши и не наши кабены, решили ли они какие-то проблемы, или это просто мода, слегка уже начавшая подвыдыхаться. Не знаю, посмотрим.