Стереоизомерия
Молекулы состоят из атомов и химических связей между атомами. Наверняка найдутся желающие это оспорить, и сделать это будет несложно, потому что это действительно довольно сильное упрощение реальности, но для наших целей это работает, а не наши цели нас волновать не должны. Атомы различаются природой, валентностью, степенью окисления, валентным состоянием (или гибридизацией – это опять не самая простая и безупречная вещь, но для атомов 2 периода, а в органике мы из него вылезать почти не будем, это работает неплохо), структурным типом (когда все остальное одинаково, но различаются типы связей на атомах). Мы хорошо знаем, что иногда бывает так, что при одинаковом элементном составе, молекулы различаются, и такие молекулы называются изомерами. В большинстве случаев изомерия возникает из-за того, что при одинаковом составе различаются или типы атомов, или связей. Такие изомеры обычно называют структурными. Вот бутан и изобутан (2-метилпропан) – структурные изомеры: они состоят из одинакового количества атомов каждого из типов (водорода и sp3-гибридного углерода), одинакового количества связей каждого из типов (C(sp3)-H и C(sp3)-C(sp3)), но например, в одной из этих молекул есть атом углерода с тремя C-C связями, а в другом нет атома углерода этого структурного типа. Все, вопрос закрыт, одного отличия достаточно, чтобы утверждать, что перед нами структурные изомеры. Если для двух молекул совпадает числа каждого из типов атомов и связей между ними, но эти молекулы все же различаются, то это различие обусловлено только пространственным расположением атомов, и тогда молекулы являются стереоизомерами. Существует два и только два типа стереоизомерии – энантиомерия и диастереомерия. Это очень простая и важная идея, которую стоит воспринять буквально, и не искать никаких других форм проявления стереоизомерии.Обновления на странице
02.12.20 – добавил пояснение про конституционные изомеры
А как вообще понять, что молекулы отличаются?
Это значит, что молекулы при желании можно не только различить, но и доходчиво рассказать об этом другим людям так, чтобы они с вами согласились. Поскольку люди, особенно ученые, по природе упрямы и недоверчивы, аргументы придется приводить железные.
Когда мы сравниваем две молекулы мы последовательно отвечаем на ряд важных вопросов:
- Различается ли состав, то есть количество атомов каждого элемента, выражаемое в элементном составе и кратко в брутто-формуле (в органике принято перечислять элементы в порядке C – H – N – O и дальше, если есть, все остальное в алфавитном порядке, но если ищете органику в неорганическом или общехимическом формульном указателе, все элементы перечисляются в алфавитном порядке). Если различается, вопрос закрыт – молекулы разные. Как и вещества, из них составленные. Это немного банальное правило не всегда хорошо работает, если мы имеем дело не с нейтральными молекулами, а с ионами в составе солей, где сопоставлять надо именно сами ионы. Это неприятный, но к счастью для нас не очень актуальный случай, поэтому оставим это за скобками.
- Состав одинаковый по элементам, но разный по изотопам (вместо водорода дейтерий, вместо 12C – 13C и т.п.). Это разные молекулы, хотя свойства их очень близки, но в данном случае речь идет именно о точности измерений, и если она достаточно велика, то различия будут найдены. При достаточной точности измерений разноизотопные молекулы можно различить по самым разным свойствам. Собственно именно на этом основаны все технологии изотопного обогащения и разделения. Когда переходим к веществу, проблем становится чуть больше – реальное вещество может быть составлено из молекул с разными изотопами, особенно это касается элементов, взятых “из Природы”, так как многие природные элементы являются смесями изотопов (например, в природном углероде около 1% 13C). Тогда реальное вещество представляет собой смесь молекул, в которых каждый элемент имеет изотопное распределение, соответствующее природному. Такие разноизотопные молекулы безусловно различаются, по большинству свойств очень слабо, но есть свойства, очень чувствительные к изотопному составу, в частности, магнитные свойства, использующиеся в спектрах ядерного магнитного резонанса. Что уж тут говорить про радиоактивные изотопы – они сами на себя оформляют явку с повинной. Иными словами, когда мы имеем дело с веществом, то большинство свойств просто усредняются по реальному изотопному составу, но некоторые свойства выдают наличие именно отдельных конкретных изотопов.
- Две молекулы, одинаковые по элементному составу, но имеющие разную структуру. Что такое структура, мы уже разобрались (это написано в расчете на вашу невнимательность, и на то, что вы не полезете проверять, действительно ли это так). Структурные изомеры – это разные молекулы.
ИЮПАК попытался определить это понятие немного строже в Рекомендациях по стереохимической терминологии 1996 года, но, на мой взгляд, не очень преуспел. Было введено понятие constitutional isomers. В русском языке этот термин совсем не пошёл, хотя бы птому что само слово constitutional в русском языке не имеет хорошего перевода в том, что не касается политического контекста. Иногда в нашей литературе можно встретить буквальный перевод этого термина как конституционной изомерии, но на этом спотыкаются все, очевидно, опасаясь того, что термин попадёт на глаза сотрудникам правоохранительных органов и будет сочтён покушением на государственный строй – а там поди доказывай, что это химия. Тем более подозрительно, что химия, да еще и из-за бугра откуда-то – скажет вам бдительный правоохранитель. В общем, не прижилось это у нас. Да и у них тоже, если честно. Уж больно туманно. Хотели как лучше, а получилось как почти всегда у ИЮПАКа – непригодно для использования (это не касается основ номенклатуры, которой мы пользуемся, впрочем, и там мы видели массу проблем и неоднозначностей). Английское constitution мы обычно переводим как состав, что в данном случае совсем не катит. ИЮПАК расшифровывает это понятие довольно странным образом – как совокупность типов атомов и связей (identity and connectivity of atoms in a molecule), и тогда такие изомеры – это молекулы, у которых не совпадают эти совокупности. Очевидно, что попытка воспользоваться этим определением сломается на первой же простой паре – бутан и изобутан – в обеих число атомов углерода и водорода одинаково, как одинаково и количество связей C-C и C-H. ИЮПАК никак это не поясняет, ограничиваясь более очевидным примером изомерии диметилового эфира и этанола, где нет таких вопросов. И не расшифровывает, что точно значит термин connectivity. Если домысливать ИЮПАК, придётся вкладывать более точное понятие в тип атома – это не просто элемент с конкретной степенью окисления и набором связей (одинарных, двойных), а точнее – связи придется классифицировать еще и по соединяемым атомам. Тогда в бутане есть, например, атом углерода с двумя связями С-С, а в изобутане нет. А в изобутане есть атом углерода с тремя связями С-С, а в бутане нет. С этой поправкой можно принять понятие конституционных изомеров, но станет непонятно, чем это отличается от структурных. В формализованной химии такие вещи описываются в рамках молекулярных графов и прочего, а нам надо жить, оценивая изомерию и структуру на глаз.
В общем, мы не будем пользоваться этим термином (это не опасно, у ИЮПАК нет службы химических приставов, которых посылают к тем, кто посылает ИЮПАК, с болгаркой, кувалдой и наручниками). И продолжим пользоваться термином структурные изомеры. Но если встретите конституционные изомеры, не пугайтесь. Я собственно и добавил это разъяснение, потому что встретил того, кто встретил. Конституционные изомеры = структурные изомеры. - Сравниваемые молекулы имеют одинаковую структуру: для каждого атома в первой молекуле мы находим такой же в сравниваемой, и у каждого из таких атомов полностью совпадают количество и природа химических связей с другими атомами. Первое впечатление – молекулы одинаковы. Но посмотрим повнимательнее, уже выбирая из каждой молекулы атомы попарно, и сравнивая их с такой же парой в другой молекуле, и если найдем хотя бы одну такую пару пар, в которой межатомные расстояния различаются, то и молекулы различаются. Такие молекулы называются диастереомерами. Пока выглядит довольно мутно, но скоро расшифруем.
- Нет, не нашли ни одной такой пары – все атомы одной молекулы в пространстве относительно друг друга расположены точно так же как соответствующие атому другой молекулы. Все межатомные расстояния одинаковы. Ну это уж точно одинаковые молекулы! Не спешим – проверим, не является ли случайно одна молекула отражением в зеркале другой. Для этого возьмем одну из молекул и поставим перед ней (за ней, сбоку от нее, как удобно) зеркало. И дальше возьмем это зеркальное отражение и попробуем совместить с исходной молекулой. Придется повертеть, конечно, но поскольку первая молекула прямо перед вами, то легко мысленно попробовать перевернуть ее отражение и надвинуть на исходную молекулу. Есть шанс, что они не совместятся ни при каких смещениях. Если это так, то мы имеем дело с другим типом стереоизомеров – с энантиомерами. Это, конечно, не всегда очень просто сделать для сложных молекул, но у нас таких случаев не будет, а в том, что будет, мы без труда разберемся, потому что есть более практичные критерии энантиомерии, не требующие использования зеркала.
- Нет, совместились. Молекула и ее зеркальное отражение совместились. Этот случай можно распознать даже еще проще – нужно посмотреть, нельзя ли расположить зеркало внутри молекулы так, чтобы одна ее часть отражалась на другую. Такое внутреннее зеркало называется плоскостью симметрии. Молекулы, имеющие внутренние плоскости симметрии (плоскосимметричные молекулы), не могут иметь энантиомеров.
Безусловно, этот алгоритм из 6 шагов не выглядит простым развлечением. Более того, в реальной жизни его применение может столкнуться с трудностями, если рассматриваемые молекулы не жесткие, а имеют части, подверженные внутреннему вращению. Таких частей почти в любой органической молекуле найдется немало – да просто любая метильная группа вращается вокруг связи углерода с тем атомом, к которому она прикреплена. И какие положения для атомов водорода в метилах использовать, чтобы оценивать расстояния, искать отражения, проводить плоскости? На самом деле это не так сложно, но и не вполне очевидно, потому что потребует дополнительно умения обращаться с конформациями молекул. Поэтому мы не будем “в лоб” выполнять этот алгоритм, а сосредоточимся на важных частных случаях, когда работают более простые для исполнения способы распознавания стереоизомеров.
А что следует из того, что молекулы отличаются?
Если молекулы различаются, то это можно узнать по свойствам и самих молекул, и веществ, состоящих из этих молекул (я надеюсь, что вы понимаете разницу, потому что если нет, то нужно или срочно устранить этот пробел в образовании, либо озаботится сменой профессии, потому что это почти то же самое, как учиться на командира воздушного судна человеку, который не понимает разницу между небом и землей).
У каждой молекулы множество всяких свойств, и собственных, и связанных с взаимодействием с другими молекулами, частицами, полями. У вещества, состоящего из молекул, свойств еще больше, но можно ограничится параметрами фазовых переходов, теплотами (точнее, термодинамическими функциями) и температурами плавления, кипения, сублимации, и т.п. Спектры любые – это тоже свойства веществ. И цвет, а это просто спектр электронного поглощения, измеренный глазом. И, самое главное для химии – реакционная способность, скорости реакций с другими молекулами, константы равновесий. Чтобы в этом не запутаться, можно вывести такой упрощенный универсальный подход. Все в молекуле и веществе зависит от внутренней энергии молекулы. А эта энергия определяется межатомными взаимодействиями. А они, в свою очередь – межатомными расстояниями. И вот – если в сравниваемых молекулах найдется хотя бы одна пара одинаковых по всем остальным параметрам атомов, но отличающихся по расстоянию друг от друга, то у таких молекул разная внутренняя энергия, а значит и разные свойства. Какие свойства? Все свойства без исключения. Бывают случайные совпадения по одному из каких-нибудь свойств (и то, только из-за недостаточной точности измерения), но тогда нужно или повысить точность, или измерить другое какое-нибудь свойство.
Как мы уже поняли, такие пары атомов с разными расстояниями всегда найдутся в структурных изомерах и в диастереомерах. Значит и структурные изомеры и диастереомеры всегда имеют разные свойства, и молекулярные, и относящиеся к веществу. Про структурные изомеры это и так все понимают, но про диастереомеры это не так очевидно. Но это так. Еще раз:
Диастереомеры имеют разные свойства
Из того же самого мы делаем вывод, что свойства энантиомеров и веществ, из них составленных, одинаковы. Почти все свойства. Но не все.
Энантиомеры – это пример очень распространенного в Природе явления хиральности. Хиральными являются объекты, являющиеся отражением друг друга в зеркале, но не совмещающиеся ни при каком перемещении. В мире молекул хиральными объектами являются энантиомеры. В мире больших предметов – левые и правые рука, нога, лапа, крыло, глаз, и т.д. и т.п. – животные, рыбы, птицы, насекомые, земноводные и пресмыкающиеся имеют левую и правую половины, которые взаимно хиральны. Много и других примеров можно найти. Хиральными бывают и излучения, если излучение поляризовано, например, лево- и правополяризованный свет.
Энантиомеры по-разному взаимодействуют с хиральными объектами – молекулами, системами, излучением. Другими словами, хиральные объекты могут распознать другие хиральные объекты, например, энантиомеры. И те свойства, которые определяются взаимодействием энантиомеров с хиральными объектами, тоже различны. Самое известное свойство – взаимодействие в поляризованным светом, явление вращения плоскости поляризации. Но также важно взаимодействие с другими хиральными молекулами – они фактически распознают друг друга, различаться будут скорости реакций и константы равновесий. Поскольку у человека и животных внутри все хирально (кроме благородных помыслов), например, всякие рецепторы, энантиомеры имеют разный запах, вкус (но не цвет – цвет распознается за счет нехирального излучения), они по-разному действуют на организм (одни могут лечить, другие калечить), и т.д. Хиральные молекулы, энантиомеры распознают сами себя и друг друга – они по-разному кристаллизуются, образуя левые и правые кристаллы, обладающие хиральной формой, а также кристаллы рацематов, в которых энантиомеры упаковываются в точном соотношении 1:1.
И наоборот: энантиомеры одинаково взаимодействуют с нехиральными объектами. Другими словами, нехиральные объекты не могут распознать хиральные объекты, в частности, энантиомеры. Константы равновесий и скорости реакций энантиомеров с нехиральными молекулами всегда точно одинаковы. И с электромагнитным излучением любого типа энантиомеры взаимодействуют одинаково, из чего, в частности, следует, что у них одинаковые спектры от ЯМР до ИК, и спектров электронного поглощения. У энантиомеров одинаковый цвет, совсем одинаковый, никаких оттенков, и не то что бездушный спектрометр, но даже сам Диего де Сильва и Веласкес, который умел различать малейшие оттенки любого цвета, не нашел бы разницы в цвете двух красок, сделанных из энантиомерных форм одного красителя. И поскольку рентгеновское излучение только одна из форм электромагнитных волн, и оно не может различить энантиомеры, поэтому самый главный экспериментальный метод определения структуры, рентгеноструктурный анализ в своем классическом, дифракционном виде, столь же бессилен различить энантиомерные формы, как и уже упомянутый Веласкес. Эта страшная проблема – невозможность определить абсолютную конфигурацию (R или S) энантиомерных молекул, – висела над органической химией до середины прошлого века. Это сейчас мы легко определяем, R или S энантиомер перед нами, но до 1951 года этот вопрос просто не имел смысла, так как не было возможности это определить ни для одной органической молекулы.
Интересным практическим следствием различия между диастереомерами и энантиомерами является принципиальная возможность разделения с помощью хроматографии. Хроматографий разных невероятное количество. При хроматографическом разделении разделяемые молекулы взаимодействуют с хроматографическими фазами за счет различной сорбции, растворимости, комплексоообразования и других физических, а иногда и химических процессов. Сразу становится ясно, что диастереомеры всегда можно разделить хроматографически, потому что они по-разному взаимодействуют с фазами. Безусловно для хорошего разделения придется подбирать и тип хроматографии, и фазу, и условия разделения, но принципиально не это, а то, что это точно можно сделать. А вот энантиомеры просто так разделить хроматографией нельзя, так как они совершенно одинаково взаимодействуют с большинством фаз. Но если фаза хиральна, например, содержит хиральные центры на поверхности сорбента, является хиральным лигандом, или хиральной кислотой Бренстеда-Лоури, или еще как-нибудь умудряется это проявить, то возникает возможность хроматографического разделения энантиомеров. И хотя это совсем не просто и безумно дорого, но такие фазы и разновидности хроматографии есть, и появление этого метода чрезвычайно сильно упростило работу с оптически активными веществами.
Энантиомерия
Экспериментально энантиомеры определяются по явлению вращения плоскости поляризации света. Энантиомеры всегда проявляют это свойство, поэтому их еще называют оптически активными веществами. Не молекулами! Оптическая активность – это свойство вещества (чистого или в растворе, но так или иначе, речь идет о большом количестве молекул), а не одной молекулы. Молекула может быть хиральной, но не оптически активной. Для измерения берут растворы в подходящем растворителе (величина зависит от растворителя, поэтому его всегда указывают), после измерения величину пересчитывают пропорционально концентрации на единичную концентрацию. Интересно, что по историческим причинам для этого свойства используют весовую, а не молярную концентрацию, обычно измеряемую в граммах на миллилитр (кубический сантиметр) раствора. Обратите внимание, что это не то же самое, что процентная концентрация, и вообще, кажется, в химии эту величину концентрации не импользуют более нигде. Эти величины приводят как удельное вращение – обозначая [α], дополнительно указывая температуру и длину волны света, использованного при измерении. Энантиомеров у каждой хиральной структуры бывает два и только два, не больше двух и не меньше двух. И если один из них вращает плоскость в одном направлении, то второй на точно такой же угол (в пересчете на удельное вращение) в противоположном. Для обозначения направления используют слова право и лево, или знаки + и —, а сами энантиомеры называют право- и левовращающими. Буквы D и L (или d и l), которые иногда можно видеть в названиях некоторых энантиомеров, не имеют никакого отношения к знаку вращения, это остатки старых номенклатур и мы не будем их использовать нигде кроме углеводов и аминокислот в самом конце курса, там и разберемся, откуда это взялось.
Величину и даже знак вращения нельзя просто предсказать по структуре (сложные теории и менее сложные эмпирические корреляции для этого, конечно, есть, но очень узкоспециальная область). Более-менее очевидно то, что чем более сильно выражена асимметрия, тем больше есть вероятность увидеть очень большую величину удельного вращения, и наоборот, чем менее она выражена, тем меньше будет знак. Например, асимметрия за счет изотопного замещения (водород-дейтерий, или даже водород-дейтерий-тритий) очень слаба, и угол вращения в таких случаях настолько мал, что его непросто измерить с достаточной степенью достоверности.
Угол вращения больше 180º – это ошибка? Ведь кажется, что если угол равен, например, 270º, то это просто -90º! Нет, не ошибка! Не забывайте, что угол пересчитывают на единичную концентрацию, а измерять могут в любой – и в значительно меньшей, если угол велик, и в значительно большей, если мал. И тогда очень просто убедиться, что знак вращения правильный, просто изменив концентрацию, и сделав ещё одно измерение – если удельное вращение определено правильно, то получающаяся величина должна быть пропорциональна концентрации. И поэтому удельный угол вращения может быть и больше 360º. Самое смешное, что он может быть и точно равен 360º и это, как мы уже поняли, не ноль. Я не знаю конкретного примера соединения с такой величиной удельного вращения и даже не знаю, есть ли такой пример, очень возможно, что и нет, ведь, как известно, вероятность получить одно конкретное значение непрерывной функции равна нулю. И вообще, это просто курьёз, в этом нет ничего существенного. Существенно то, что удельное вращение может иметь любую величину, вообще любую. Например, для соединений, хиральность которых определяется спиральным расположением ароматических колец, гелиценов, удельное вращение может доходить до 10000º (прописью: до десяти тысяч градусов), и это не предел. Это просто означает, что для того чтобы измерить такое вращение, нужно использовать очень разбавленный раствор, и после пересчитать на концентрацию 1 г/мл, а если мы этого не проверим, то можем легко ошибиться, так как не будем знать, сколько полных оборотов уже прокрутилось.
Энантиомеры бывают только у молекул, не имеющих внутренней плоскости симметрии.
Если такая плоскость есть, то энантиомеров быть не может. Для молекул, в которых разные части крутятся друг относительно друга, образуя самые причудливые формы (они называются конформациями) наличие плоскости устанавливается по любой из конформаций – если есть хотя бы одна конформация, имеющая плоскость симметрии, то вопрос закрыт. Пример очень простой – любой длинный нормальный алкан имеет огромное количество конформаций, потому что все части молекулы вращаются вокруг всех связей C-C, и большинство таких форм явно не имеют никакой симметрии и кажутся совершенно бесформенными клубками связей, большинство таких конформаций вполне хиральны, и если бы кому-то удалось отобрать только такие конформеры и создать из них вещество, оно было бы оптически активным. Но это невозможно – а почему, можете посмотреть на странице про нежёсткие молеклы и конформации. Но стоит вам вытянуть цепочку алкана так, чтобы все связи C-C оказались в плоскости (это всегда можно сделать и не одним способом, но один способ совершенно очевиден – это такая змейка, состоящая из букв v – vvvv…), – то эта плоскость и станет плоскостью симметрии. Такими способами можно справиться с любой гибкой молекулой, хотя иногда повозиться придется немало.
Насыщенная нециклическая органическая молекула может иметь энантиомеры только если в ее составе есть хотя бы один так называемый стереогенный (он же хиральный, он же асимметрический) центр. Чаще всего это атом углерода с четырьмя разными группами (разница групп устанавливается точно так же как разница молекул, что мы уже проделывали выше на этой странице – просто вместо разорванной связи с углеродом подставьте атом водорода и сравнивайте молекулы – группы могут различаться по составу, в том числе изотопному, или по стереохимии – они могут быть диастереомерны или энантиомерны). Это довольно очевидный вывод, легко доказываемый от противного: предположим, что такая плоскость есть. Но тогда она или проходит через стереогенный центр или не проходит. Но проходить она не может – через атом с 4 разными группами в вершинах тетраэдра не может проходить плоскость симметрии. А если плоскость проходит не через атом, то в молекуле есть еще и его отражение со своими четырьмя разными группами но в отраженной, энантиомерной форме, и два таких центра взаимно уничтожают друг друга – в этом случае молекула не имеет энантиомеров и нехиральна (это называется мезо-формой).
Кроме углерода, хиральными (стереогенными) могут быть и атомы других элементов, например, азота, фосфора, серы, не говоря уж о переходным металлах, стереохимия которых необычайно разнообразна и сложна. Не будет бередить эту область, а то заблудимся и потеряемся раньше времени. В нашем курсе нам это не встретится (особо любопытным может попасться хиральный азот, но мы сделаем вид, что не знакомы с этими несчастными – пусть выбираются сами).
Мы в нашем курсе будем иметь дело практически только с энантиомерией молекул со стереогенными углеродными центрами. Но нелишне хотя бы иметь представление, что бывают и другие причины энантиомерии в молекулах, не имеющих плоскости симметрии: бывают стереогенные оси, плоскости, спирали. Пока оставим это за скобками.
Диастереомерия
Причины диастереомерии совершенно другие, и наличие плоскостей симметрии или других элементов симметрии не играет никакой роли. Диастереомерами могут быть и плоские молекулы, и молекулы с очень сложной формой. Распространенных причин диастереомерии две:
- Расположение заместителей относительно жесткого фрагмента: двойной связи, цикла, еще какой-нибудь структуры. Тогда для двух заместителей возникает две возможности взаимного расположения относительно этого фрагмента:
- ситуация “по одну сторону”, она же цис, она же син
- против “по разные стороны”, она же транс, она же анти.
- Если фрагмент сложный, то заместителей может быть не два, а сколько угодно, и они могут образовывать любые комбинации от “все в одну сторону” до “часть в одну, другая в другую” в любых комбинациях.
- Наличие в молекуле не одного источника хиральности, а нескольких. Например, не одного, а двух или более стереогенных центров. Или центра и плоскости, центра и оси, и т.д.
Количество диастереомеров поэтому зависит от конкретной структуры и всегда измеряется степенями двойки – два, четыре, восемь, и т.п.
Диастереомеры обязательно имеют разные свойства – все свойства, начиная от температур плавления и кипения, до спектров и реакционной способности по отношению к любым реагентам, включая нехиральные.
А что с оптической активностью? У диастереомеров может быть, а может и не быть оптической активности. Оптическая активность возникает из-за хиральности, а не диастереомерии. Поэтому если какой-то диастереомер хирален, то он оптически активен, если нехирален (ахирален), то нет. Если две хиральных молекулы являются диастереомерами, то величина удельного вращения у них различна.
Почему цис/транс (или E/Z) изомеры олефинов и R,S/R,R (или эритро/трео)-стереоизомеры насыщенных соединений с двумя стереоцентрами относятся к одному типу стереоизомерии - диастереомерии.
Очень краткий ответ прост и логичен, как математическая теорема, и фактически представляет собой доказательство “от противного”. Существует только два типа стереоизомерии – энантиомерия и диастереомерия. Это совершенно общепринятый факт, даже если кому-то кажется, что это не очевидно. Это действительно неочевидно, но зато надёжно установлено. Пресловутый ИЮПАК признаёт это и подтверждает своим авторитетом. Своего авторитета у ИЮПАК нет, но в соответствующие комитеты и дивизионы ИЮПАК входят авторитетные и даже знаменитые химики, в том числе стереохимики, и их несомненный авторитет подпирает всё, что исходит от ИЮПАК. Если мы докажем что стереоизомеры не являются энантиомерами, значит они диастереомерны. Третьего не дано. Цис/транс-изомеры точно не являются энантиомерами, так как двойная связь вместе с заместителями лежит в плоскости, и не может быть причиной энантиомерии. Следовательно это диастереомеры. Про R,S и R,R (или S,S) это тоже очень понятно – у энантиомеров конфигурации стереоцентров (буквы R и S) должны быть попарно противоположны: вот R,R и S,S – энантиомеры (каждая буква R отражается в зеркале в S и наоборот), и R,S и S,R -тоже. А R,S и R,R – нет. Значит это диастереомеры. Теорема доказана.
Но нормальные химики не любят таких формальных умозаключений. Молекулы лучше потрогать, повертеть в руках, повертеть и погнуть, попробовать на зуб, чтобы понять, как они устроены. Попробуем разобраться на примере самых простых насыщенных диастереомеров с двумя соседникми и одинаковыми по структуре стереоцентрами. Таких диастереомеров два – их называют эритро- и трео- или по номенклатуре КИП RS/SR и RR/SS (каждый представляет собой энантиомерную пару, но одна из этих пар вырождена в одну нехиральную. молекулу – мезо-форму). Проекции Фишера для диастереомеров очевидны (показываем только один энантиомер для трео-формы, а эритро-форма представлена одной молекулой мезо-формы).
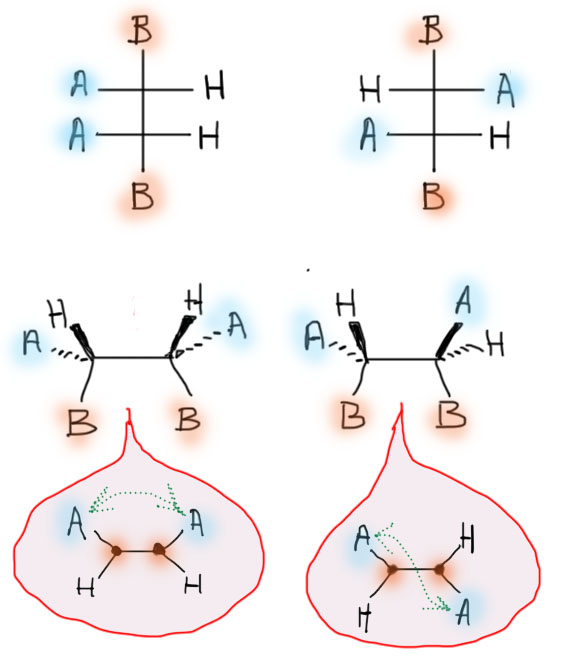
Расположим молекулы для удобства так, чтобы они максимально были похожи друг на друга, например, провернув вокруг центральной связи до совмещения атомов B. Посмотрим на молекулы с противоположной стороны и увидим нечто, похожее на картинки в красных каплях – не правда ли, это очень похоже на цис/транс-изомеры олефинов. Ясно, что расстояние А-А в структурах явно различно. Но и здесь можно усомниться и задать вопрос, а почему конформации скрутили так, а не иначе – разве это не произвол?! Нет, конечно. Строгости ради мы должны были посмотреть все формы, полученные вращением вокруг центральной связи C-C, но во всех остальных разница будет видна не менее очевидно. Например, если мы совместим уже атомы A, то так же явно разойдутся атомы B. Следовательно, действительно несмотря на возможность вращения вокруг простых связей в этих двух стереоизомерах есть атомы с различными межатомными расстояниями. А следовательно и с различными межатомными взаимодействиями. А следовательно это – диастереомеры, то есть стереоизомерные молекулы с различными свойствами.
