Стереохимия нежёстких молекул
На этой страничке попробуем разобраться с важнейшими понятиями в химии: конформациями, конформерами, заторможенным вращением – и убедиться, что нет такого уголка в органической химии, где бы они не использовались, явно или неявно.
Обновления
27.10.2020 – небольшое добавление про историю термина атропоизомерия в конце вкладки про Конформеры – это изомеры?
Сразу оговоримся – совсем жестких молекул, если в слово “жесткий” вкладывать бытовой, обыденный смысл, не бывает. Даже простейшие двухатомные молекулы типа H2, O2, N2 в реальности представляют собой такие непрерывно колеблющиеся пружины. Все атомы с любых молекулах непрерывно колеблются, и это движение не останавливается даже при абсолютном нуле. С колебаниями атомов в молекулах связано огромное количество важных явлений, от инфракрасных спектров до зависимости реакционной способности молекул от температуры, да даже и до собственно химических реакций, так как любая химическая реакция на молекулярном уровне представляет собой некоторое слишком далеко зашедшее колебание, в результате которого одни связи разорвались (…доколебались), а другие, наоборот, образовались (…приколебались), чтобы колебаться дальше уже в новой молекуле.
Но этими вещами мы серьезно заниматься не будем. Даже с инфракрасными спектрами познакомимся очень поверхностно. Тогда мы можем смело считать жесткими молекулами любые молекулы, внутри которых не происходит значительного самопроизвольного перемещения одних их частей относительно других с образованием новой формы или форм, визуально и геометрически отличных от первоначальной. Такими, например, являются
- совсем маленькие молекулы типа метана, галогенпроизводных метана;
- молекулы, состоящие из sp2-гибридных атомов, связанных двойными связями типа этилена и его простых производных, формальдегида, аллена (пропа-1,2-диена), оксида и диоксида углерода; или тройной связью типа ацетилена, цианистого водорода, но если двойные связи в молекулах могут быть подряд в неограниченном количестве (это назывется кумуленами, никто нам не может, например, запретить построить деканона-1,2,3,4,5,6,7,8,9-ен, да и что-нибудь еще длиннее, хотя эти молекулы в реальности нестабильны), то тройная связь может соседствовать только с простой.
- небольшие циклические молекулы типа циклопропана или оксирана;
- очень многие ароматические молекулы – но об этом позже;
- молекулы, состоящие из нескольких циклов связанных друг с другом минимум двумя связями – так называемые каркасные молекулы, например, норборнан и адамантан.
Ну вот, почти всё. Негусто. И стоит нам что-то добавить к этим структурам, например, заместитель на простой связи, например, из этилена сделать пропен, из бензола – метилбензол, соединить два этилена простой связью в бутадиен, как мы получаем нежёсткие молекулы, и молекул таких, конечно, подавляющее большинство в мире молекул, и если бы в мире молекул царили бы такие же нравы, как в мире людей, жёсткие молекулы были бы объектом насмешек и дискриминации со стороны нормальных, нежёстких молекул.
В нежёстких молекулах есть хотя бы одна связь, почти всегда одинарная, соединяющая фрагменты, которые могут менять взаимное расположение относительно друг друга. Если немного подумать, как они это могут делать, то в голову не придёт ничего оригинальнее простого вращения. Простая связь в этом смысле становится просто осью вращения. Это явление поэтому так и называют – внутреннее вращение.
Сравнивать простую связь, обеспечивающую это внутреннее вращение с осью можно только очень поверхностно. Вокруг настоящей оси все крутится свободно и с удовольствием, и нет никаких дискретных положений. Когда-то, очень давно точно так же представляли себе и вращение вокруг простых связей. От тех древних времён остался даже неудачный термин свободное вращение. И хотя уже сто лет назад вполне однозначно выяснили, что это не так, этот термин продолжает жить и обманывать новые поколения. Те, кто относится к терминологии серьёзно, предпочитают этот обманчивый термин не использовать, а вместо свободного вращения предпочитают говорить о заторможенном вращении (hindered rotation). Есть и такие, кто предпочитает различать свободное и заторможенное вращение в зависимости от легкости проворота. Ниже мы посмотрим подробнее, какие явления с этим связаны, но для наших целей это можно считать не очень важным, и относиться к любому такому внутреннему вращению одинаково, не пытаясь делать различия между более или менее свободным вращением.
Внутреннее вращение вокруг такой связи больше похоже на движение такого круглого переключателя с делениями: одно положение, крутим – щёлк, другое, щёлк – третье, щёлк – обратно вернулись. Нужно некоторое усилие, чтобы провернуть такую ручку от деления к делению, иногда большее, иногда меньшее, но какое-то требуется всегда.
Вот и в молекулах с внутренним вращением тоже так – проворот от одного состояния к другому может быть в одной молекуле очень лёгким, а в другой – требовать значительных усилий, но какое-то усилие требуется всегда. И очень важно, что эта легкость сильно зависит от температуры – при понижении температуры, большем или меньшем, наступает такой момент, когда вращение совсем останавливается, как говорят, вымораживается. Лёгкость вращения и температурный порог определяются энергетическим барьером, который нужно преодолеть – барьером вращения.
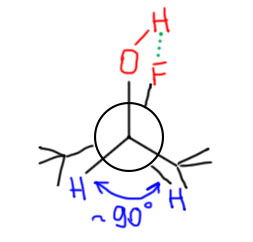
Возьмем одну из самых простых молекул, имеющих такую возможность – этан. Представьте, что у нас есть видеокамера с фантастической скорострельностью, с помощью которой мы можем наблюдать за отдельной молекулой этана в растворе этана в каком-нибудь растворителе. Скорость потребуется огромная: вот это движение, которое нас сегодня интересует, происходит с огромной частотой, порядка десяти триллионов раз в секунду. Запилив видосик с помощью нашего фантастического гаджета, и замедлив в триллион раз, чтобы видеть движение в нашем нормальном времени, увидим приблизительно такую картину (слева вид спереди, справа вид сбоку) .
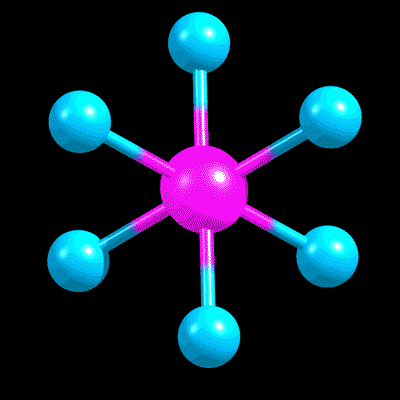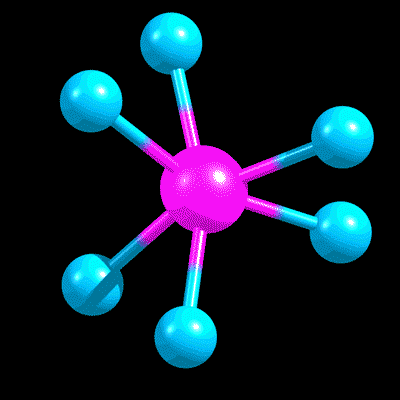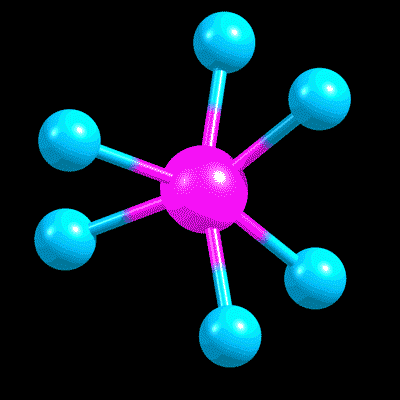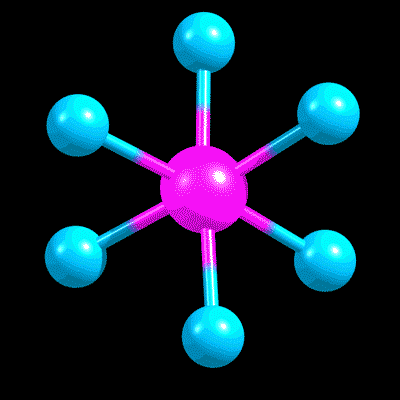
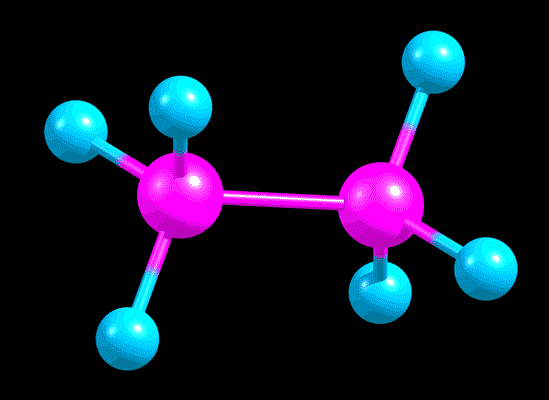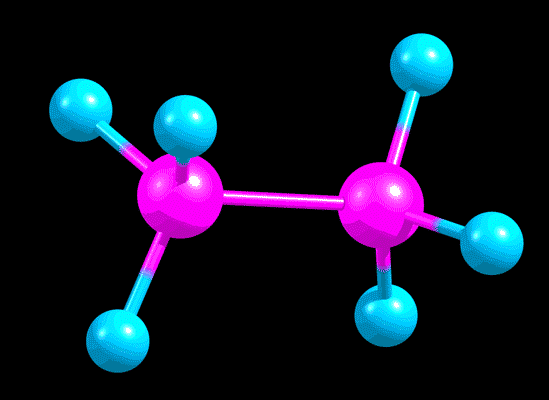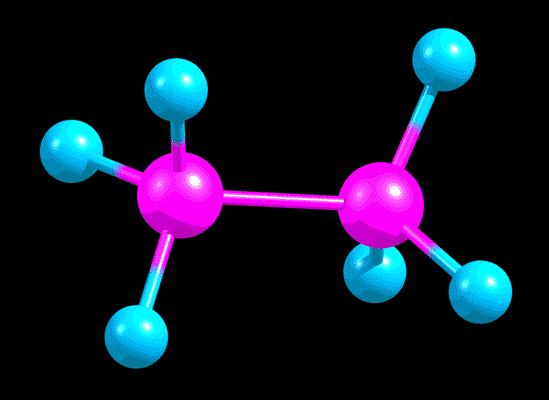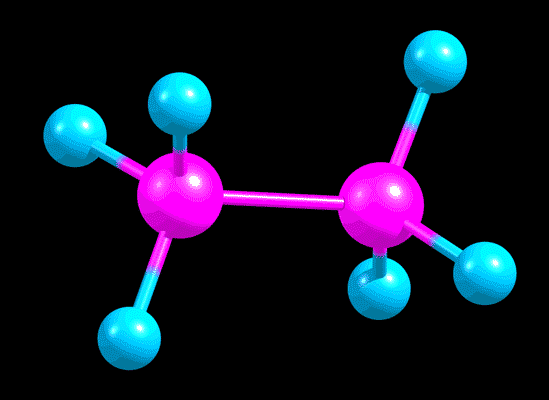
Нарисуем это среднее положение, около которого оно так крутится-колеблется. Сделать это можно разными способами.
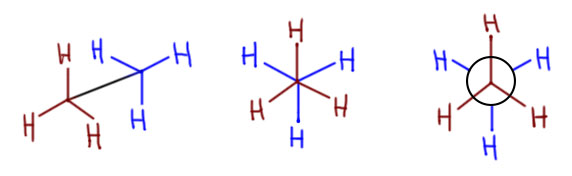
- левая формула – это как раз такой упрощенный вид сбоку, специально сделанный так, как будто метильные группы кто-то раплющил, без претензии на то, чтобы попробовать показать более-менее естественные валентные углы. Такие не-совсем-проекции принято забавно называть лесопильными козлами (кóзлами, а не козлáми). Если вы подумали, что это какая-то память о родном лесоповале, ничего подобного, это вполне американский термин, только у них бревна пилят не на козле, а на лошади – sawhorse. И не могу не заметить, что тот, кто придумал этот игривый термин, воображением обладал хорошим, но настоящего приспособления для пиления дров не видел никогда даже во сне. Такие формулы (лесопильные кóзлы, sawhorse projection) иногда попадаются особенно в учебной литературе, но для работы они очень неудобны, особенно если молекула хоть немного посложнее этана, и я не советую к ним привыкать.
- если развернуть молекулу и посмотреть ей прямо в торец, получится что-то похожее на вторую формулу. Если не использовать цвет для обозначения передней и задней группы, то такой вид просто собьет с толку. Ну его в таком виде и не используют. Но небольшое изменение, которое придумал скромный американский химик Мелвин Ньюмен в 1955, сделало и его знаменитым, и такой способ – самым популярным и до сих пор непревзойденным. Ньюмен просто добавил кружок, который должен обозначать атом углерода, хотя не совсем понятно, какой. Сам Ньюмен уверял, что задний, более далекий от зрителя, и в этом случае ближний атом обозначается точкой, что невольно выдает в учёном поклонника византийской иконописи, в которой использовалась обратная перспектива – ближнее было маленьким, дальнее большим. Так это или не так, но получилось нечто странное, но дико удобное – передний атом со своими связями растет прямо из центра; задний как будто заслонен этим кружком – сразу понятно, причем интуитивно понятно, что где. Проекцию эту так и называют проекцией Ньюмена.
Понимание конформаций и конформеров совершенно необходимо для работы с нежесткими молекулами, то есть с подавляющим большинством реальных молекул. Почему это так можно прочитать на первой вкладке с броским названием чуть ниже. На других вкладках разобраны более частные вопросы, которые можно пока пропустить. Даже так: и не вздумайте всё это читать целиком, даже если совсем нечего делать! Никогда не забивайте голову информацией, которая вас не интересует или не нужна. Но когда будете действительно иметь дело с конформациями, эти вопросы и так могут возникнуть, некоторые или даже все. Тогда и почитаете с пользой.
Почему понятия конформер и конформация совершенно гениальны, а их роль в химии невозможно переоценить - она колоссальна!
Недаром за исследование конформаций выдали целую Нобелевскую премию в 1969 году британцу Дереку Бартону и норвежцу Одду Хасселю. За это можно было бы дать не одну, а сразу десять премий.
Потому что без конформаций было бы очень тяжело обращаться с нежёсткими молекулами, которых, как мы уже выяснили, подавляющее большинство. Мы бы не знали, какая форма у этих молекул, и не имели бы способов адекватно отобразить их структуру на бумаге, а значит и представит ее в голове. Представление о конформерах и конформациях даёт нам возможность обращаться с гибкими молекулами так, как если бы они были вполне жёсткими, с постоянной фиксированной структурой, и единственное что отличает их от по настоящему жёстких молекул это то, что таких форм у каждой нежёсткой молекулы несколько, и эти формы находятся в равновесии.
Зачем нам знать структуру нежёсткой молекулы?
Структуру вообще знать необходимо для любого соединения, потому что через структуру химик познает свойства и реакционную способность. Нет представления о структуре – нет понимания, есть только экспериментальные данные, а как в них разобраться, не ясно. И если у вас молекула нежёсткая, крутится внутри, а представления о конформерах нет, а вместо этого есть идея о свободном вращении, как всего сто лет назад, то любой вопрос пришлось бы решать, представляя все конфигурации молекулы (с каким-то разумным шагом, конечно, например, сканировали бы двугранный угол с шагом в 5 или 10 градусов), для каждой конфигурации делали бы расчет желаемого свойства или переходного состояния, потом всё это усредняли бы по всему множеству таких конфигураций. Химия стала бы сущим адом, а химику обязателно требовались бы хотя бы минимальные склонности к математике.
Например, для того чтобы понимать, как они устроены, и для того чтобы отвечать на всякие важные вопросы. Нас бы спрашивали что-то такое, например, вот 2,3-дибромбутан, а как в нем расположены атомы брома – близко друг к другу или далеко. Как вообще нарисовать структуру этой молекулы. Кому-нибудь пришла бы в голову какая-нибудь затея, для которой нужно было бы, чтобы они, например, были близко, а этот кто-нибудь бы и не знал, как это узнать, и пришёл бы к вам, как к знаменитому авторитету в химии. А вы ему такой и говорите, как положено авторитету, с очень важным видом и презрительной усмешкой: Невежда, да это же насыщенная молекула, все связи в ней крутятся, слышали про свободное вращение вокруг простых связей, значит, там все все время крутится и извивается, как змей на сковородке, как там можно что-то сказать, ступайте прочь, не отвлекайте от тягостных раздумий о судьбах Родины. И тогда кто-нибудь, пришедший к вам с вопросом, горько заплакал бы и удалился несолоно хлебавши, пропала его затея, горе ему.
Про кого-нибудь сразу скажу, что затея его и так бы пропала, но и вы его обманули. Горе и ему и вам! Напрасно выпендривались. Можно ведь было очень точно сказать, какую структуру имеет молекула искомого 2,3-дибромбутана, и никакое вращение этому не помеха. И еще про многие и многие другие гибкие и нежёсткие молекулы можно много сказать. Даже про такие необъятные страшилища, как белки, которые тоже представляют собой колоссальные нежёсткие молекулы, к которым, если просто нарисовать их структурную формулу, даже страшно было бы подступаться. А наука о конформациях даёт к этому ключ, и в той же химии белков возможность узнать структуру открыла дорогу к тому, чтобы понимать, как устроено всё живое.
Ответ нам как раз и дает представление о конформациях, и наша способность их анализировать. Эту способность называют конформационным анализом. В полном виде это очень мощная и сложная наука, но даже ее азов достаточно для совершенно ошеломительных открытий.
Главный аз таков:
Любая нежёсткая молекула полностью представлена своими конформерами. Зная их, вы знаете о молекуле и образованном из неё веществе всё,
по крайней мере в жидком состоянии, в том числе и в первую очередь в растворах. Как мы уже знаем, в органической химии мы практически всегда только с этим и имеем дело. В газовой фазе и особенно в твердом состоянии могут быть дополнительные проблемы и явления. Конформеры там те же самые, только они не в равновесии и это создает некоторые проблемы, к счастью, нас это пока не волнует. Жидкость отличается от других фаз очень важным свойством: все молекулы жидкости находятся в тепловом равновесии, их средняя энергия однозначно задана температурой. С такой средой очень просто иметь дело, потому что нас не интересует, что делать, если молекуле не хватает энергии для чего-то (например, того же конформационного превращения), или если молекула где-то подцепила лишнюю энергию и не знает, куда ее девать. Такие проблемы очень часто возникают и в газовой и в твёрдой фазах, и это настоящая морока, врагу не пожелаешь. Как же здорово, что у органиков почти всё идёт в жидкости, в растворах! В жидкости идеально работают законы равновесий, распределения Больцмана и всё остальное, из чего следуют всем известные формулы химического равновесия и кинетики. Слава жидкому состоянию!!
Уже этого первого принципа достаточно для многого. Слово “представлена” в этом контексте означает – представляет собой равновесную смесь конформеров и более ничего. Ищите там днём с огнём что-то другое, не найдете – только конформеры. Не нужно больше никаких других конфигураций, не нужно сканировать двугранный угол хоть с каким шагом, и не нужно ничего усреднять. Мы фактически можем забыть, что молекула нежёсткая, и что-то там вращается – просто рассматриваем равновесие конформаций. Да, это сложнее, чем иметь дело с жёсткой молекулой с одной единственной формой, но ненамного. К тому же, ситуации, когда структуру соединения нельзя представить одной формой, а нужно смотреть равновесие нескольких форм, в химии вполне обычна и без нежёстких молекул – равновесные взаимопревращения изомеров втречаются очень часто.
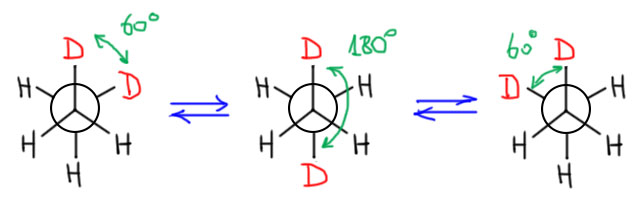
Особенно просто это в тех случаях, когда все конформеры одинаковы. И на вопрос, что такое этан, и какая у него структура, мы смело рисуем приведенный выше конформер – у этана их три, но все одинаковые, поэтому достаточно одной проекции Ньюмена. И всё, не нужно больше ничего крутить. Для молекул посложнее потребуется чуть больше. Если у молекулы не один, а несколько конформеров, придется разобраться в их относительной стабильности и выбрать наиболее стабильный. Если мы сможем это сделать, то нам полагается мощный бонус – второй принцип:
Самый устойчивый конформер определяет большинство значимых свойств нежёсткой молекулы, имеющей много конформеров.
Про остальные конформеры можно забыть, по крайней мера, пока нам не встретиться какой-то особое свойство, требующее более точного учета конформаций. На отдельной вкладке разберемся с этим.
Усвоив это, вернемся к молекуле 2,3-дибромбутана. А, их же три – два энантиомера трео-диастереомера и эритро-диастереомер. Поскольку у энатиомеров конформеры одинаковы с точностью до отражения в зеркале, можно взять любой. Потренируемся заодно еще в свободном сочетании в рассуждениях естественной проекции и проекции Ньюмена. Начнем с эритро. Естественную проекцию обычно рисуют змейкой, вытянув главную цепь. Сейчас мы увидим, что это удобно, хотя и не всегда полностью оправдано. Переводим естественную проекцию в ньюмена, просто развернув её левым концом вперёд. Этот конформер соответствует конформации с анти-расположением (по другому можно сказать – анти-конфигурацией) атомов брома. Крутим одну тройку относительно другой и получаем две другие, уже с гош-конфигурацией и бромов и метилов. Думаем, какая из трёх конформаций самая лучшая – самая стабильная. В первом приближении, а нам другого и не надо, это очень просто. Конформацию дестабилизирует стерическое отталкивание близко расположенных групп. Поскольку в реальных конформерах нециклических молекул не бывает заслоненных конфигураций (об этом отдельно), но только заторможенные, самое близкое расположение – это тот самый гош, торсионный угол 60º. Отметим для наглядности такие сближения красненьким облачком, чем ярче, тем отталкивание сильнее. Самый большой атом здесь бром, и гош-расположение атомов брома сильнее всего дестабилизирует. Гош-расположение метила и брома дестабилизирует слабее, двух метилов – еще слабее. В настоящем конформационном анализе все дестабилизирующие взаимодействия в каждой конформации оценивают и суммируют. Мы будем делать проще: будем учитывать только самое сильное дестабилизирующее влияние, а всеми послабее пренебрегать.
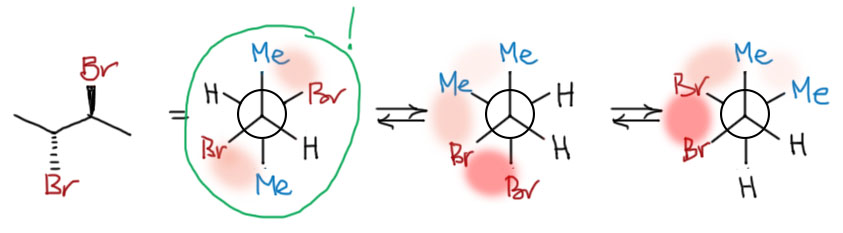
Получаем, что вторая и третья конформации, во-первых, одинаковы по энергии, и во-вторых, менее стабильны, чем первая. Какие выводы мы делаем? Самый важный состоит в том, что на вопрос, что такое эритро-2,3-дибромбутан мы смело можем сказать – это вон тот анти-конформер в зеленом кружке. Иногда, довольно редко, придется признать, что это анти-конформер с небольшой примесью гош-конформеров в равновесии. И больше ничего не нужно искать в эритро-2,3-дибромбутане, нет в нём больше ничего. И это невероятно важно: нам дали гибкую молекулу, в которой прямо всё крутится. А оказывается, как только мы идентифицировали конформеры и нашли самый стабильный, можем оперировать этой молекулой так, как будто она имеет жёсткую и определенную структуру. И обратите внимание, что мы совершенно не паримся про другие две связи C-C, те, которые с метилами, хотя у них тоже есть конформации, но ничего нового они в понимание структуры не внесут.
Попробуйте сами проделать конформационный анализ для трео-2,3-дибромбутана, найдите самую стабильную конформацию, и заодно убедитесь, что проекция “змейкой” не всегда соответствует наилучшему конформеру, а следовательно без помощи проекций Ньюмена может дать неверный результат, если вы решаете какую-то стереохимическую задачу и остро нуждаетесь в правильной стереохимии. Ньюмен для этих целей непревзойден по удобству и надёжности.
Почему если конформеров много, так важно знать самый устойчивый
Много или мало эти 1.36 ккал/моль? Мало, очень мало. Если в менее устойчивом конформере есть хотя бы одно гош-взаимодействие более-менее крупных групп (галогенов, более тяжелых чем фтор; фенильных колец, разветвленных алкилов от изопропила и далее, и т.п.) разница в энергиях более и менее устойчивых конформеров будет существенно больше, а значит и соотношение более и менее устойчивых конформеров станет совсем подавляющим (всего в два раза больше – 2.72 ккал/моль – обеспечит вам соотношение 99:1, а в три раза больше, т.е. около 4 ккал моль, а это по-прежнему не очень много – 999 к одному – поди найди в такой смеси эти менее устойчивые изомеры!
Естественно всё это относится к комнатной температуре. Если температура повышена, то содержание менее устойчивого конформера относительно возрастет, например, если температура на 100 градусов больше комнатной, то 1.36 превратится приблизительно в 1.8. Тоже немного на самом деле и при разнице в энергиях более и менее устойчивого конформера в 4 ккал/моль смесь все равно будет состоять почти нацело из более устойчивого конформера.
А вот при понижении температуры преимущество более устойчивого конформера становится подавляющим, даже и при совсем небольшой разнице. При понижении от комнатной на 100 градусов вниз, а это как раз приблизительно температура сухого льда, разница, обеспечивающее 10-кратный перевес становится меньше 1 ккал/моль, а такую разницу более и менее устойчивого конформера обеспечит хотя бы одно лишнее гош-взаимодействие даже маленьких групп типа метилов. Отсюда вывод – при низкой температуре можно вообще не замечать ничего, кроме самого устойчивого конформера. Такое поведение иногда образно называют “вымораживанием” самого устойчивого конформера. И совершенно очевидно, что если разница в энергиях более и менее устойчивых конформеров побольше от 3 ккал/моль и выше, то это самое “вымораживание” фактически происходит уже при комнатной температуре, а если 5-6 ккал/моль и более (для этого потребуется гош-взаимодействие по настоящему крупных групп) – то и при температуре кипения замерзнем. Такое жаркое “вымораживание” можно называть вымораживанием большими заместителями, или стерическим вымораживанием.
Мы очень активно будем использовать “вымораживание” при решении стереохимических задач именно для того, чтобы не связываться с рассмотрением менее устойчивых конформеров – это не проблема, но просто лишняя морока.
И если будете пользоваться “вымораживанием”, не забывайте, что в нём есть некоторая некорректность. Оно описывает только положение равновесия, только относительное содрежание более устойчивого конформера. Но не скорость собственно процесса конформационного превращения. Скорость, в отличие от равновесия “заморозить” намного сложнее. Об этом подробнее на следующей вкладке.
А почему же тогда нельзя вообще забыть про менее устойчивые конформеры?
Если коротко, то потому что из менее устойчивых конформеров иногда, а точнее довольно часто, получаются самые интересные, самые вкусные продукты.
По той же причине – они, эти конформеры, являются частью равновесия, а равновесие (химическое) – совершенно удивительная вещь. Равновесие даёт шанс всем – и бедным, и богатым, в смысле, и более и менее стабильным. Проявив прыть, бедный может вырваться вперед ленивого богатого и захватить большую долю, а иногда и всё, все 100%. Да здравствует равновесие!
Никогда не нужно забывать, что равновесие состоит из двух важных вещей, ведущих себя немно по разному – собственно равновесие, определяемое константой равновесия, то есть разницей свободных энергий между участниками равновесия; и скоростью достижения равновесия, которое зависит от совершенно иной величины – энергетического барьера между участниками равновесия. Барьер почти всегда намного, в разы больше разницы свободных энергий. Но поскольку зависимость скорости от барьера другая, чем зависимость положения равновесия от разности свободных энергий, даже довольно высокий барьер не мешает быстрому установлению равновесия. Одним из следствий этого является то, что даже при пониженной температуре, когда равновесие сильно или почти нацело сдвигается к более устойчивому конформеру, скорость конформационного превращения остается высокой, и в этом смысле равновесие очень трудно, почти невозможно “заморозить”. Подробнее поговорим об этом на вкладке про конформации в кристаллах.
Представьте себе, что у вас есть реагент, существующий в виде двух конформеров, A и B, в равновесии, и равновесие почти целиком смещено в одну сторону (то есть константа равновесия сильно меньше единицы). Определённости ради, примем что в сторону A, и в равновесной смеси это соединение преобладает, хотя бы и в соотношении 9999:1 или даже ещё больше. Но иногда бывает так, что есть какая-нибудь реакция, которая идёт как раз с менее стабильным конформером с образованием какого-то продукта, а основной конформер в ней не реагирует.
И в этом случае реакция пойдет именно через менее стабильный изомер, присутствующий в равновесии с малых количествах (есть большой соблазн коротко называть такие конформеры или компоненты мажорным и минорным, просто взяв эти определения из английского, где их точно так и называют major|minor, но, к сожалению, у этих слов в русском такой сильный музыкальный смысл, что многих, и меня в том числе, это коробит – но если хотите, называйте смело, это уже почти общепринятые термины). И через равновесие, весь исходный реагент понемногу прореагирует через менее стабильный конформер. И это продолжит происходит даже при пониженной температуре. 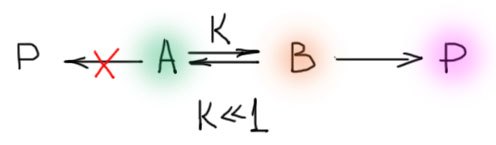
Часто ли это бывает? Довольно часто. С типичным примером мы столкнемся уже скоро в реакции Дильса-Альдера, где реагирует как раз менее стабильный конформер диена, и реакция вполне идёт, хотя и при нагревании, когда, как мы видели, содержание менее стабильных конформеров сильно увеличивается.
Хорошо, менее стабильный конформер реагирует, а более стабильный не реагирует. Но ведь это означает, что данная нежёсткая молекула в этой реакции вполне реакционноспособна, а что нам за нужда точно знать, из какого конформера происходит реакция? Реагирует и реагирует, а как реагирует – не наши проблемы! Можно и так сказать, но некоторым позитивным знанием нас это вооружает в любом случае, и такое знание может иногда очень сильно пригодиться. Когда реагирует менее стабильный конформер, которого в равновесной смеси очень мало, скорость реакции обычно очень мала просто по причине низкой концентрации реагирующего конформера – скорость почти всегда зависит от концентрации реагента. И тогда мы увидим, что если разница в энергиях конформаций не очень велика, реакция идёт, а если побольше, то практически не идёт – скорость становится такой малой. Представление о конформационном равновесии помогает нам это оценить и понять. В той же реакции Дильса-Альдера можно найти очень яркие примеры такого поведения. И в реакциях элиминирования мы часто видим, что более стабильный конформер имеет неподходящее расположение протона и уходящей группы, а менее стабильный, наоборот, подходит идеально: в таких случаях реакция элиминирования идёт, но медленно.
Принцип Кёртина-Гаммета
Раз уж мы сюда забрались, посмотрим на еще один важный случай. Та же самая история – два конформера, один более стабильный, которого много, второй менее стабильный, и его мало. Но реагируют оба, и с разной скоростью, образуя разные продукты. И очень часто бывает так, что менее стабильный конформер реагирует быстрее более стабильного – это часто бывает в химии, когда менее стабильное соединение обладает более высокой реакционной способностью, хотя это и не закон Природы, и даже вообще никакой не закон, просто наблюдение над сотнями и тысячами разных реакций. Вопрос: можно ли что-то сказать про то, какого продукта образуется больше – того, что образуется из более стабильного конформера, или того, что из менее стабильного.
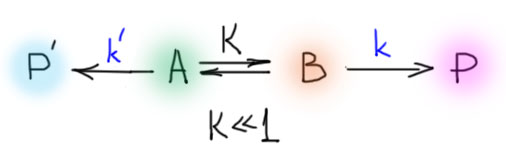
Да, можно и легко. Этот случай, оказывается, очень часто встречается в химии (не только в органической) и называется кинетикой Кёртина-Гаммета (или принципом Кёртина-Гаммета), Не будем писать никаких формул, просто скажем, что соотношение продуктов зависит как от константы равновесия, так и от соотношения констант скоростей обеих реакций. Если константа скорости менее стабильного конформера действительно больше константы скорости более стабильного конформера, и отношение констант скоростей больше чем константа равновесия, то получится больше продукта как раз из менее стабильного изомера. Сильно больше, если отношение констант скоростей сильно больше константы равновесия. На повседневном языке можно сказать так – скорость перешибает равновесие. Ей, кстати, довольно сподручно это делать, потому что обычно диапазон изменения констант скоростей намного шире чем диапазон изменения констант равновесий.
На этом остановимся, так как на 3 курсе нам это точно не понадобится. Но если решите выйти за рамки курса, то примеры кинетики Кёртина-Гаммета повалятся на вас сотнями там, где и не ждали. Это одна из самых распространенных ситуаций, определяющая селективность в самых разнообразных процессах.
Но про некоторые конформеры можно смело забыть и это очень хорошо
Мы разобрались с 2,3-дибромбутаном, занимаясь только связью между 2-ым и 3-им атомами углерода, и не обращая внимания на метилы, которые тоже крутятся. А они крутятся, образуя, каждый, еще по три конформера. Поэтому, если мы спросим себя, а сколько всего конформаций у эритро или трео-2,3-дибромбутана, мы получим три в кубе (каждая связь имеет три независимых положения, связи три, по законам комбинаторики получаем три в кубе). Но конформации по метилам одинаковы, поэтому можно для всего, кроме расчета энтропии, до которой нам дела нет, считать, что метилы фиксированы в любой заторможенной конформации, и все сводится к трём конформерам по центральной связи, которые мы уже обсудили. Получается довольно удобно – мы рассматриваем только конформации по той связи, которая на по каким-то причинам интересует, и не требуем возиться во всеми конформациями молекул, содержащих несколько связей, способных к вращению.
Если мы возьмем молекулу подлиннее, например, дибромгексан, гептан или еще подлинее. Получим довольно интересную ситуацию. Мы по прежнему рисуем и разбираем конформацию по связи между углеродами с бромами. Но остальные части молекулы уже имеют очень много конформаций каждая. Это важно или нет?
Чрезвычайно важный ответ на этот вопрос гласит – нет, не важно. Плевать нам на эти конформации. Это чрезвычайно упрощает дело, когда нам попались молекулы побольше. Мы всегда обращаем внимание на то, что происходит в той части молекулы, от которой мы ожидаем какую-нибудь реакцию. Остальная часть молекулы может делать всё, что ей заблагорассудится. Это работает не всегда, бывают исключения, но как правило нет. Поэтому, если мы будем анализировать реакции 2,3-дибромбутана и, например, 5,6-дибромдекана, мы будем делать одно и то же, рассматривая конформации по связи С-С, несущей атомы брома. А всё остальное нам, скорее всего, не понадобится. Эту возможность трудно переоценить, настолько она облегчает жизнь.
Конформеры - это изомеры? Если да, то какие?
Да, безусловно. Конформеры – это изомеры. Но вопрос, какие это изомеры, весьма непрост.
Начнем с безусловных вещей, которые легко устанавливаются осмотром соответствующих конформаций глазом. Конформеры образуются друг из друга вращением вокруг связей, допускающих такое вращение. Обычно это простые (одинарные, single) связи. При таком вращении в структуре молекулы не изменяется ни одна связь – количество связей, их тип, на каждом атоме остается тем же самым. Поэтому конформеры – это типичные стереоизомеры. При этом при сравнении конформеров друг с другом можно получить две ситуации. Возьмем тот же 2,3-дибромбутан, тот же эритро. Сравнив анти- и любой гош-конформер, мы без труда найдем пары атомов, находящихся на разных расстояниях друго от друга. Те же бромы. Значит, это типичные диастереомеры. Но если мы сравним два гоша (+60 и -60 градусов), то не найдем таких пар. И с удивлением обнаружим, что эти два конформера являются отражением друг друга в зеркале. Да-да, точно так и есть, они энантиомерны. У таких конформеров нет плоскости симметрии, как же им не быть энатиомерными. Да и сами можете в этом убедиться. Возьмите одного гоша и отразите его в зеркале и проверьте, что получится, просто покрутив это отражение целиком (целиком!!!), например, как на картинке: зеркало поставили снизу, отражение целиком(!) перевернули так что задний углерод стал передним (ни в коем случае не крутите связи, только всю молекулу!!), и потом опять целиком крутаните вокруг C-C на 120 градусов по часовой стрелке. С удивлением обнаружите второй гош-конформер. Что и требовалось доказать. 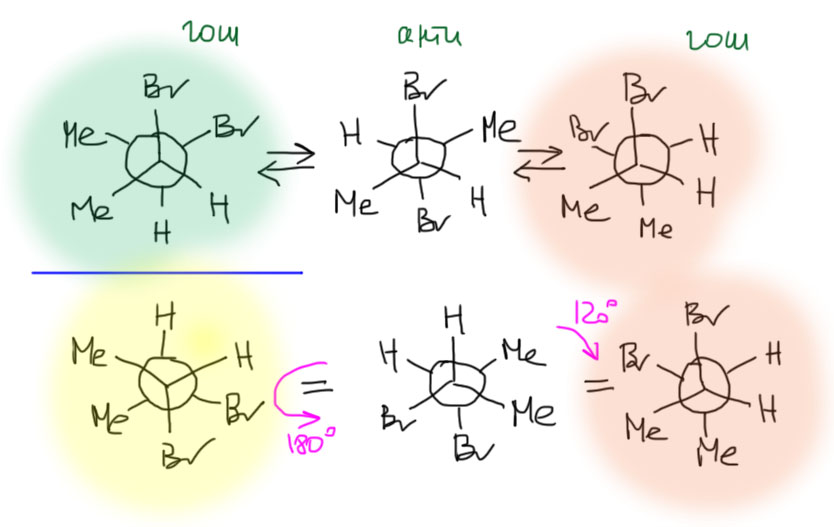
Это немного удивительное открытие показывает нам одну очень странную вещь. Давайте не забывать, что крутим мы сейчас эритро-2,3-дибромбутан, а это, чёрт побери, оптически неактивная мезо-форма, как мы однажды уже договорились. И откуда же мы в оптически неактивной мезо-форме вдруг обнаружили энантиомерные, то есть заведомо оптически активные конформеры! Караул, кругом жулики и воры!! Обман, везде обман!!!
Спокойно. Всё в порядке. Повторю еще раз ту истину, мимо которой многие пролетают с ветерком, не заметивши. Оптическая активность – это свойство вещества, а не молекулы. Очень большого количества молекул, образующих вещество. И мы говорим про это свойство только в жидкости, в растворе (в твердом состоянии оно тоже, естественно, есть, но там всё намного сложнее, к оптической активности добавляется анизотропия кристалла, лучше в это не лезть). А в жидкости конформеры находятся в тепловом равновесии, и поскольку энергии двух энатиомерных гош-форм, естественно, совершенно одинаковы, они по определению содержатся в совершенно одинаковой концентрации. Сама Природа, природа равновесия заботится об этом с потрясающей точностью. И ведут себя как обычная рацемическая смесь, гася оптическую активность друг друга. А третий конформер, самый стабильный, просто нехирален – он имеет плоскость симметрии, совершенно очевидную из конформации. Теорема доказана – мезо-форма действительно оптически неактивна, хотя состоит в значительной степени из энантиомерных гош-конформеров.
Естественный вопрос – а нельзя ли их оттуда достать по отдельности, разделить гош-конформеры и получить чистые энантиомеры. Увы, нет. Или, точнее, это выполнимо при определенных условиях. Конформационные равновесия достигаются очень быстро, намного быстрее, чем любой мыслимый способ разделения, к тому же практически все способы разделения сами по себе представляют собой равновесные процессы (фазовые переходы, растворение, сорбция, комплексобразование и пр.). Нам нужно было бы работать при пониженных температурах, когда конформационное превращение “заморожено”. Увы, и методы разделения точно так же “замерзают” при понижении температуры. Для простых соединений, типа уже намозолившего глаза бибромбутана барьеры вращения слишком малы, и заморозить их можно только при очень низкой температуре, при которой ни один метод разделения уже не работает. Вот если бы барьер вращения был побольше! Побольше чем что? Оценки вполне известны, и их в принципе легко получить из простых формул кинетики и термодинамики. Оценки сходятся на том, что если барьер меньше 20 ккал/моль, то шансов нет совсем – равновесие слишком быстро как при комнатной температуре, так и при разумном охлаждении, при котором еще возможно пользоваться какими-то методами разделения. Увы, 20 ккал/моль это уже очень много, и в нециклических конформерах даже эта величина труднодостижима – большинство барьеров вращения простых связей C-C меньше 10 ккал/моль, и в этом случае равновесия усnанавливаются за доли секунды.
Вот если барьер выше 20, а ещё лучше 30 ккал/моль, тогда такие конформеры можно не только разделить, но и затем хранить в чистом, оптически активном виде часами и днями (если меньше 30 ккал/моль), и даже годами (если больше). Такие конформеры принято называть атропоизомерами, то есть буквально изомерами, которые не могут перекрутиться один в другой.
К сожалению, среди простых нецикличесих алифатических молекул таких пока не известно, хотя ничего особенного в этом нет, и кто-нибудь сильно упорный наверняка довольно скоро что-нибудь такое получит. Больше всего таких молекул среди ароматических, и хотя это от нас пока далеко, принцип вполне нам понятен – в любом случае за вращение отвечает простая связь C-C, а ароматические кольца работают как жёсткие, а следовательно очень удобные для изучения заместители. Исторически самую первую такую молекулу нашли почти 100 лет назад среди производных дифенила – двух бензольных колец, связанных простой связью, вокруг которой происходит вращение. В обычном незамещенном дифениле это вращение происходит с небольшим барьером, и это ничем принципиально не отличается от этана, бутана и других алифатических соединений, кроме того, что конформеров не три, а два, ну и тем проще. Эти конформеры всем похожи на энантиомерные гош-конформеры в простых нециклических соединениях, кроме разве того, что их только два, а анти-конформера здесь просто нет, и хорошо, он только под ногами бы путался без толку. В незамещенном дифениле они быстро превращаются друг в друга, но стоит в орто-положения вставить почти любые заместители, они будут цепляться друг за друга, и вращение совсем остановится. И если пара заместителей разная, то пойманные в ловушку конформеры будут энантиомерны, оптически активны. Посмотрите сами и убедитесь и в этом, и в том, что ситуация принципиально (кроме высокого барьера) не отличается от той, что изображена на картинке сверху. Такие атропоизомеры отлично разделяются обычными методами разделения энантиомеров, и как только мы их разделим, они устойчивы и не теряют оптической чистоты годами
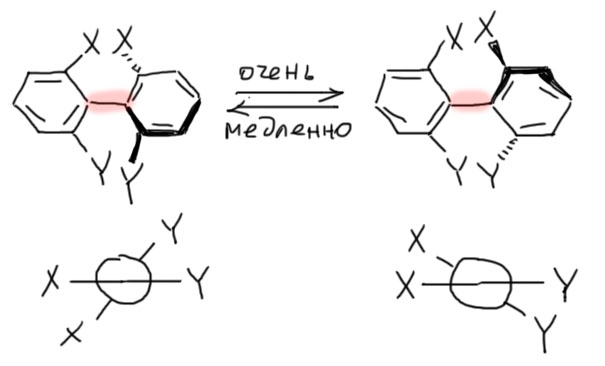
С тех пор оптически активных атропоизомеров было получено великое множество. Это невероятно модные соединения, исследуемые в самых разных областях химии, упомянем хотя бы одно – на их основе делают эфективные катализаторы для реакций, приводящих к оптически чистым продуктам (это называется асимметрическим или энантиоселективным синтезом). Современная химия просто жить не может без оптически активных аторопоизомеров. Разберитесь, почему если заместители одинаковые (все X), атропоизомеры оптически неактивны.
Сам термин атропоизомерия необычайно интересен, потому что вызывает множество очень мрачных ассоциаций и аллюзий, непрестанно крутящихся вокруг смерти, и сам его изобретатель в этом очень плотно поучаствовал.
Явление атропоизомерии было открыто еще в 1922 году Джеймсом Кеннером в Англии (J. Chem. Soc., Trans., 1922, 121, 614) – удалось разделить на оптические изомеры 6,6’-динитродифенил-2,2’-дикарбоновую кислоту (на схеме замените X на нитро-группу, а Y на карбоксил), доказав, что дифенил не является плоской молекулой, как считалось ранее. Но англичане не дали названия этой стереоизомерии, фантазии не хватило, у англичан традиционно не очень хорошо с фантазией, от этого у них такая скучная кухня и архитектура. Сделал это австриец, лауреат последней предвоенной Нобелевской премии 1939 года Рихард Кун, весьма лояльный нацизму, но несмотря на это, вместе с другим поклонником фюрера Адольфом Бутенандтом, не получивший разрешения от Гитлера принять премию. После войны оба получили свои медали и денежки, но репутацию было уже не вернуть – слишком наследили оба в Третьем рейхе. В наше время на этого деятеля смотрят очень косо, потому что в годы нацизма он успел отметиться в разных очень мерзких делах. Тогда его карьера развивалась стремительно. В 1938 немецкие химики избрали его фюрером Немецкого Химического Общества. Вот так прямо и назвали. Среди его известных научных достижений синтез одного из основных фосфорорганических отравляющих веществ зомана как раз в середине войны. Можно долго не гадать на ком испытывались результаты исследований учёного. Впрочем, есть сведения, что он очень хорошо был осведомлён об испытаниях разных веществ, и не только зомана, на заключённых. После войны он, как многие, прикинулся веником, скромным учёным совершенно вне политики, долго не отсвечивал, и в Германии продолжил научно-административную карьеру. Но правда о его достижениях понемногу повылезла, впрочем, он успел помереть вовремя и никаких реальных неприятностей не имел.
Вернёмся к атропоизомерии: символично, что сам термин Кун ввёл в 1933, годе прихода нацистов к власти, можно сказать отметил успех любимого фюрера, которого всячески прославлял все последующие годы. Вряд ли он сам придавал какое-то метафизическое значение придуманному им слову, имея в виду самое банальное – не крутится и всё тут. Но слова иногда играют людьми, а иногда и целыми нациями. В корне нового термина оказался зарыт совершенно зловещий смысл, созвучный русской поговорке “Сколько верёвочке не виться…”. Сама этимология этого термина выдает мрачную игру судьбы в прямом и переносном смысле. Первая половина слова – атропо – происходит из греческого. Так называлась одна из трёх богинь судьбы, мойр. Греки мыслили судьбу человека, не только Рихарда Куна, но вообще человека, метафорически. Троица мойр пряли нить судьбы человека, наматывая её на челнок, оборот за оборотом. Одна пряла, вторая наматывала, а третья – Атропос – в один прекрасный момент решала, что достаточно уже оборотов и решительным движением резала нить. Отсюда имя – А-тропос – то есть нет оборотов, не крутится больше челнок, и не наматывается нить судьбы. Уносите. В римской мифологии аналог мойры Атропос называется еще более ясно – Морта.
Неразрывная ассоциация со смертью греческой богини-мойры Атропос всплыла еще один раз, когда Карл Линней составлял современную классификацию животных и растений, вводя систематические названия, всегда состоящие из родового и видового определений. Для знаменитого растения белладонны (по-русски это называют, фактически буквально переводя с итальянского bella donna, красавкой) он должен тоже был придумать название из двух слов. Он и придумал, вспомнив про смертельный яд, содержащийся в этом растении – немало людей отправилось на тот свет с его помощью с античных времён – назвав его Atropa belladonna, так богиня стала родовым названием одного из знаменитых растений семейства паслёновых (напомню, что из того же семейства перец, картошка, помидоры и баклажаны). Потрясающее сочетание смерти и красавицы в названии растения появилось оттого, что женщины с древних времён научились закапывать в глаза несколько капель настоя этого растения – зрачки от этого расширялись и красавица делалась совершенно неотразимой, невольно играя со смертью. Ну и понятно, что действие это вызывает содержашийся в белладонне алкалоид, названный по растению атропином – он блокирует связывание ацетилхолина холинорецепторами, нервные импульсы блокируются и наступает всеобщее расслабление всяких мышц, в том числе тех, которые сужают зрачок.
Если учесть, что атропин – основное противоядие (антидот) при отравления фосфорорганикой, в том числе зоманом, получается, что судьба Куна выдала совершенно головокружительный оборот с неповторимой игрой слов – от введения термина атропоизомерия в начале нацизма, до изобретения зомана почти в самом конце. Кому-то наверняка захочется перекинуть мостик и в наши дни, но мы не будем. Это тот случай, когда и так всё ясно.
На этом месте можно было бы остановиться, но иногда в литературе нередко попадается ещё одно слово, явно имеющее отношение к тому же самому – ротамеры, очевидно происходящее от слова rotation, вращение. Изомеры вращения, так как-то получается. Но это же конформеры? Да, именно так. Чаще всего это слово используют для обозначения конформеров, которые можно как-то экспериментально наблюдать, например, с помощью разных спектров, особенно ЯМР. Как видим, никаких особых значений у него нет. Совсем лишнее слово, я бы даже так сказал. Не советую его вообще применять, если только вы не будете заниматься какой-то особой областью химии, где это слово приобрело популярность, став таким узкоспециальным жаргоном. Такие области есть, и занимаются они обычно очень сложными молекулами. А нам оно не нужно.
Если конформеры это изомеры, то почему мы так их и не называем?
Конформеры – это стереоизомеры. И во многом отношения, например, между анти- и гош-конформерами, очень похожи на отношения между транс– и цис-диастереомерами алкенов. Более того, возьмём самый простой случай – бутан и 2-бутен.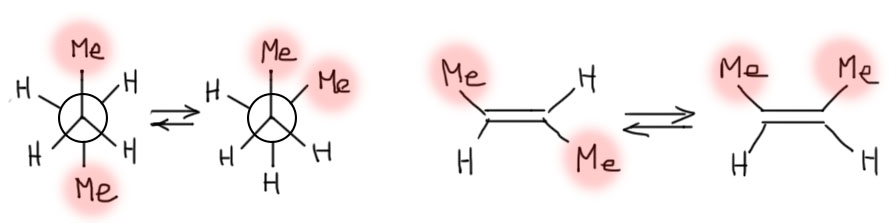
Что мы видим: видим два равновесия (гош-конформеров, как мы знаем, на самом деле два, но это сейчас не важно, и мы этим сейчас пренебрежем, чтобы не перегружать картинку).
Про первое мы знаем, что анти-конформер стабильнее гош-конформера. Про цис-транс мы знаем, что транс стабильнее циса. Меньшая стабильность гоша и циса по сравнению с анти и транс объясняется стерическим отталкиванием метильных групп. Это отталкивание довольно слабое, и для нас тогда не будет сюрпризом, что разница в обоих случаях почти одинакова, для простоты округлим и получим и там, и там около 1 ккал/моль. Действительно так и есть, и это значит, что константы равновесия обоих процессов практически одинаковы, и содержание более стабильной формы в обоих случаях в равновесной смеси очень близко, опять округлив, получим что-то около 70%.
А вот скорость достижения этого равновесия очень сильно различается. Эта скорость зависит от энергии активации прямой или обратной реакции. В первом случае – н-бутана – мы называем эту энергию барьером вращения, и знаем, что она очень невелика, около 3 ккал/моль, а это означает, что не только при комнатной температуре, но и при очень приличном минусе, равновесие устанавливается за доли секунды. Это означает, что у нас нет шансов разделить эти конформеры, мы всегда будем видеть только равновесную смесь. О том, что будет, если мы это попробуем заморозить, можно почитать на отдельной вкладке про конформеры в кристалле. Там будет объяснено, почему у нас есть шанс получить чистый более устойчивый конформер в кристаллическом виде, но нет ни малейшего шанса получить гош-конформер. Конформеры – это изомеры, но принципиально неразделимые, такие, которые превращаются друг в друга быстрее, чем мы можем пытаться их разделить. У нас был бы шанс только если бы мы умели хватать отдельные молекулы конформеров, на лету определять, кого поймали, и класть каждую в отдельную баночку при очень низкой температуре, замораживающей конформационное превращение (жидкий азот пойдёт, но вопрос, а что значит “заморозить отдельную молекулу” выведет нас на очень сложную науку, которую мы трогать не станем, просто признаем, что, наверное, как-то это делают, как у нас любят выражаться, специально обученные люди). Ясно, что всё это фантастика, а мы остаемся с тем же самым: конформеры невозможно разделить.
А вот во втором случае – 2-бутена – скорость достижения равновесия очень мала. Пренебрежимо мала, настолько мала, что ее невозможно измерить. А это означает, что энергия активации прямой или обратной реакции очень велика. Эту энергию активации оценивали разными способами, и получили величину не менее 90 ккал/моль. Это очень много. Для того, чтобы реакция с таким барьером активции пошла с заметной скоростью понадобилась бы очень выскокая температура, при которой одновременно происходили бы процессы термического разложения бутена. Поэтому и цис- и транс-2-бутены вполне стабильны и при комнатной температуре и при разумном нагревании. Если мы их разделим, а ничего сложного в этом нет, у них даже температуры кипения различаются, и при наличии ректификационной колонны проблем в фракционной перегонке не будет, – они будут устойчивы, и их можно хранить, продавать, дарить, закладывать в ломбарде, завещать потомкам, всё, что угодно, и что не противоречит Гражданскому кодексу Российской Федерации.
Сравнение выглядит приблизительно так. Естественно, в относительной шкале энергии, так как абсолютные величины для алкана или алкена сильно различаются, но для сравнения это совсем не важно. И эта картинка очень наглядно показывает, что когда мы имеем дело с равновесиями, очень важно понимать разницу между константой равновесия (то есть, составом равновесной смеси) и скоростью достижения равновесия. Но с точки зрения стереохимии, в обоих случаях происходит одно и то же – вращение вокруг всязи, но в однос случае очень лёгкое, а в другом невозможно трудное. В одном случае барьер вращения маленький, в другом – огромный. В одном случае мы говорим про конформеры, в другом – про изомеры, диастереомеры.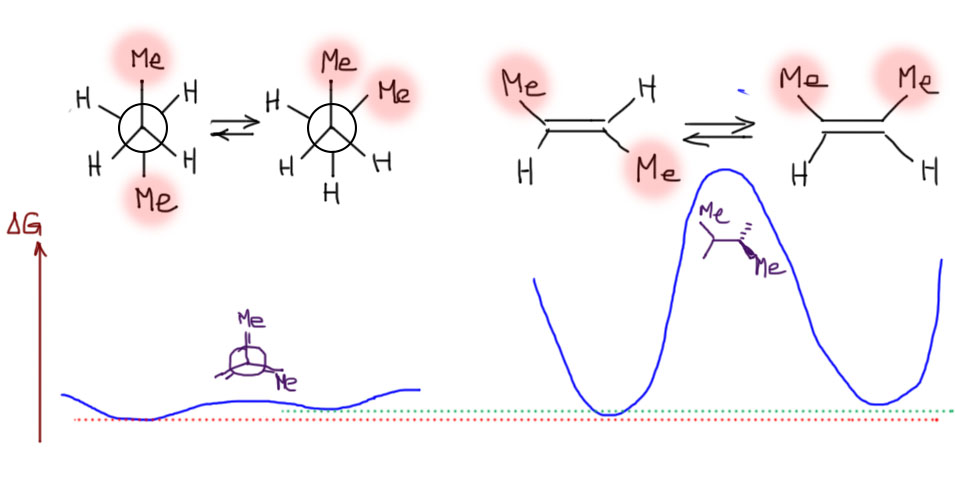
Это очень ясная картина, не правда ли? Но химия не была бы химией, если бы не предоставляла возможностей влиять на всё, на что только можно влиять. Можно ли влиять на равновесие? Да, конечно, той же температурой. Мы с этим уже знакомы. Понижаем температуру, увеличиваем содержание более устойчивой формы. Повышаем – всё наоборот, любая константа равновесия стремится к единице, к равному содержанию форм, хотя в реальных условиях органические соединения редко выдерживают температуры выше 300 градусов и просто начинают разлагаться.
А на скорость достижения равновесия. О, это проще и интереснее, и вариантов гораздо больше. Например, катализ – катализатор не влияет на положение равновесия, но может в огромной степени влиять на скорость достижения равновесия, скорость прямой и обратной реакции. И тогда нас ждёт не только полезный результат, но и маленький сюрприз – изомеры могут превратиться в конформеры. Изомеризация цис/транс очень любит всякий катализ – огромное количество соединений очень сильно ускоряют цис/транс изомеризацию. Одно из таких веществ – просто молекулярный иод. Я не хочу здесь разбирать, как он работает – любой катализатор как-то химически взаимодействует с реагентами, регенерируясь в конце реакции. С точки зрения энергии активации, катализатор ее, энергию, эффективно понижает. На самом деле там просто идёт другая реакция, часто многостадийная, с участием катализатора, но результат у нее тот же, в данном случае, изомеризация. Так вот, если мы добавим иод или иной катализатор, скорость достижения равновесия возрастет настолько, что мы получим ту самую равновесную смесь, а если попробуем разделить изомеры, не избавившись от иода, у нас ничего не выйдет – изомеры будут быстро изомеризоваться, и вы все время будете получать равновесную смесь. Можно сказать так: катализатор, например, иод облегчает вращение вокруг двойной связи. А можно даже так: катализатор, например, иод разрешает вращение вокруг двойной связи. На артинке покажем это немного условно – я там показал пунктирчиком на кривой с иодом наверху барьера потому что действие катализатора нельзя показать просто понижением барьра – там по дороге будет еще одна или несколько стадий, но важно то, что в каждой из них энергия активации будет не выше этого формального барьера, показанного пунктирчиком.
И в этих условиях цис- и транс-изомеры вполне можно рассматривать как конформеры. Сразу скажу, что так делать не принято, но суть дела мы должны понимать, и тогда никто не может нам запретить использовать это слово в таком контексте. 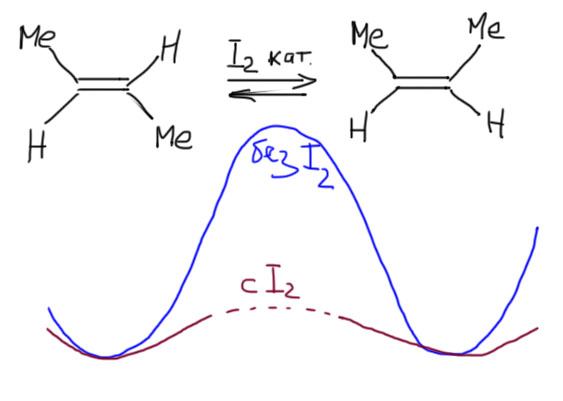
Вообще, в химии, да и в любой другой содержательной науке, имеющей дело с реальными вещами, совершенно бесполезно просто заучивать понятия с определениями, как это очень любили делать в советской школе, потому что так требовалось по шаблонам марксизма-ленинизма: всё время требовалось дать определение того, дать определение сего. Если мы хотим свободно ориентироваться в огромном материале химии, лучше попробовать разобраться в том, как работают химические реакции, и особенно хорошо понимать, чем отличается равновесие (термодинамика) и скорость (кинетика).
В чем разница между понятиями конформация, конформер и конфигурация
Вообще-то это очевидно, но почему-то этот вопрос регулярно всплывает и даже считается чуть ли не трудным. Ничего трудного в этом нет, нужно только серьезно относиться к определениям научных терминов. Проблема может быть в том, что если у понятий конформация и конформер вполне точное определение есть, то конфигурация – термин не такой строгий, он возник сам собой в разных местах и с разными смыслами, и никтотак и не озаботился тем, чтобы сделать его более определенным. .
Конформер – это реальная молекула, соответствующая одной из конформаций с минимумом энергии.
Еще раз напомню, что конформация это структура, стереохимическая формула конформера, а конформер это форма молекулы, получаемая вращением вокруг какой-нибудь связи. Конформеры – это реальные, существующие молекулы,
А вот понятие конфигурация определено не так однозначно. Оно используется в двух смыслах.
Первый – это просто слово для обозначения конкретной стереохимии молекулы или части молекулы. Вот, например, у вас есть молекула с двойной связью, и вы определили, что эта двойная связь имеет E- или Z- … что? – вот как раз конфигурацию. Точно так же мы скажем R-конфигурация, S-конфигурация, эритро-конфигурация и т.п. Любое слово, обозначающее стереохимию можно использовать со словом конфигурация. Это просто удобно. И в обсуждении сложной молекулы со сложной стреохимией удобно, разговаривая не обо всей молекуле, а о части ее, говорить: а поглядите-ка вон на тот стереогенный центр с R-конфигурацией…, а вон, например, два соседних гидроксила в трео-конфигурации…, а вот двойная связь, у неё Z-конфигурация, и т.п. И т.п. Поэтому в этом смысле не совсем термин, а скорее просто удобное слово, заменяющее много других, по-английски такие слова называют generic term.
Второй смысл еще более абстракный – это просто удобное слово для описания геометрии молекулы или многих молекул – любое расположение атомов в пространстве, которое вдруг всплыло при обсуждении реальных или воображаемых молекул и даже не обязательно молекул, удобно назвать конфигурацией. Например, кто-то решит обсудить, что будет при приближении атома хлора к молекуле метана с разных сторон – со стороны атома водорода или между двумя атомами водорода. Будет нарисована картинка для обоих случаев, возможно, проведены расчеты. И в обсуждении можно сказать что-то типа того, что первая конфигурация представляется мне более подходящей чем вторая конфигурация для реакции отщепления атома водорода. И в этом смысле, если мы обсуждаем молекулу, в которой есть внутреннее вращение, то конфигурации, получаемые этим вращением – это и есть конформации. В таком контексте смысл один, но конформация – более точное слово, а конфигурация – более общее.
Длинные алканы и длинные алкильные цепи имеют много конформаций: гидрофобность
Длинные алканы и алкилы в разных соединениях ведут себя немного не так, как предписано азами коформационного анализа – найдите самую устойчивую конформацию и забейте на всё остальное. И всё потому, что в дело вступает самая страшная вещь, перед которой смолкает всё остальное – энтропия. Если мы попробуем нарисовать какой-нибудь более-менее длинный нормальный алкан и спросим, какая конформация в нём самая устойчивая, ответ будет очевиден – это как раз та самая змейка. По очевидной причине – это единственная конформация, у которой на всех C-C связях расположение заместителей (в данном случае это просто части молекулы до и после рассматриваемой связи) – чисто анти, то есть в ней все крупные группы находятся на максимальном расстоянии друг от друга. Понятно теперь, почему мы так любим эту змейку.
Но – такая конформация только одна. А конформаций, в которых у одной из связей расположение гош, а все остальные анти гораздо больше. Они будут менее устойчивы из-за этого одного гоша, но ненамного. А конформаций, у которых две связи гош, а остальные анти еще больше, и они еще чуть менее устойчивы. Вопрос – какую же форму будет иметь эта молекула – змейку или нет? За змейку играет энергия – это самая устойчивая уонформация. А против змейки играет энтропия – форм с немного большей энергией очень много. И чем длиннее алкан или алкил, тем больше. Змейка всегда одна, а скособоченных форм всё больше и больше. И тогда “вымораживание” самой устойчивой формы, змейки, из всего множества конформаций будет давать всё более невыгодную, всё более отрицательную энтропию. И с некоторой длины цепи энтропия переиграет энергию. Можно считать, что уже с 6-7. Следствием этого является очень важное явление – длинные алкильные цепи и алканы гибки, пребывают в непрерывном конформационном превращении между огромным количеством конформаций, не сохраняют определенную форму. Метафорически выражаясь – кишат, как те червячки, которыми кормят аквариумных рыбок.
Одним из важнейших последствий такой гибкости является так называемая гидрофобность, полная несмешиваемость с водой. Действительно, трудно найти что-нибудь более противоположное, чем жидкая вода, молекулы в которой двигаются, сохраняя изумительный порядок, определяемый водородными связями. И алканом, молекулы которого обречены на дикий беспорядок, непрерывное самопроизвольное конформационное движение, и при этом с водой практически не взаимодействуют – просто нечем. Алкан и вода не смешиваются, и практически не растворяются друг в друге. Алкан ненавидит воду – является гидрофобом. Вы можете сказать, что очень многие органические соединения не растворяются в воде. Это так, но только алканы делают это совершенно и полностью – другие молекулы, не имеющие длинных алкильных хвостов обычно имеют небольшую, но вполне измеримую растворимость, не вляются совершенными гидрофобами.
И если у нас есть молекула, которую мы хотим сделать нерастворимой в воде, но растворимой в органических расторителях, на нее навешивают несколько длинных алкильных хвостов. Например, ион аммония, как любой небольшой ион, очень хорошо взаимодействует с водой – мы знаем, что большинство солей аммония в воде растворимо. Стоит нам навесить на азот несколько длинных алкильных хвостов, как полученный ион тетераалкиламмония перестает любить воду, и с удовольствием уходит в органический растворитель. На этом основан межфазный перенос или межфазный катализ, которым мы будем много и активно пользоваться.
Конформационная подвижность и огромное количество близких по энергий конформеров вообще способствуют растворимости в органических растворителях. Это используют не только для межфазного катализа, но и для увеличения растворимости всяких полезных соединений. Большие молекулы, содержащие много ароматических колец или заместителей, образующих прочные межмолекулярные связи (например, карбоксилов), очень часто образуют кристаллы, очень малорастворимые в органических растворителях – молекулы прочно цепляются друг за друга в кристалле. А растворимость нужна и для синтеза таких молекул, и для их использования. Эту проблему почти всегда решают добавлением длинных алкилов, минимум н-бутилов, и тогда побольше, а можно и н-додецилов, тогда и пары хватит. На вкладке про конформеры в кристаллическом состоянии разберемся, почему это так работает.
Не путаем заслонённую конформацию и заслонённый конформер. Первое возможно всегда, второе только в особых случаях
Это очень распространенная ошибка, которую можно встретить даже в очень серьезных и практически безупречных по корректности книжках. Видимо, это связано с тем, что многие считают это маловажной деталью. В принципе, можно было бы к этому не придираться и считать обычным занудством, но в ряде важных ситуаций эта ошибка в терминологии ведёт к глупейшим фактическим ошибкам при анализе стереохимии реальных реакций, например, реакций элиминирования. Давайте попробуем сразу научиться не делать эту ошибку. Для этого придётся аккуратно разобраться в различии понятий “конформер” и “конформация”. Важно понять, что конформер – это реальная вещь, а конформация – абстрактное понятие.
В реакциях участвуют реальные молекулы и образуются реальные молекулы. В реакциях не участвуют воображаемые, абстрактные структуры, и не получаются воображаемые, абстрактные структуры. Следовательно вполне корректно говорить о том, что в реакциях участвуют конформеры и образуются конформеры, но некорректно и даже просто неверно говорить, что в реакциях участвуют конформации.
Единственная воображаемая вещь, с которой можно встретиться при анализе реакции это переходное состояние, но и оно должно как-то разумно сооответствовать исходным молекулам и ожидаемым продуктам. Всё остальное и слева и справа от стрелки реакции – реальные молекулы, частицы, имеющие время жизни, соответствующие минимумам энергии. Если мы имеем дело с нежёсткими молекулами, то, это конформеры.
Конформеры – это реальные молекулы. Реальным молекулам всегда соответствуют минимумы энергии. Два конформера – это два минимума энергии, разделенных небольшим потенциальным барьером. Небольшой барьер это обычно несколько килокалорий на моль. Такие барьеры достаточно легко преодолеваются просто за счет теплового движения молекул в жидкости, когда молекулы, сталкиваясь, случайным образом обмениваются энергией, что дает возможность время от времени этот барьер преодолевать. Мы уже видели, что основное время молекулы проводят в таких крутильных колебаниях вокруг формы, которая обычно является одной из заторможенных конформаций. Когда барьер преодолевается молекула попадает в другую заторможенную конформацию и колеблется уже вокруг нее, пока не представится возможность скакнуть в слеудующую. И так всю жизнь.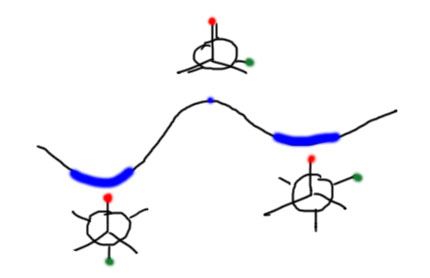
Конформеры поэтому почти всегда соответствуют заторможенным конформациям – гош или анти, с двугранными углами 60, 180, -60 градусов.
Когда молекула перепрыгивает барьер на ничтожное мгновение пролетает заслонённые конформации с углами 0, 120, -120 градусов. Этим конформациям соответствуют максимумы энергии . Молекула не живёт в этой форме, это просто точка на оси координат, переходное состояние. Мы имеем право говорить о конформации, потому что это формальное понятие – форма молекулы, полученная вращением вокруг связи, как будто у нас не настоящая молекула, а ее моделька из шариков и соломинок. Модельку можно крутить как угодно, на любой угол, и любая такая форма будет конформацией. Мы можем захотеть конформацию с двугранным углом в 24 градуса, 77 градусов, да сколько угодно. И на модельке без труда этого добьемся (хотя придётся вооружиться транспортиром). Но для химии такие конформации даром не нужны – им не соотвествует ничего реального. Это точки на диаграмме зависимости энергии от двугранного угла – такую диаграмму можно довольно легко получить квантово-химическим рассчетом, но не экспериментально. Экспериментально из константы равновесия между конформерами мы можем узнать энергии минимумов, то есть конформеров, и, из константы скорости конформационного превращения – величину барьера между конформациями. Ни про какие промежуточные точки мы экспериментально ничего не узнаем. Если вы еще немного помните мат. анализ, без труда поймете почему – точка это бесконечно малая, и ровно таково – бесконечно мало, то есть просто равно нулю, её время жизни. А то, что не имеет времени жизни, невозможно поймать – любое измерение или наблюдение бесконечно дольше бесконечно малой, пока измеряете или наблюдаете, молекула успевает совершить множество движений. Попробуйте даже очень навороченным фотоаппаратом с сумасшедшей выдержкой 1/8000 сек поймать резким движение, занимающее 1/100000 секунды – ничего не выйдет, получите просто смазанный след, если вообще что-то получите. Но здесь разница между возможностями экспериментальных методов и внутримолекулярным движением больше еще на многие-многие порядки. Поэтому говорить о таких конформациях бессмысленно. А нельзя ли их как-то хитро заморозить, подумают некоторые мечтатели. Нет, нельзя – при понижении температуры вы будете всегда оказываться всё ближе и ближе к минимумам, к заторможенным конформациям, и более нигде.
Но мы же говорим про заслоненную конформацию. Да, но тоже только потому, что можем определить величину барьера – мы просто знаем положение этой точки, и знаем, что максимум соотвествует именно этой конформации. Но это такая же точка, как и любая другая, такая же мимолётная, бесконечно малая. Мы теоретически знаем, где она, но не можем на ней остановить движение молекулы, не можем её заморозить. У неё такое же бесконечно малое время жизни, как и у других точек на диаграмме зависимости энергии от двугранного угла. Поэтому и этой конформации не соответстует никакой конформер.
Можно еще попробовать выразить эту ситуацию так: в химии, как и в других естественных науках, есть такое понятие “наблюдать”. Наблюдать – это означает каким-то образом экспериментально получать информацию об объекте наблюдения – с помощью какой-нибудь спектроскопии, или другого экспериментального метода. Наблюдать можно только то, что существует, имеет время жизни. Может это время жизни быть очень малым? Может, если у вас есть метод наблюдения в таких малых временах – у каждого экспериментального метода есть характеристические времена наблюдения, и это могут быть и минуты, и секунды, и миллисекунды, и микросекунды, и даже наносекунды, если есть что-то совсем современное. Но это не может быть нисколько секунд, ноль секунд. Мы можем наблюдать конформеры, реальные молекулы, потому что их время жизни достаточно для наблюдения. Но не можем наблюдать переходное состояние или конформации, не соответствующие конформерам – время жизни этих объектов равно нулю.
Так. Нет ли здесь противоречия. Ведь и минимум – такая же точка. Формально да, реально нет. Реально минимум это не точка, а большой кусок потенциальной поверхности вокруг этой точки. Кусок в отличие от точки не бесконечно мал, у куска есть размер, его можно найти. Если вы спросите, можно ли заморозить молекулу так, чтобы она оказалась точно в конформации с двугранным углом точно 60, -60, или 180 градусов, ответ будет точно такой же – нет. Мы же знаем, что в реальной молекуле непрерывно происходят колебания, в том числе те, которыми мы сейчас занимаемся – крутильные. И это колебание-кручение как раз и происходит вокруг такого среднего положения, которое и соответствует этим заторможенным конформациям. Если бы вы взяли тот самый фотоаппарат и навели бы его на эту точку, все равно получили бы размытый след, но без труда по этой фотографии нашли бы центр этого следа. Даже как следует заморозив молекулу, мы бы всё равно получили бы тот же размытый след, только размах его стал бы меньше, и чем ниже температура, тем уже был бы след, но никогда в точку он бы не превратился никогда, даже тогда, когда вы сами бы уже замерзли вместе с модным фотоаппаратом, потому что колебания не прекращаются даже при абсолютном нуле. Когда мы говорим, что наблюдаем конформер, мы наблюдаем именно эту форму, соответствующую минимуму энергии, но непрерывно колеблющуюся вокруг этого минимума. Время жизни соотвествует не нахождению молекулы точно в минимуме, а времени, когда она вокруг него колеблется. Это время может быть сколь угодно велико, если мы не дадим ей превращаться в другие конформеры (понизим температуру, выморозим конформер), или оно может быть достаточно мало, если температура не препятствует превращению колнформеров друг в друга. Но оно не равно нулю.
Самое главное в этом вот что. Время жизни каждого конформера у простых молекул ничтожно. У простых алканов это несколько десятков пикосекунд (при комнатной температуре, в растворе, пико это одна триллионная). У этана около 10 пикосекунд, у бутана в несколько раз дольше. Это же ничто – чихнуть даже не успею! Что о такой ерунде говорить, при чём тут химия? Да, нам жто действительно не нужно, потому что химика волнует не это, а том, в каких формах он может застать молекулы реагента в реакционной смеси – если это известно, то можно представить себе, как эти молекулы реагируют. Тогда нам неважно точное время жизни каждого конформера, но важно знать сколько времени молекула за ее собственное время жизни проводит в этих формах. Ввозьмем тот же этан. У этана все конформеры структурно одинаковы. И переход одного в другой мы и не заметим. Поэтому эти пикосекунды складываются в микросекунды, просто секунды, минуты, часы, годы, столетия, миллионы и миллиарды лет. Этан – молекула устойчивая, и пока не прореагирует, например, не сгорит, так и будет существовать. Миллионы лет – не метафора, этан есть в природном газе, а это образовалось и спокойно булькало в недрах десятки миллионов лет. И даже миллиарды лет – не метафора, этан есть в космосе, а там все времена приблизительно такими величинами и измеряются – таков там возраст молекул. Этан, как многие другие органические и неорганические молекулы совершенно устойчив сам по себе. И вот всё это немыслимое время он живёт в виде одного из своих одинаковых конформеров, и никак иначе.
И если мы вставим в этан два дейтерия, на энергии и барьеры это почти не повлияет, но мы получим возможность различать конформеры. И на времена жизни это не повлияет, будет те же десяток пикосекунд. Поскольку энергии таких конформеров практически одинаковы, можно очень точно сказать, что треть жизни такая молекула живёт как анти-конформер, и две трети как два гоша. И если такая молекула проживёт год, в сумме четыре месяца она будет жить как анти, и восемь, как один из гошей. И ни одной секунды как что-то ещё. Вот, это уже вполне человеческий разговор, потому что пикосекунды как-то в голове не умещаются. Но только в одном мы неправы – мы же договорились не следить за одной молекулой, но только за огромным количеством молекул, за веществом, жидким, чистым или в растворе. И тогда все эти пикосекунды и миллионы лет переводятся в совсем близкую химику вещь – в концентрации, мольные доли. Это очень просто, потому что в такой туче молекул всё усредняется, и времена жизни элементарно переводятся в концентрации или мольные доли. Какова концентрация (мольная доля) единственного конформера этана в жидком этане (растворе этана)? – Ровно 100% (мольная доля = 1). Какова мольная доля анти-конформера в жидком 1,2-дидейтериоэтане или растворе? Одна треть. А гош? Две трети. И больше там нет ничего.
С мольными долями удобно связывать еще одно понятие – заселённость. О заселённости состояний или уровней любят говорить всяческие физики. Но и нам незазорно, ведь конформеры – это тоже состояния во вполне физическом смысле, и даже вполне себе уровни, ведь у каждого есть своя энергия. И если у нас есть вещество, жидкость, в которой N молекул (очень много, неважно сколько, что-то порядка числа Авогадро), и в этой жидкости установилось конформационное равновесие, то каждый из конформеров возьмет свою долю этого числа, в зависимости от их относительной энергии и количества. Суммарная заселенность будет строго равна общему числу N – ни одна молекула не пропадет. У дидейтероэтана три конформера, заселённость каждого одинакова и равна трети от общего числа молекул. Химикам, конечно, милее концентрации и мольные доли, чем заселённости, но химики имеют дело с реальными молекула, в частности конформерами. мино понятие заселенности очень удобно как раз для конформаций, но не конформеров, и оно для них равно нулю. Заселённость состояния молекулы, соответствующего заслонённой конформации равна нулю. Это не конформер. Поэтому мы и не имеем права использовать заслонённую конформацию при обсуждении стереохимии реальных реакций. Молекула не может реагировать из заслонённой конформации именно поэтому – не из чего реагировать, ни одна молекула не живёт в этой форме никогда и ни при каких обстоятельствах.
Называем такие конформации по очевидной причине заслонёнными. Но поскольку молекула в этой форме не живёт, её никак нельзя зафиксировать, заморозить, как-нибудь поймать, то это не конформер. В нециклических насыщенных молекулах не бывает заслонённых конформеров (в непредельных и циклических бывают, потому что там эта форма может быть принудительно зафиксирована или стабилизирована сопряжением, обсудим это в другом месте).
Почему в твёрдом состоянии (в кристалле) мы обычно видим только самую устойчивую конформацию
В жидкости мы всегда имеем равновесие между всеми конфомерами, а их содержание легко определяется, если знать разницу свободных энергий конформеров. Но в твердом виде все не так.
Во-первых, когда молекула имеет много конформаций (является очень гибкой, содержит более-менее длинные насыщенные углеродные цепочки), такое вещество очень трудно закристаллизовать. Большинство органических молекул довольно гибкие, имеющие множество конформаций. С этим связано явление, хорошо знакомое всем, кто занимается органическим синтезом и часто получает много новых соединений. При выделении из реакционных смесей органические соединения очень часто не хотят кристаллизоваться, получаются в виде очень вязких жидкостей. В органике еще в 19 века принято образно называть очень вязкие жидкости маслом (oil). Упариваете в очередной раз на роторе что-то новенькое, что вы только что усердно чистили хроматографией и видите, что вещество получилось чистым, а оно не кристаллизуется, размазывается по стенкам колбы в невидимую пленку, и потом медленно стекает вязкой массой, маслом. Так себя ведут очень многие органические соединения, даже по структуре очень большие и красивые. Мы ведь всегда хотим получить кристаллы: они красивые и с ними легче работать, пересыпать, доставать из колбы, наслаждаться блеском и формой, бахвалиться, да и перекристаллизовать их можно. Но более чем часто получаем масла, противные и вязкие, которые даже нормально переместить из колбы в пузырёк для хранения задача нетривиальная. И при описании синтеза вместо температуры плавления приходится писать: масло. Опять масло, чёрт бы его побрал. Мало кто задумывается, но плохая способность к кристаллизации почти всегда связана с конформационной подвижностью частей молекулы. Сразу оговоримся, если вещество получилось действительно чистое. Если примесей много и хорошо очистить не удалось, задача кристаллизации еще усложняется – представляете себе ситуацию, что молекулам нужно перепробовать массу способов подойти друг к другу, а под ногами путаются какие-то чужие молекулы. Грязная органика кристаллизуется совсем плохо.
Тогда можно задать вопрос – а все ли на свете органические вещества кристаллизуются? Да, все. Теоретически. Для того, чтобы образовать кристалл, молекулы должны подойти друг к другу на расстояние тесного контакта, хорошенько потолкаться, перепробовать все возможные позы, и методом проб и ошибок найти оптимальное взаимное расположение. В любой молекуле всегда найдутся части, которые испытывают друг к другу сильное или слабое влечение (притяжение за счет противоположных зарядов, статических или наведённых, водородные связи и другие типы связей, и т.п.), и части, которые отталкиваются. При упаковке в кристалл молекулы должны найти оптимальное взаимное расположение, в котором сближено то, что притягивается, и удалено то, что отталкивается. В реальности это еще сложнее, потому что оптимизируется даже не попарное взаимодействие молекул, а вся конструкция из многих молекул – затравка, вокруг которой уже растёт кристалл. Понятно, что это непростое занятие, чем сложнее молекула и чем хитрее ее форма, тем дольше нужно толкаться. А если еще конформеры. Увы, в вязкой жидкости, скорость движения (диффузии) тоже невелика, и в таком замедленном танце что-то никак это не получается – нужно очень много времени. Практикующие органики знают этот фокус – если оставить масло на недельку, а иногда месяц, а иногда год, а иногда на всю жизнь минус один день – и в колбе вдруг из масла вырастают замечательные кристаллы. Некоторые масла приходится завещать потомкам. Некоторые – будущим поколениям. Через пару тысяч лет археологические раскопки на месте древних лабораторий несомненно обнаружат многие колбочки и пузырёчки с кристаллами, – их тогда выставят в музеях, и снабдят этикетками с указанием температуры плавления, которые так и не смогли измерить в далёкой древности. А масел никаких, скорее всего, уже не обнаружат.
Почему это происходит? Потому что, если конформеров много, разные конформеры почти не имеют шансов достичь оптимального взаимного расположения и начать образование кристалла – создать затравку будущего кристалла. Кристалл образует самый устойчивый конформер, просто потому что его в смеси конформеров больше, и больше вероятность правильной встречи двух таких молекул. Но другие конформеры путаются под ногами, как та самая примесь. Ага, понятно, надо просто снизить температуру, ведь при этом относительное содержание самого устойчивого конформера возрастает, и если температура очень низка, то самый устойчивый конформер рано или поздно становится преобладающим, как мы выяснили, не менее 99% потому что барьеров вращения сильно меньше одной ккал/моль не бывает. И тогда все было бы просто – охлаждайте любое масло и закристаллизуется оно. Увы, есть проблема. Вязкая жидкость при охлаждении становится еще более вязкой, всё более вязкой, вот уже перестаёт течь, и застывает, но не в кристалл, а в аморфную массу, где молекулы не упорядочены, застыли в тех позах, в которых застала их стужа. Такую массу часто называют стеклом, говорят, что масло застекловалось, по очевидной причине – самый известный твердый аморфный материал это обычное стекло, хотя это не органический материал, но законы химии одни для всех химий, а красивое слово науке идёт. А для образования кристалла подвижность молекул очень важна, чем выше вязкость и медленнее диффузия, тем меньше шансов образования затравки. Когда уже застекловалось, диффузия замедляется настолько, что шансов уже нет вообще – диффузия займёт столетия. Поэтому никогда не суйте масло в жидкий азот, если хотите попробовать вызвать кристаллизацию. Получите стекло. Оно не закристаллизуется никогда в масштабах жизни человечества. Посмотрите на древние стекляшки в археологических музеях, там можно найти стекляшки из Древнего Египта, которым минимум полторы тысячи лет, и они все еще вполне прозрачные, то есть всё еще стелянные и аморфные.
Охлаждать надо медленно. Тогда происходит очень простая и понятная вещь. Мы уже выяснили, что скорость превращения конформеров очень велика, и остается большой даже при понижении температуры. А соотношение конформеров сильно зависит от температуры, и чем температура ниже, тем больше относительное содержание самого устойчивого конформера. Поэтому если у нас есть при комнатной температуре смесь конформеров в равновесии, в которой довольно много менее устойчивых конформеров, из-за очень малой разницы (1 ккал/моль или даже менее) в энергиях, то мы не можем взять и заморозить это соотношение просто понижая температуру. Скорость охлаждения жидкости очень мала по сравнению со скоростью конформационного превращения. По мере охлажения практически все конформеры превращаются в самый стабильный. Если это делать достаточно медленно, то рано или поздно вещество закристаллизуется, и, естественно, в кристалле мы увидим самый устойчивый конформер. Как это узнать? С помощью рентгеноструктурного анализа, если получится вырастить хорошие кристаллы, а это целое искусство, которым владеют далеко не все.
Это работает даже с самыми простыми нежесткими молекулами, алканами. Закристаллизовать их очень непросто, потому что молекулы совсем неполярные, никаких интересных групп, серьезных зарядов и прочих вещей, обеспечивающих взаимодействие между молекулами, нет. Молекулы алканов взаимодействуют друг с другом очень слабо за счет электростатического притяжения слабеньких диполей – связи C-H обладают небольшим смещением электронной плотности. Начиная с пропана уже при небольшом охлаждении алканы – жидкости, чем больше углеродов, тем более вязкие, а начиная где-то с 14 атомов вязкость возрастает настолько, что мы получаем воскоподобную аморфную массу, парафин. Это не кристаллы, и это естественно. В таких соединениях с длинными цепочками при обычных температурых огромное количество конформеров, кристаллизация в таком беспорядке невозможна. Нашлись, тем не менее, мастера кристаллизации, которые умудрились так искусно охлаждать их до очень низких температур, что закристаллизовать получилось сначала все до н-октана, а затем даже и додекан, и даже н-гексадекан. И вот, вот что получается, например, для нормальных пропана, бутана, пентана, декана, гексадекана:
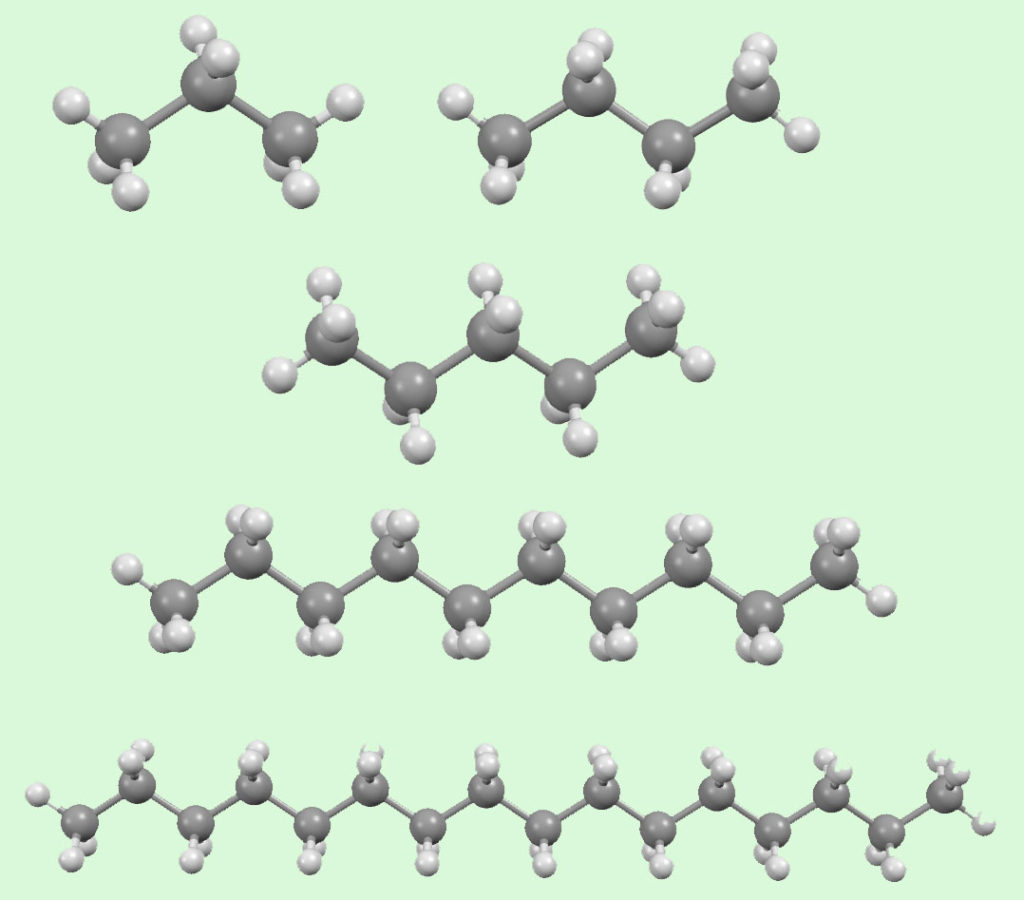
Как видим, в кристалле просто чистые самые устойчивые конформеры – плоские змейки, у которых по всем C-C связям заторможенная анти-конфигурация. Кристаллы эти, естественно, устойчивы только при очень низких температурах, если охлаждение убрать, то они расплавятся. Пропан – органическое соединение с самой низкой температурой плавления из всех известных всего на несколько градусов выше температуры жидкого азота, у остальных температура плавления понемногу повышается с ростом числа атомов углерода.
н-пропан, н-пентан R.Boese, D.Blaeser, H.-C.Weiss, Angew.Chem.,Int.Ed. (1999), 38, 988
н-бутан M.Podsiadlo, A.Olejniczak, A.Katrusiak, J.Phys.Chem.C (2013), 117, 4759
н-декан A.D.Bond, J.E.Davies, Acta Crystallogr.,Sect.E:Struct.Rep.Online (2002), 58, o196
н-гексадекан V.Metivaud, A.Lefevre, L.Ventola, P.Negrier, E.Moreno, T.Calvet, D.Mondieig, M.A.Cuevas-Diarte, Chem.Mater. (2005), 17, 3302
Чем определяются энергии конформеров и всегда ли анти лучше, чем гош
Это и просто и сложно. Определяются взаимодействиями между атомами, между диполями связей. Важно понимать, что взаимодействия могут быть отталкиванием, а могут и притяжением. Относительные энергии конформеров определяются суммой (балансом) таких взаимодействий. Более-менее точно это можно выяснить только расчётами с помощью или молекулярной механики, или квантовохимическими. Но во многих случаях разумный результат получается “на глазок”, особенно если есть отдельные заместители или группы, которые явно доминируют в сумме взаимодействий.
В несложных молекулах основным взаимодействием является отталкивание пространственно сближенных атомов или групп. Естественно, часто возникает вопрос, неужели в том же этане действительно отталкиваются атомы водорода, они же далеко. Если собрать модельку, то кажется, что они такие малюсенькие и так далеко друг от друга. Но это иллюзия, вызванная тем, что такие модельки (шарики-и-палочки) плохо передают реальную форму молекул, хотя они страшно удобны, вполне адекватно показывая структуру. Реальную форму молекул лучше передают модели, в которых атомы представлены шариками с ван-дер-ваальсовыми радиусами. Вот как выглядит этан в таких моделях. На третьей картинке модельки вложены друг в друга в одном и том же масштабе, и это очень ярко показывает, насколько неадекватно представление шарикопалочковой моделькой.
Ван-дер-ваальсова модель показывает молекулу приблизительно так, как ее “видят”другие молекулы. Расстояние контакта именно таких моделек показывает, на каком расстоянии молекулы “касаются” друг друга. Ближе подойти нельзя – сила отталкивания с этого момента растет почти вертикально в небо. Хорошо, попались, – но ведь и в такой модельке водороды не касаются друг друга! Славно, что не касаются, если бы касались, барьер вращения был бы не 1-2-3 килокалорий на моль, а десятки их, и вращение стало бы очень затруднённым, конформер бы заморозился. Фокус в том, что ван-дер-ваальсов радиус – это расстояние, на котором отталкивание растёт очень сильно. Но реальные атомы это не жёсткие шарики, а такие размытые – электронная плотность не падает ступенькой в ноль на ван-дер-ваальсовом расстоянии, и атом не заканчивается на этой границе. Атом представляет собой суммарную электронную плотность от всех занятых орбиталей, и на ван-дер-ваальсовой границе эта плотность не превращается в ноль, а просто становится очень небольшой и продолжает падать дальше при увеличении расстояния. Поэтому шарики атомов и на большем, чем ван-дер-ваальсовы радиусы расстояниях отталкиваются, но слабо, а барьеры в таких молекулах, как этан и так невелики, но достаточны для того, чтобы вращение было не свободным, а заторможенным, с большим или меньшим барьером. В анти-конформере расстояние максимально, и оталкивание минимально. В заслоненной конформации расстояние минимально и отталкивание максимально, поэтому в этой форме молекула не задерживается, это конформация, но не конформер. Если у нас не этан, а что-нибудь покрупнее, например, бутан, по средней связи возникает дополнительная возможность существования анти- и гош-конформеров.
Итак, атомы отталкиваются, даже на расстоянии большем ван-дер-ваальсовых радиусов. Это отталкивание и объясняет то, что мы называем стерическими эффектами. Если в молекуле больше ничего нет, то анти-конформер по самым крупным группам всегда будет устойчивее гош-конформера.
Но в более сложных молекулах, могут быть и более сложные взаимодействия, которые приводят не к отталкиванию, а к притяжению. Тогда в балансе взаимодействий появится вклад, который будет приводить к уменьшению расстояний между группами, в которых есть такие взаимодействия. Это может привести к тому, что гош-конформер станет стабильнее анти, а в самой крайней форме, даже и к преимуществу заслонённой конформации, которая в этом случае станет конформером. Что за взаимодействия:
- электростатика: противоположные заряды или противоположные диполи. Довольно редкая штука, но когда дойдём до углеводов, обнаружим что она объясняет очень важный эффект – аномерный. Аномерный эффект впрочем встречается не толкьо у углеводов, есть он и в нециклических молекулах, и тогда называется общим аномерным эффектом, современное объяснение этого эффекта предпочитает не электростатику, взаимодействие диполей, а квантовый эффект, σ-σ*-сопряжение, или такую обобщенную гиперкогъюгацию, мы это когда-нибудь рассмотрим вместе с обычным аномерным эффеком в углеводах.
- орбитальные взаимодействия: сопряжение или гиперконъюгация. И то, и то требует максимальной параллельности взаимодействующих орбиталей, и это тянет за собой сближение фрагментов, на которых сидят такие орбитали. Так объясняется, например, заслонённые конформеры 1,3-бутадиена. Гиперконъюгация, как мы уже отметили в предыдущем пункте, является причиной аномерного эффекта и его обобщения.
- водородные связи, если на соседних атомах сидят доноры и акцепторы водородной связи. Вот, например, одна из самых простых молекул с таким взаимодействием – этиленгликоль. Структура, по данным рентгеноструктурного анализа (J.Mol.Struct. 2010, 964, 126), ясно показывает, что самой устойчивой конформацией является заторможенный гош. В растворе будет то же самое. Корректности ради замечу, что конформация в кристалле стабилизирована не только взаимодействиями внутри молекулы, но между молекулами в кристалле. В растворе всё чище и понятнее, но зато в кристалле это экспериментальная структура, а в растворе можно было бы сделать только расчёт. И вопрос: почему гош- а не заслоненная – в ней ведь водородная связь будет короче. А потому что не одной водородной связью определяется конформация, а балансом всех взаимодействий, а остальные атомы продолжают отталкиваться. Гош-конформация в данном случае и в похожих случаях – это просто компромисс между притяжением водородными связями и отталкиванием всего остального.
Водородная связь это страшная сила. Несмотря на то, что водородные связи обычно относят к категории слабых межатомных взаимодействий, они вносят небольшой, но очень весомый вклад в баланс взамодействий, определяющих конформации молекул – энергии заторможеного вращения ведь тоже не очень велики, так что около десятка ккал/моль водородной связи могут переиграть баланс в свою пользу с лёгкостью. Водородная связь может стабилизировать необычные конформации, далёкие от нормальных заторможенных и близкие к заслонённым. Забавный пример молекулы с таким поведением давным-давно обнаружили в Новой Зеландии (Tetrahedron, 1969, 25, 4445): фторгидрин с трет-бутильными заместителями в протонном ЯМР не показал расщепления вицинальных протонов друг на друге. Отсутствие расщепления вицинальных протонов объясняют тем, что между ними угол близок к перпендикулярному (речь идёт о двугранном угле!) – то есть это нечто среднее между заторможенной и заслонённой конформацией – водородная связь подтягивает атомы кислорода и фтора друг к другу.