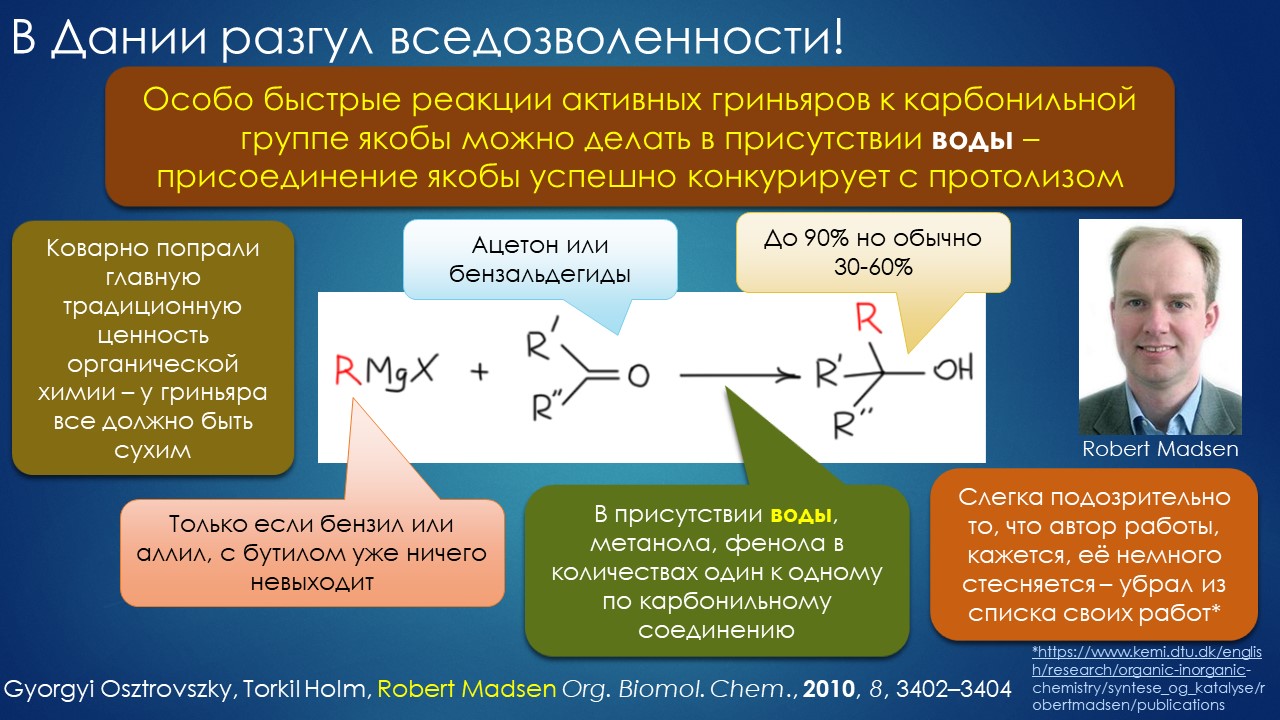
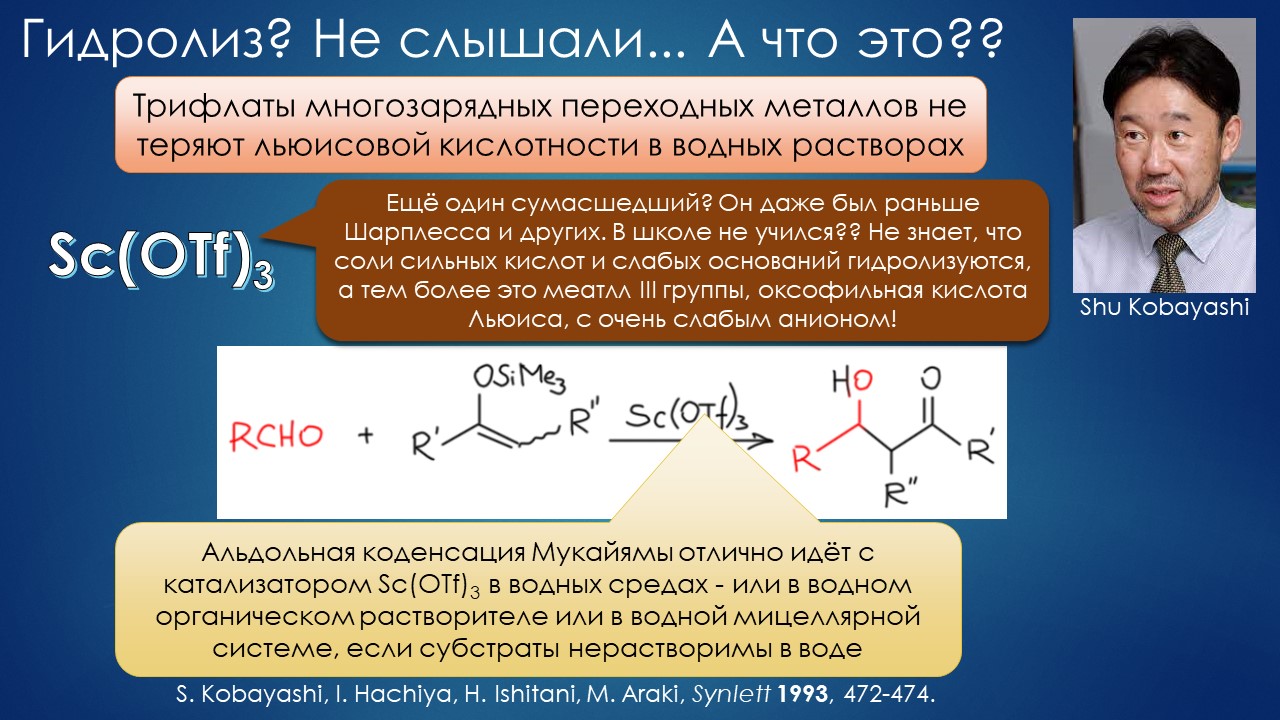
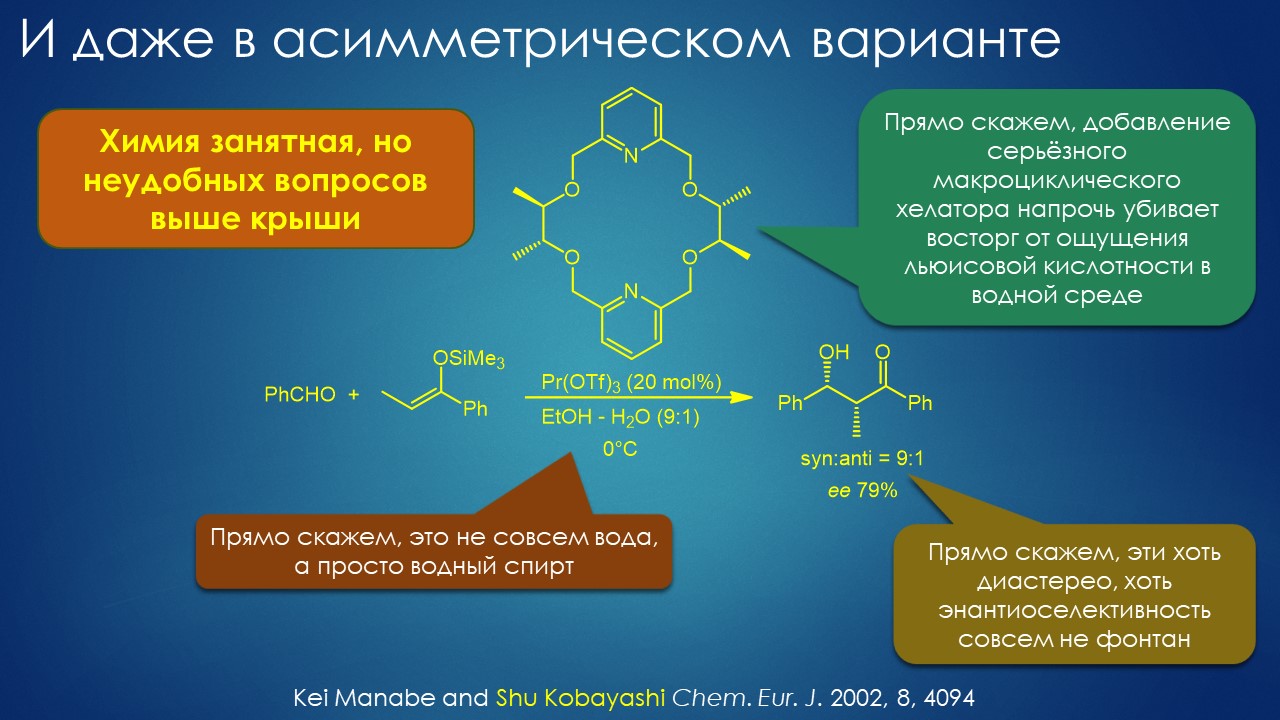
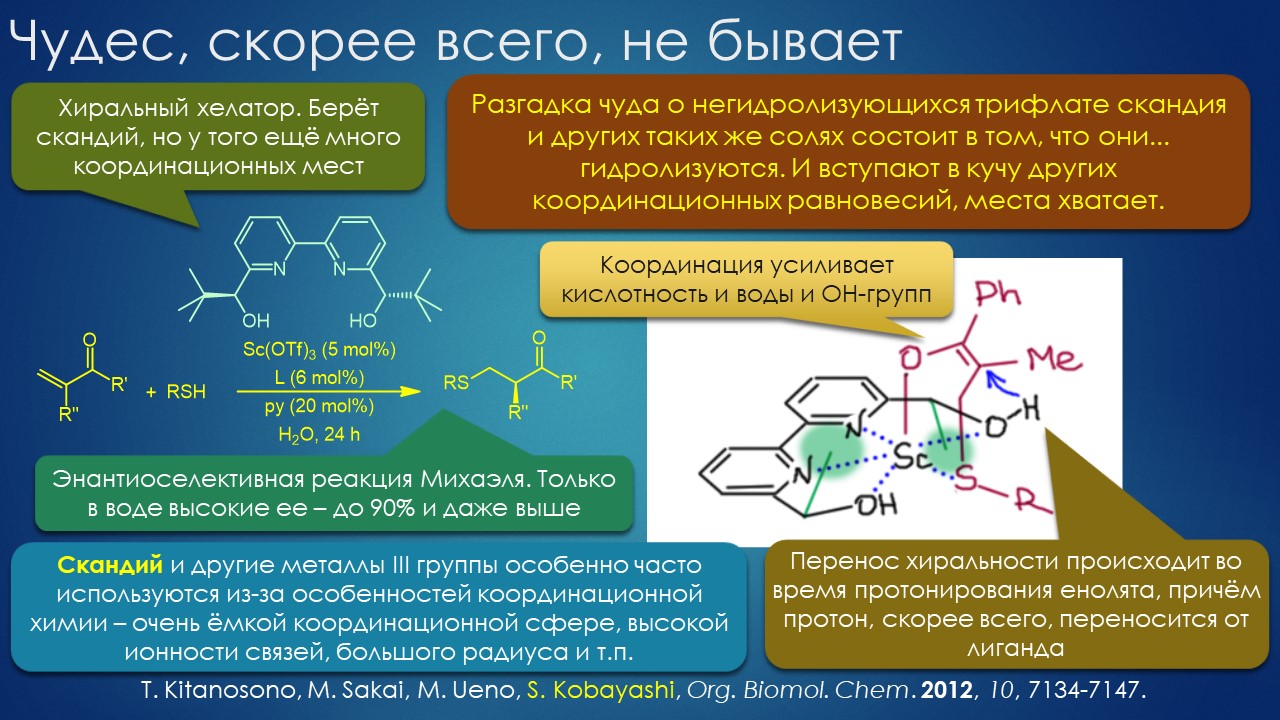
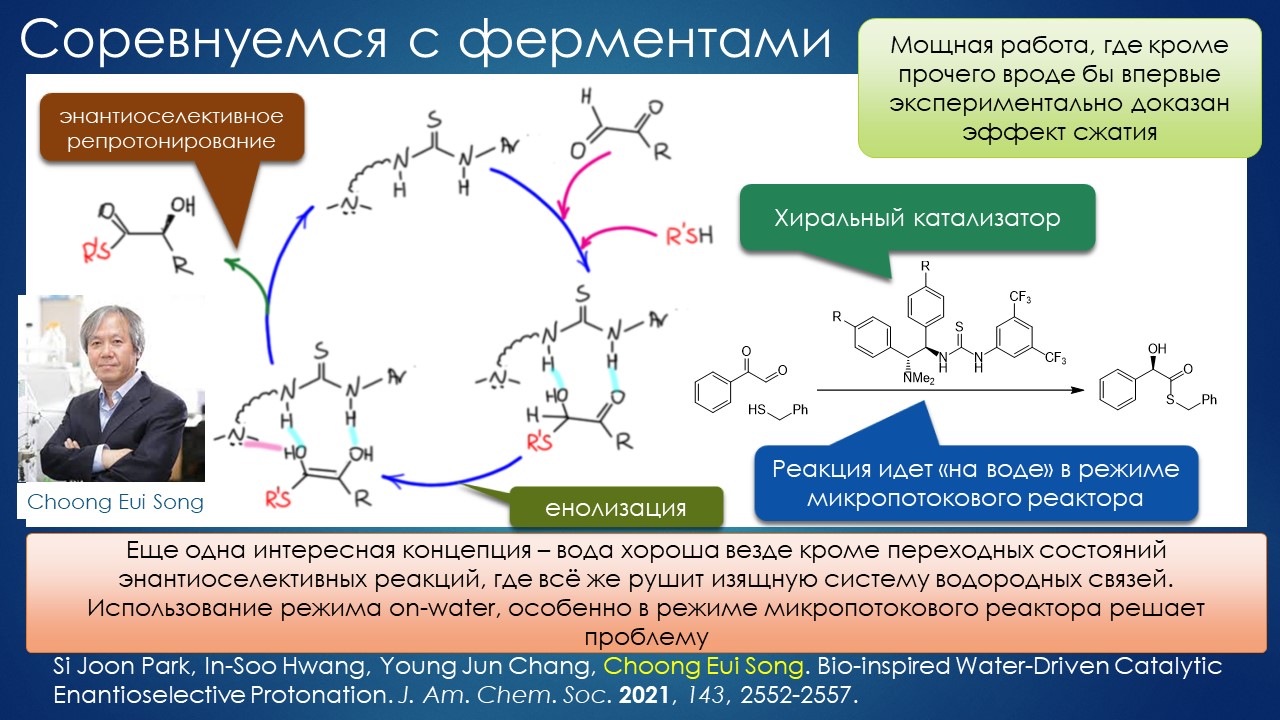
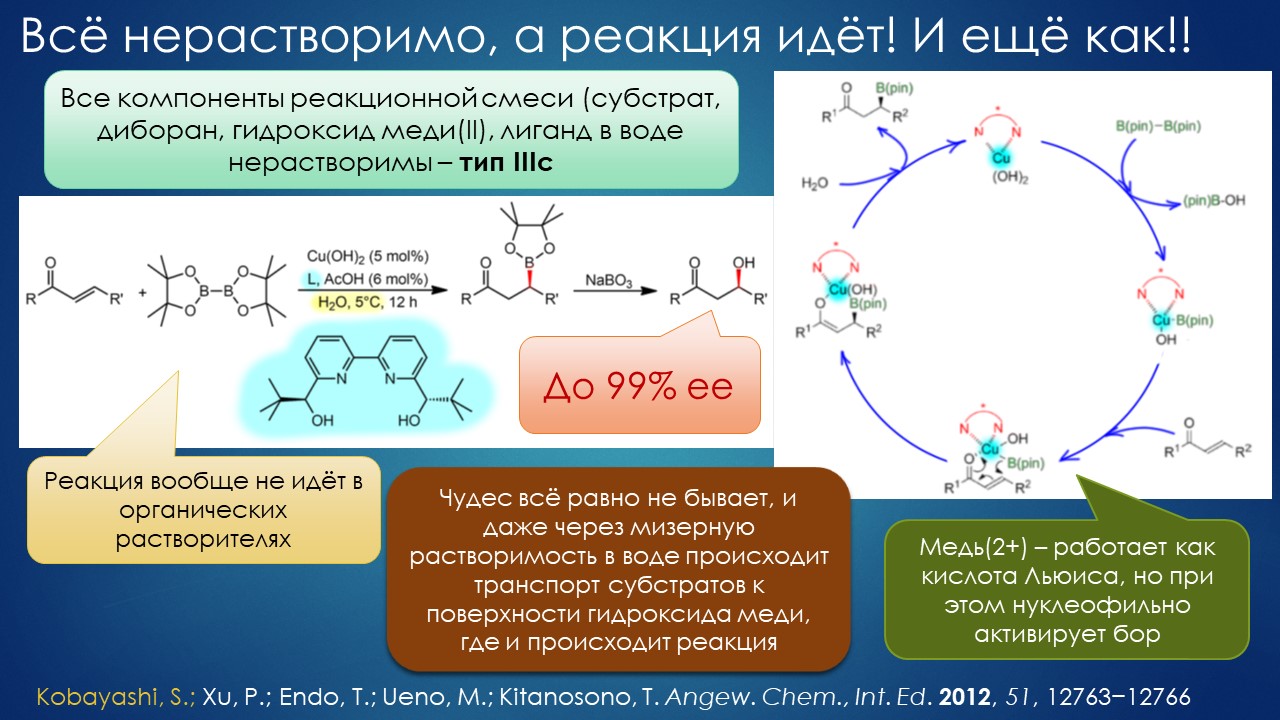
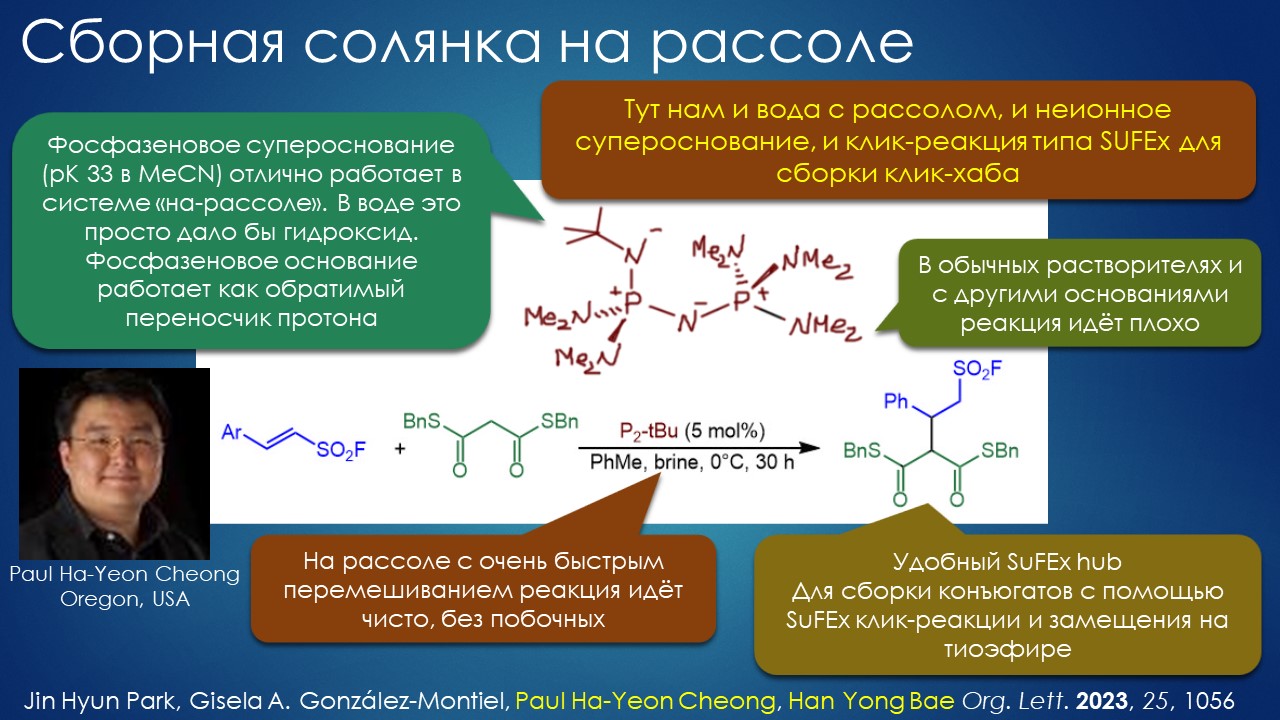
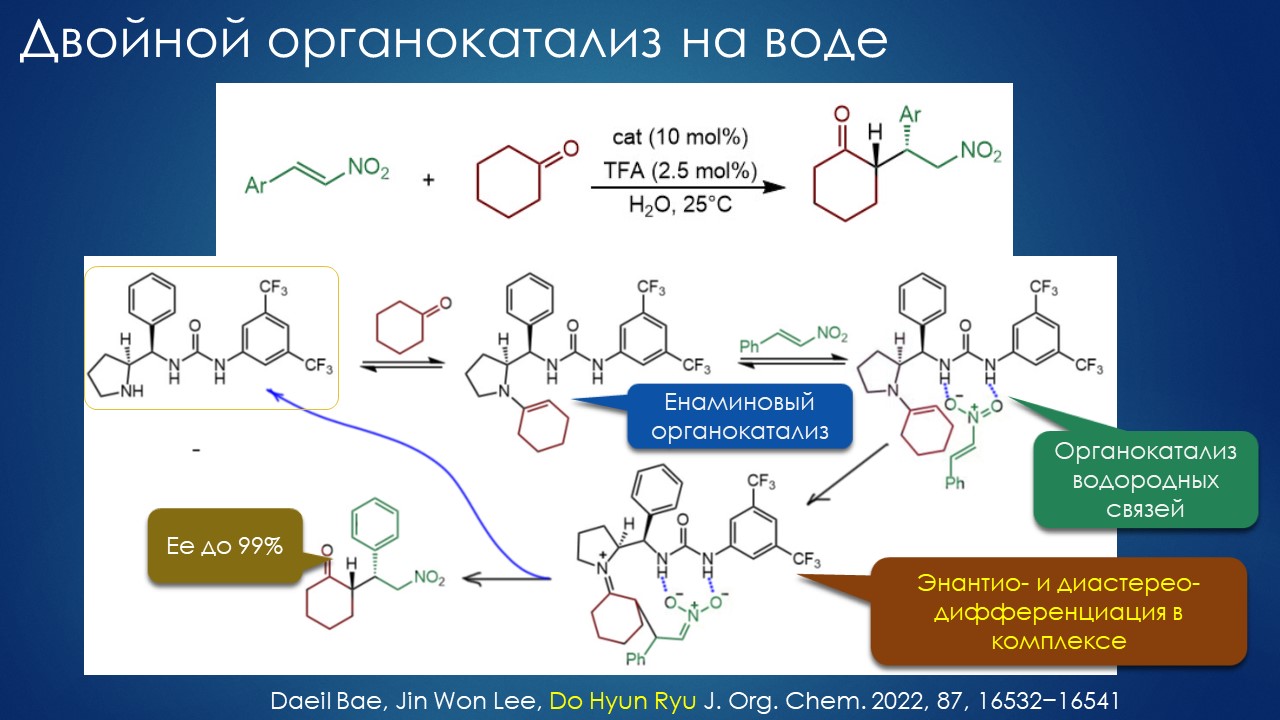
Что ищет реакция в растворителе? А мы?
А действительно, что? Что такое растворитель в химии, зачем он нужен, нельзя ли без него, и насколько хорошо мы понимаем, как нам выбирать растворители для конкретных реакций. И есть ли из чего выбирать. И собирается ли современная химия нам в этом помогать и предлагать новые растворители, лучше прежних.
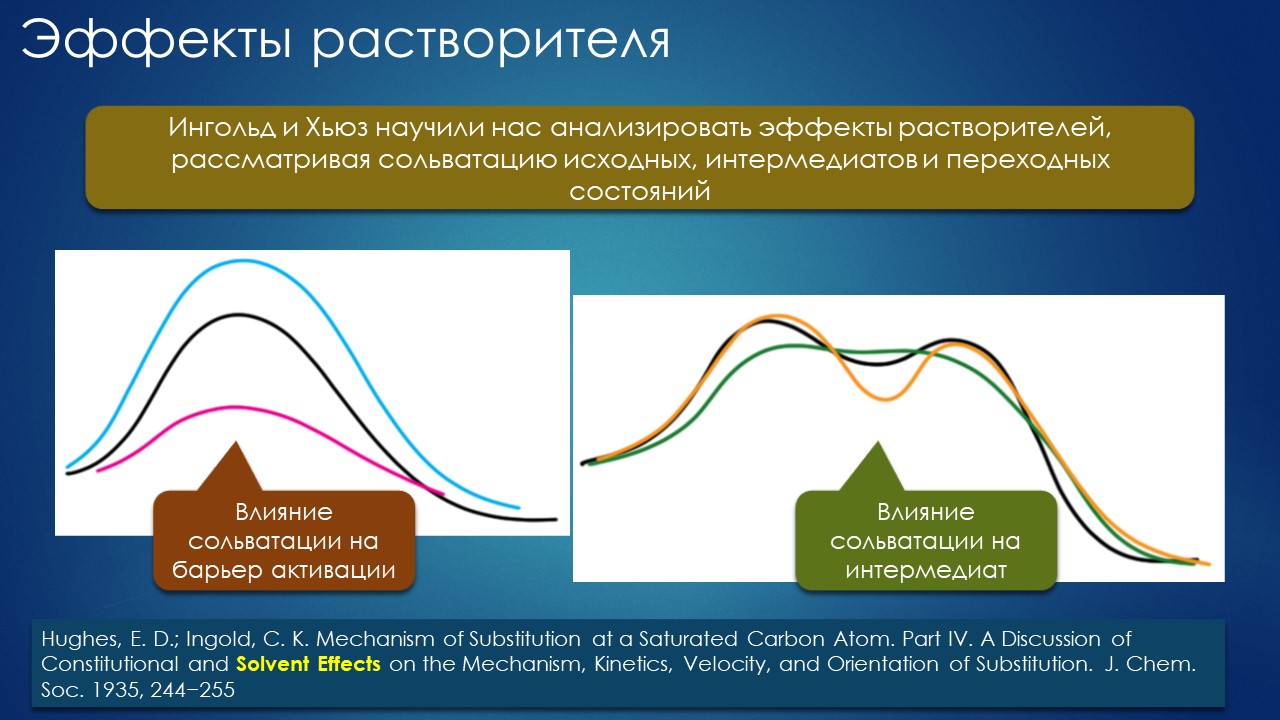
Органические химики в чём-то подобны алхимикам: те всю дорогу искали универсальный растворитель, находясь под влиянием античной мудрости о том, что тела якобы не могут действовать, не будучи жидкими, то есть растворёнными – мысль сколь глубокая, столь же и уводящая в сторону от истинной природы взаимодействий. В самом начале органической химии, в 19-м веке, откуда мы и получили все наши основные реакции, которые усердно изучали на 3-м курсе, про растворители сильно не задумывались – делали всё так, как получится, и к растворителю относились просто как к неизбежному подспорью, помогающему смешивать реагенты в колбах и дальше выделять продукты реакции. То, что растворитель может влиять – и сильно, ускоряя реакцию в десятки и сотни раз – впервые заметил русский химик Николай Меншуткин в исторической работе, от которой вполне можно отсчитывать историю теории механизмов реакций. В 20-м веке усилиями Ингольда и Хьюза мы получили представление о том, как и почему растворители влияют на скорости и равновесия, и окончательно поняли, что растворитель – один из основных участников реакций, и что если мы не разберёмся в функциях и свойствах растворителей, делать нам в органической (в неорганической тоже, но это их проблемы, нас не касаются) химии просто будет нечего.
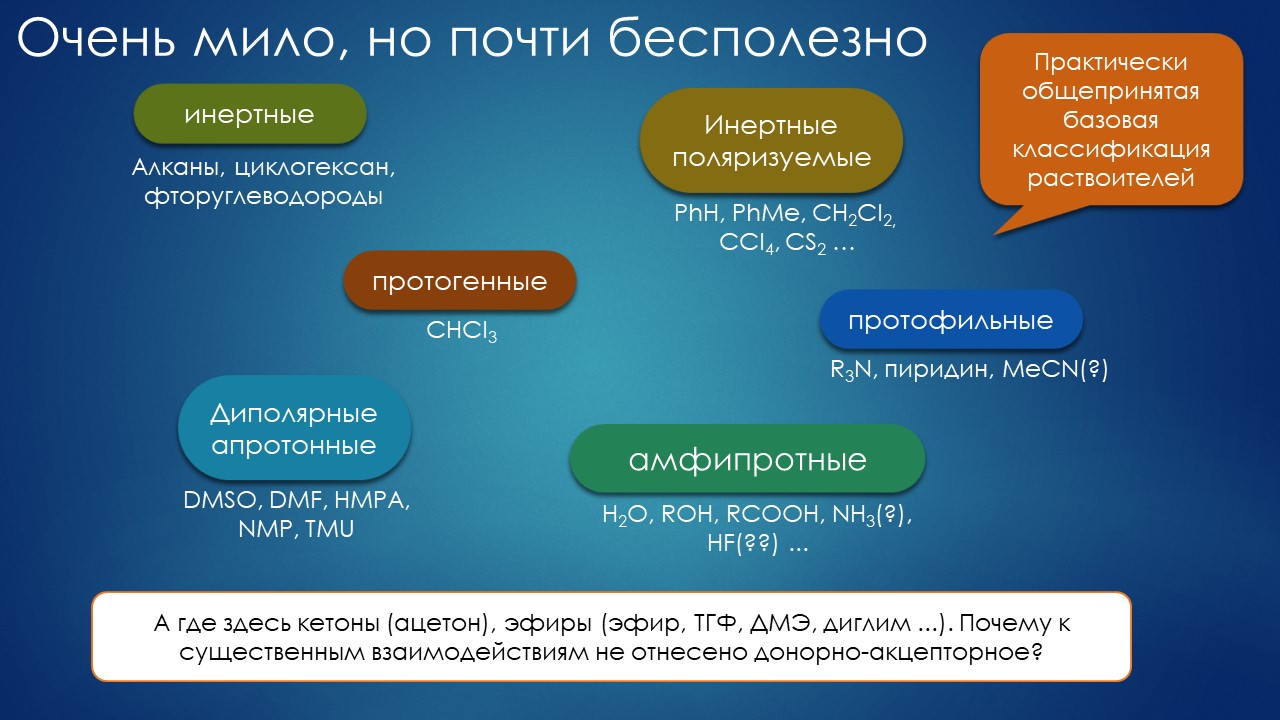
Дальше с этим прозрением произошло приблизительно то же самое, что и с другими гениальными прозрениями в научной и иной мысли – хочется поскорее превратить величественную теорию в практику, но что-то всегда мешает. В случае с растворителями дело уперлось в несколько почти комических обстоятельств. Во-первых, растворитель это по определению жидкость (это не всегда так, но почти всегда), а жидкое состояние наиболее сильно сопротивляется изучению – все имеющиеся теории жидкости ужасающе сложны и практически бесполезны. Поэтому приходится обходиться сильно упрощёнными и очень грубыми приближениями, сводя все свойства к нескольким экспериментальным параметрам типа пресловутой диэлектрической проницаемости – блестящая перспектива судить о химических реакциях по параметру, описывающему ёмкость конденсатора, заполненного такой жидкостью. Как бы комично это ни выглядело, это работает, но только для самой грубой оценки вляния полярности среды на скорость, учёта так называемой неспецифической или континуальной сольватации. Если бы только в этом было дело, то в химии можно было бы ограничится десятком растворителей, перекрыв шкалу диэлектрической проницаемости с разумным шагом, или даже вообще сведя все многообразие к трем-четырем средам малой, средней и высокой полярности. Но это не работает почти никогда. Все, кто что-то делал с органикой руками, отлично знают как плохо работают предсказания не то что скоростей реакций, а и самой растворимости веществ, исходя из просто полярности. Все знают, что кроме полярности растворитель делает много других вещей, проявляя кислотность и основность, электрофильность и нуклеофильность, специфические межмолекулярные взаимодействия типа пи-стекинга и даже недавно вошедших в моду сигма-дырок. Да и просто электростатика на молекулярном уровне и для близких взаимодействий сблизившихся для непосредственного взаимодействия молекул это нечто намного более сложное и труднопредсказуемое. А для реальных реакций немаленькое значение имеют и температуры плавления и кипения (диапазон жидкого состояния), вязкость, летучесть, а еще дальше – чистота, содержание воды и других примесей, легкость очистки, способность сохраняться в приемлемом состоянии более-менее длительное время, токсичность и горючесть, даже запах (я вот, например, вообще не переношу толуол, и катитесь сразу ко всем чертям все реакции, в которых этот растворитель предлагают как основной), и так далее. А еще добавьте к этому собственную реакционную способность, что делает растворители несовместимыми с многими реагентами – скажем, хотите вы что-то окислить, а не можете подобрать растворитель, который бы сам не окислялся. Всё это затейливо комбинируется в существующих жидкостях, причем довольно легко можно прийти к выводу, что главный закон этой комбинации – дать вам что угодно, только не то, что нужно. В поисках подходящего растворителя химик очень часто оказывается в положении Агафьи Тихоновны из Женитьбы Гоголя: “Если бы губы Никанора Ивановича да приставить к носу Ивана Кузьмича, да взять сколько-нибудь развязности, какая у Балтазара Балтазарыча, да, пожалуй, прибавить к этому ещё дородности Ивана Павловича…” – если бы полярность воды приставить к растворяющей способности ацетона, да взять немного кислотности, как у муравьиной кислоты, да, пожалуй ещё ароматического стекингу бы малую толику – то как бы мой, скажем, очередной порфирин стал бы в растворе порхать, а так, что ни пробовал, лежит на дне колом, а в единственном растворителе, где он растворяется, не растворяется ни один нужный мне реагент…
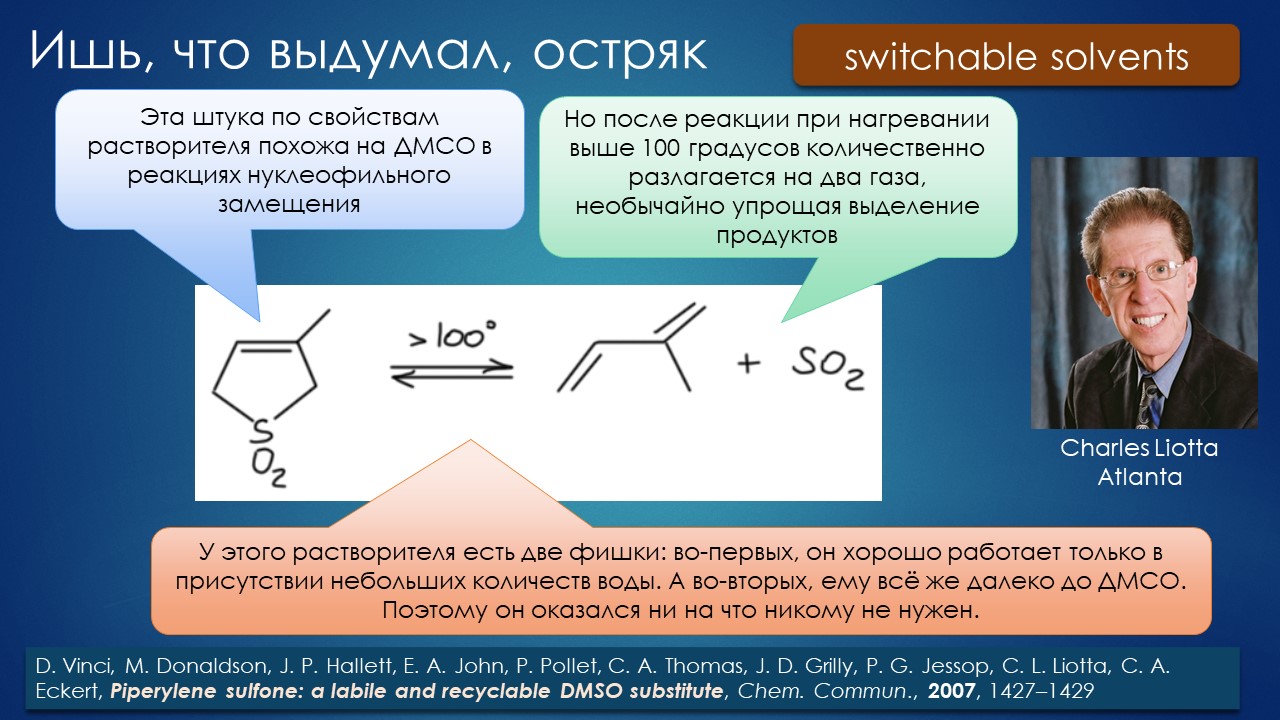
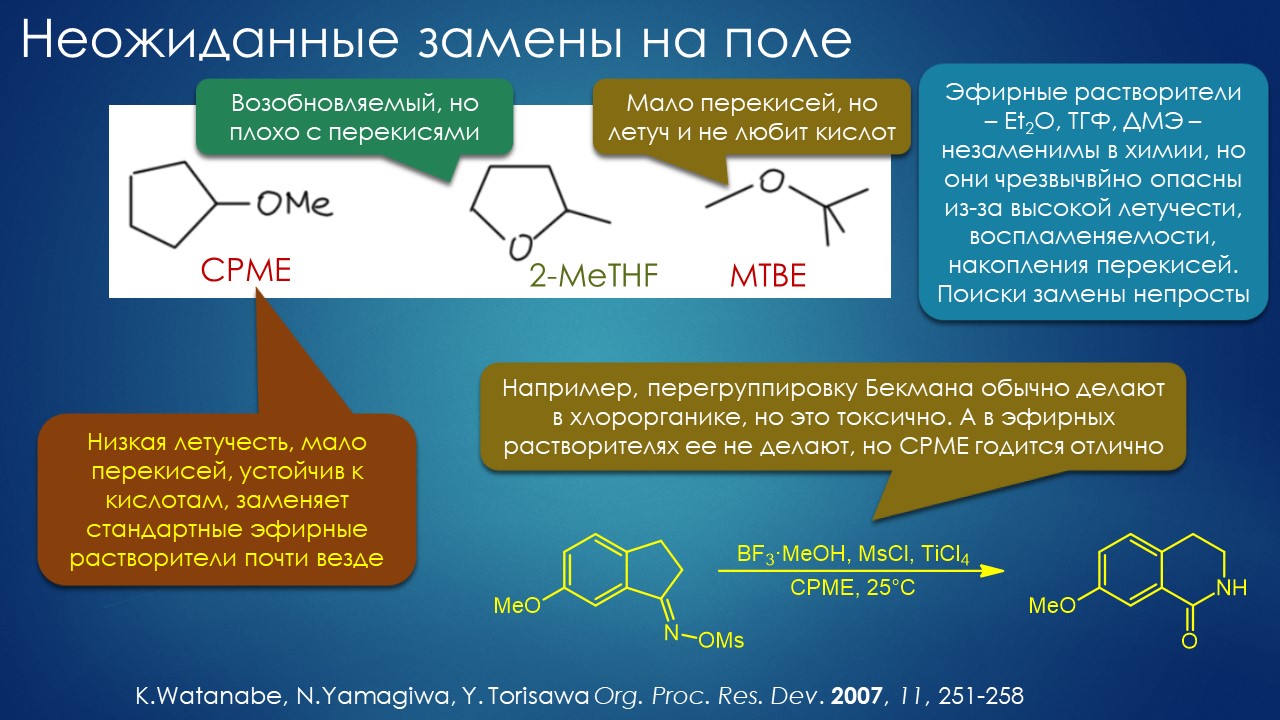
И вот в таких мучениях прошёл 20-й век. Было одно историческое дополнение к ассортименту растворителей – благодаря австралийскому химику Алану Паркеру все узнали, что в общем-то и до этого известные растворители типа диметилформамида и диметилсульфоксида обладают совершенно удивительной способностью драматически влиять на нуклеофильность анионов, а также и на бренстедову основность – эффект мог выражаться пятью-шестью порядками скорости и десятком единиц pK (в одной статье Паркера обещали даже до 18 порядков, но это, к счастью, нереально, так как наталкивается на естественные препятствия увеличения скорости). Важность этого типа растворителей для развития органического синтеза переоценить можно, но незачем, всё равно деваться в большинстве случаев некуда – а растворители эти все как на подбор очень неудобные, попробуйте разок выделить продукт реакции из диметилсульфоксида или N-метилпирролидона, особенно если этот продукт не очень гидрофобен, тогда навсегда избавитесь от восхищения этими действительно выдающимися растворителями. Работать с ними почти то же самое, что завалиться в какую-нибудь пафосную харчевню, отведать там всех блюд и напитков, а собравшись наконец уйти, увидеть счёт за съеденное и выпитое (а мне обещали скидку… – ну да, это уже со скидкой). Почти одновременно с раскруткой апротонных биполярных растворителей (неудачнее назвать было трудно, но все привыкли) было открыто Чарльзом Старком явление межфазного катализа (ещё один неудачный термин), давший возможность достигать приблизительно такого же эффекта, но используя самые непритязательные растворители типа углеводородов или хлоруглеводородов – то есть создавать эффект хорошего растворителя с помощью плохого растворителя и добавки агента межфазного переноса – и это тоже выдающийся вклад в препаративную химию, здорово смягчивший проклятие недостаточного выбора жидких сред, но, увы, только для очень ограниченного класса реакций, существенно расширить который так и не удалось. Да и часто получается, что счет за растворитель просто перешёл в счет за добавку, который бывает не менее отрезвляющ.
Незаметно подобрался век 21-й. И у всех исследователей, хоть как-то связанных с разработкой сред для реакций появилось ясное понимание того, что в 2023 году будет прочитана лекция про развитие идей в этой области, и надо срочно пошевеливаться, а то рассказывать будет нечего – вот позорище-то будет! К счастью, подмога пришла откуда не ждали – от, условно говоря, экологически мыслящей общественности, которая стала заставлять химию работать над тем, чтобы не повторять одного из главных “достижений” предыдущего века – успешного загаживания окружающей среды и создания десяти новых проблем на месте двух-трёх наполовину решенных. Ещё одного века такого прогресса мы не выдержим – часы остановятся гораздо раньше, и наступление следующего нового века праздновать будут беспозвоночные, эти выживут в любых условиях. Подробнее мы об этом поговорим в следующей лекции, но немного забегая вперёд, замечу, что в перечислении самых главных угроз, исходящих от химии, растворители заняли одно из самых высоких мест – оказалось, что это один из основных источников проблем и загрязнения, просто потому что без них не обходится ни одно производство, и даже если основной процесс у вас идет в газовой фазе над гетерогенным катализатором, дальше начинается разделение продуктов, а там тоже полно всяких растворителей. Загляните когда-нибудь на какое-нибудь химическое или околохимическое производство, даже на очень современное и продвинутое, всё блестит, жужжит и мигает, но – пахнет! Чем? – Почти всегда растворителями из процесса, летят они, проклятые, как их ни улавливай.
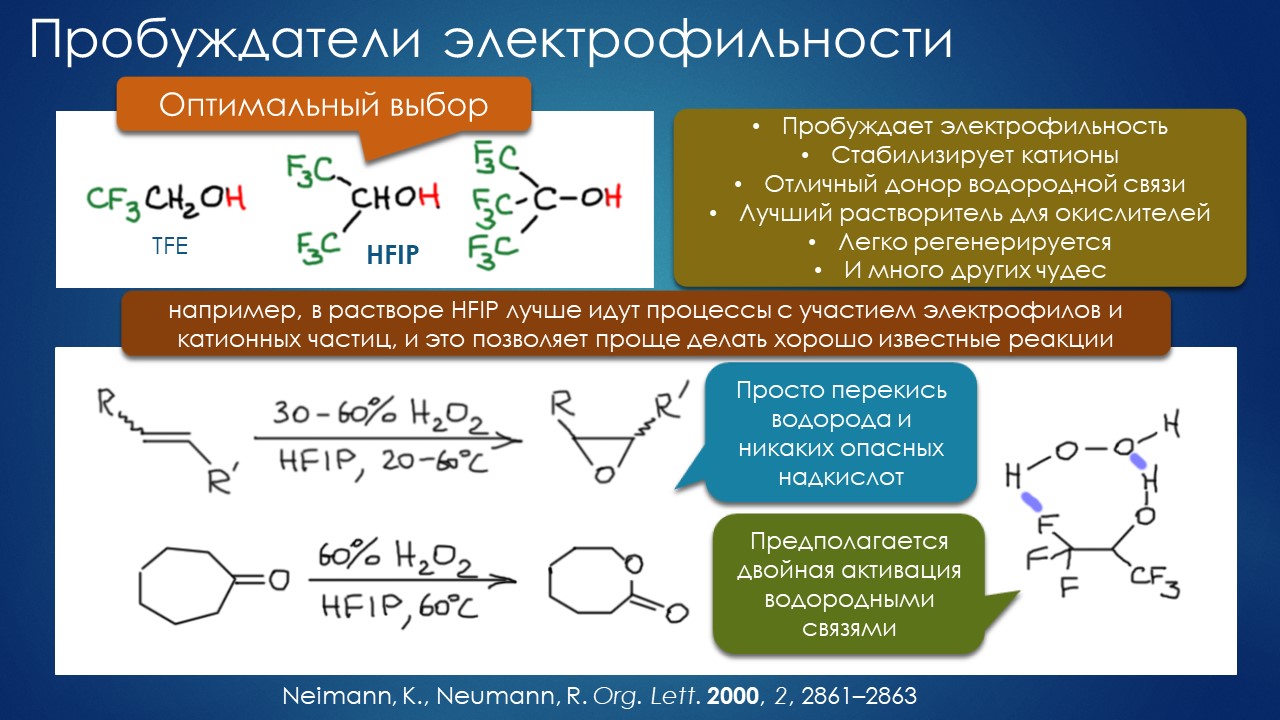
Получилось, что эти неприятные люди – экологически мыслящие люди всегда неприятны, потому что говорят гадости и сулят проблемы – вдруг поставили вовсе не ту задачу, которая обуславливает поиски нового именно химией – способностями ускорять реакции и делать возможными ранее невозможные процессы, – а куда более приземлённой задачей: сделайте хотя бы так, чтобы нехимики не имели проблем от химиков, а то ведь однажды побьют, и больно. Иными словами, в разговоре от растворителях в новом веке мы почти не касаемся великолепных эффектов растворителя в реакциях, и ничего даже отдаленно похожего на эффект ДМСО в нуклеофильном замещении, заставивший остолбенеть от изумления препаративных органиков в 1960-х, мы не увидим. Есть любопытные достижения, например, связанные с эффектом фторированных спиртов типа гексафторизопропанола (HFIP) на электрофильные реакции – в чём-то этот эффект отзеркаливает эффект ДМСО в реакция нуклеофильных, хоть и пониже, и пожиже, но – впечатляет, хочется попробовать, что у меня тут есть такого электрофильного… ничего? что за чёрт, вот же химию себе выбрал, модную фишку не пристроишь. Что ещё? Право, затрудняюсь.
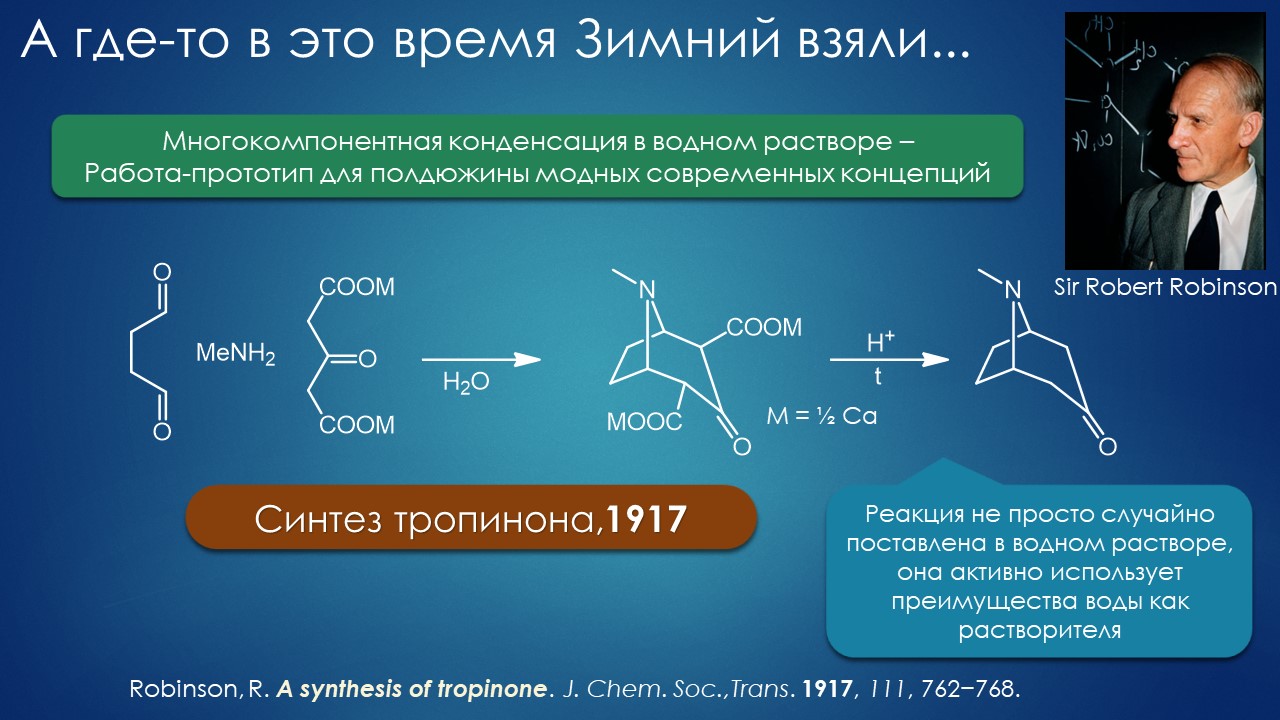
Вода. Вот чего в органике не хватало, воды! Органики традиционно не любят воду, хотя и используют её, иногда просто для совсем гидрофильных веществ и некоторых реакций. Часто, как вторую фазу, в реакциях межфазного переноса в системах жидкость-жидкость. Идеи, как бы воду ещё использовать, уже в качестве именно основного растворителя, возникли рано, но дело шло медленно, наблюдаемые эффекты были иногда интересны, но практически пользоваться ими было трудно. Почти всё крутилось вокруг довольно банальной идеи – а давайте сделаем часть реагентов или катализаторов водорастворимыми, тогда это очень упростит послереакционную обработку смесей. И прочая тягомотина такого же типа, скорее технологическая, и очень узкая – в одном процессе работает, в сотне похожих – нет. Ведь скорости реакций напрямую зависят от концентраций, и если не все реагенты хотя бы немного в воде растворимы, то хоть в лепешку разбейся, реакции с разумной скоростью не пойдут. Конечно – это же, простите, ежу понятно.
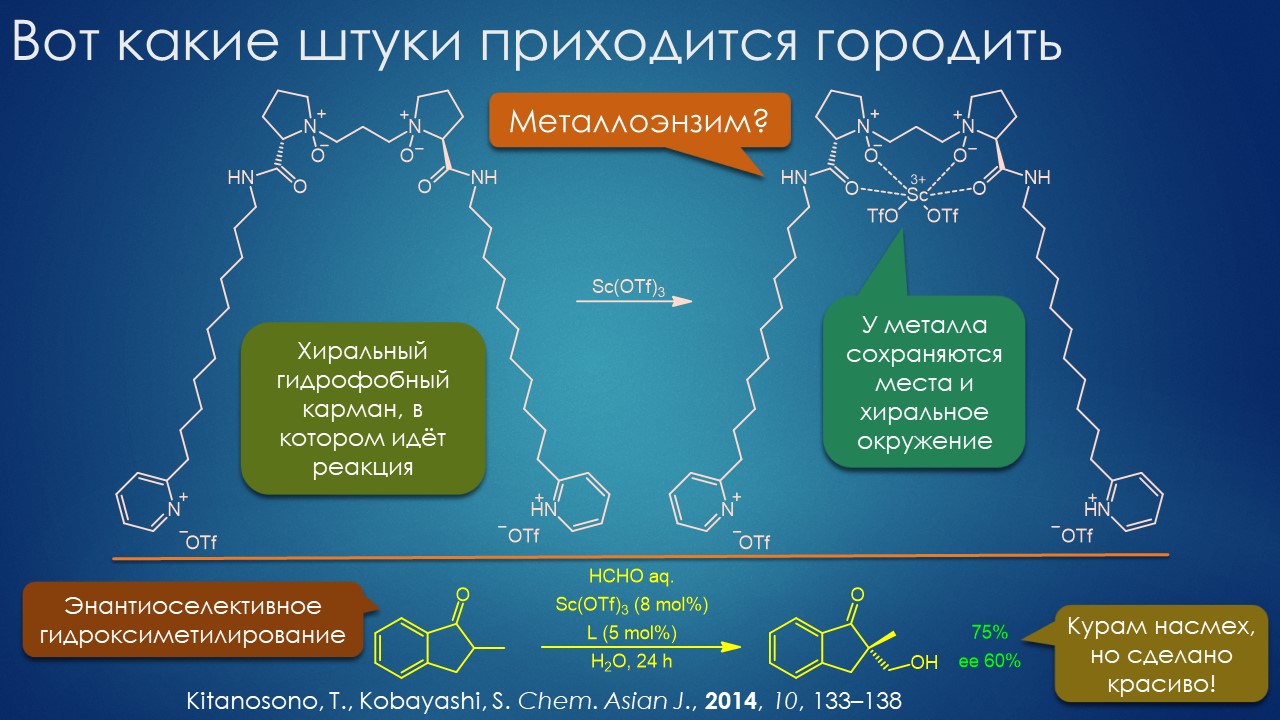
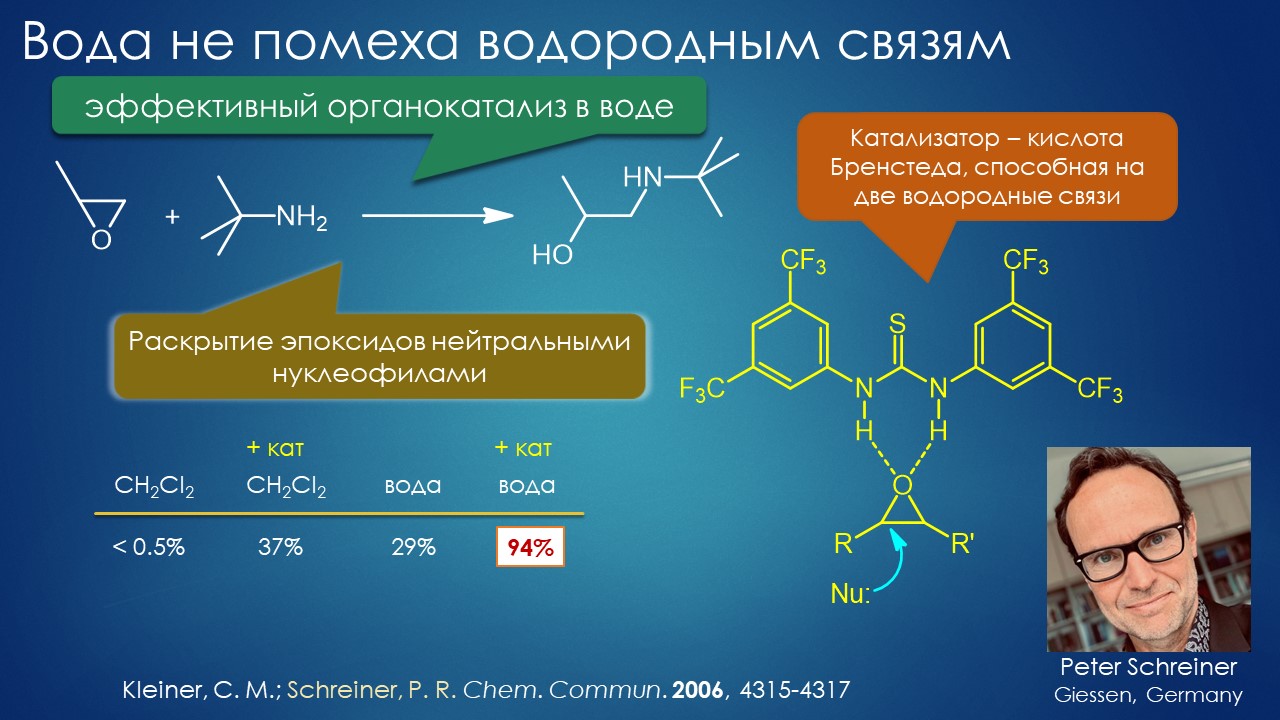
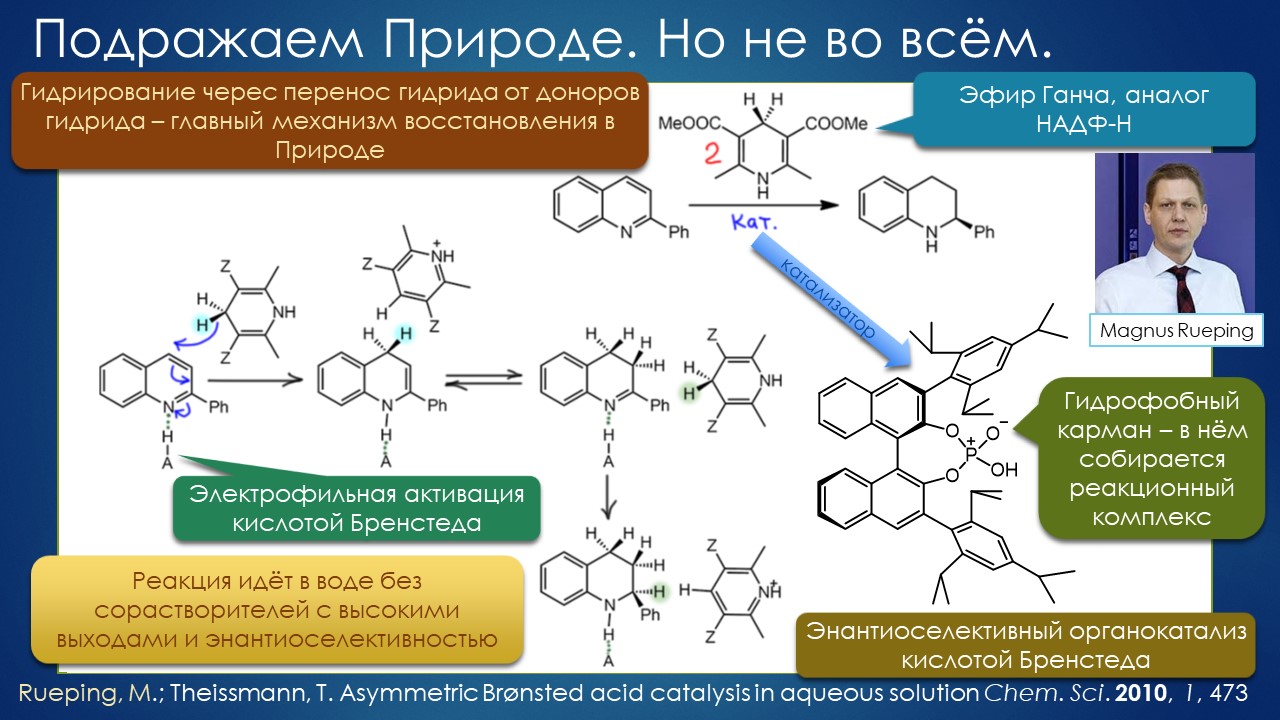
Ежу понятно, но таки нашёлся один бунтарь, надо признать, весьма профессиональный, уже успевший огорошить органическое сообщество заявлением о том, что искусство синтеза даром никому не нужно, и что надо наоборот всё делать максимально просто и незатейливо – клик, и готово! И вот этот бунтарь, Барри Шарплесс, видимо, оценив произведённый кликом на сообщество эффект как недостаточный, – настоящий хулиган будет буянить пока на загребут в участок – запускает в окошко химической светлицы второй кирпич – выбросьте все растворители, берите воду, а то, что в ней ничего не растворимо, так это даже здорово – именно так реакции идут лучше всего. Как-как?! Ну, это уже слишком – вскричали возмущённые органики, – дайте этому типу скорее вторую нобелевку за клик, а то он и не такое ещё придумает, а нам краснеть перед другими науками – что это у вас нобелевский лауреат такое несёт! Но некоторые призадумались и стали исподтишка пробовать, лауреат всё же, вдруг дело говорит. И кое-что стало действительно получаться. Так возникла и стало медленно и не очень верно развиваться странное направление органики, напрочь отрицающее всё, что мы знаем о растворителях. Дело идёт тяжело, играют в эту игру единицы, но то тут, то там выскакивают странные и даже завораживающие работы, авторы которых в выводах честно признают, что они не понимают как это работает, используя словечки из лексики книжек про Гарри Поттера (не читал увы ни одной, но догадываюсь). Но ведь работает – сами попробуйте.
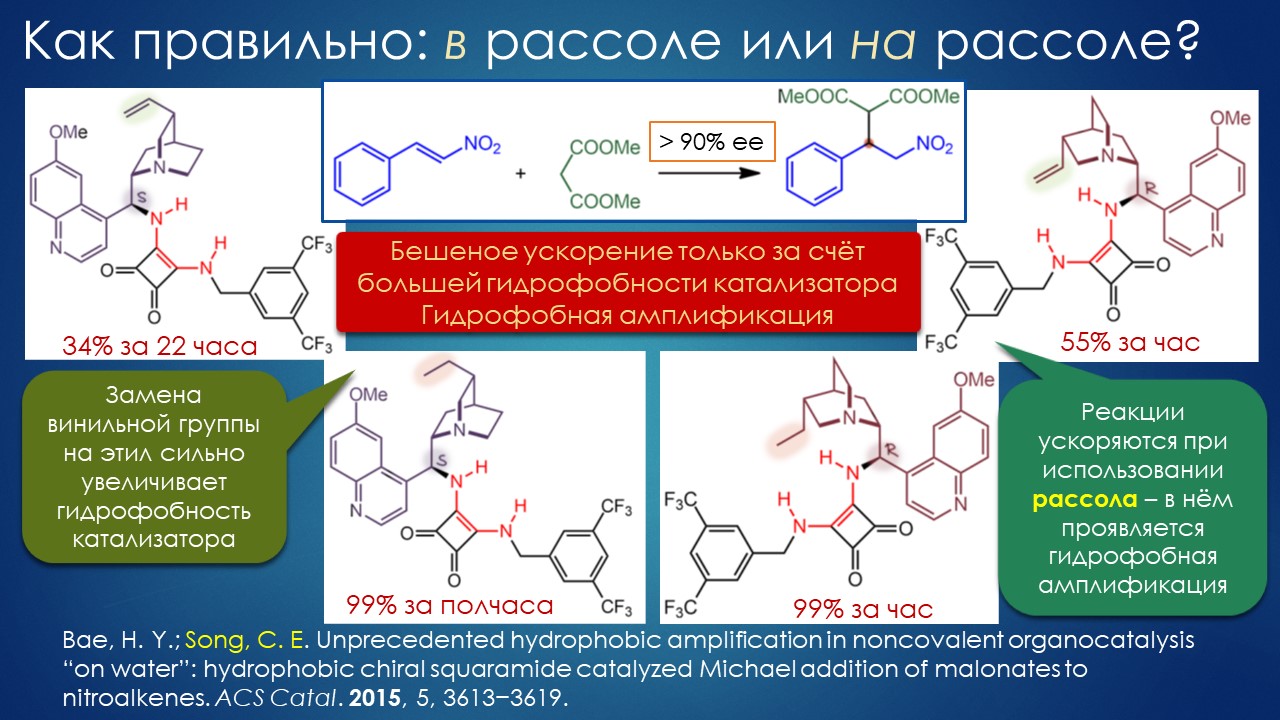
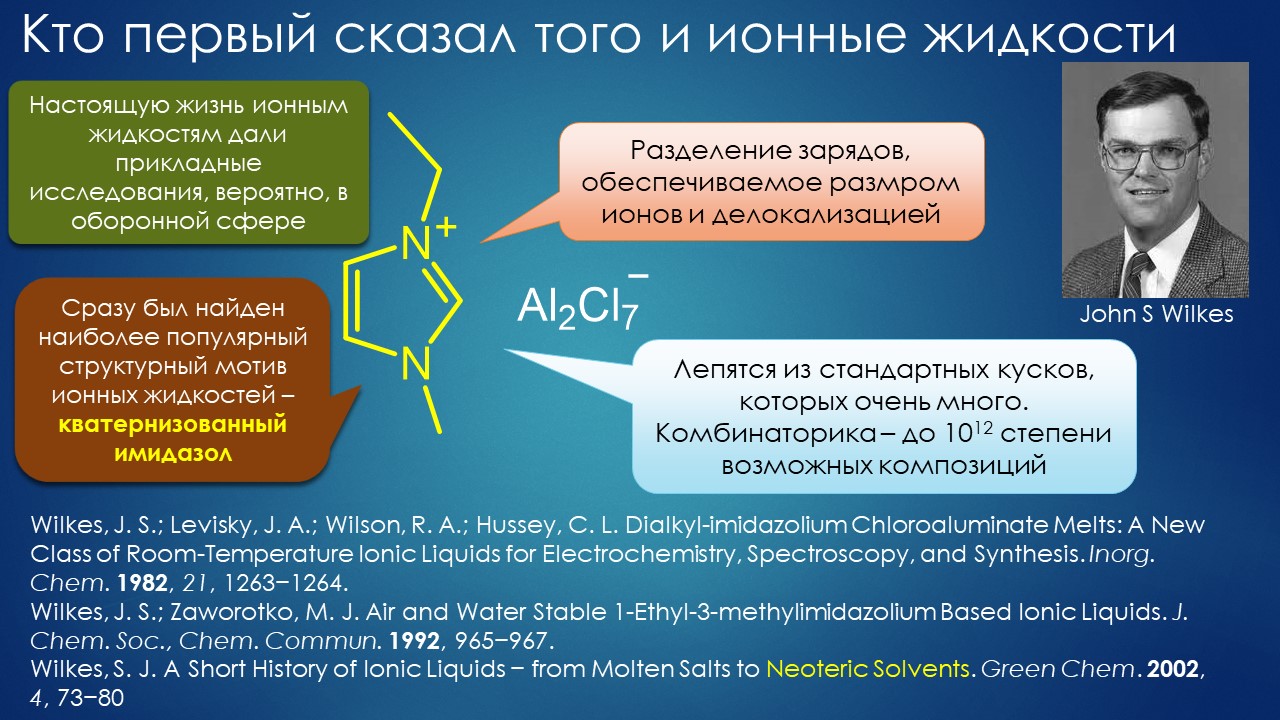
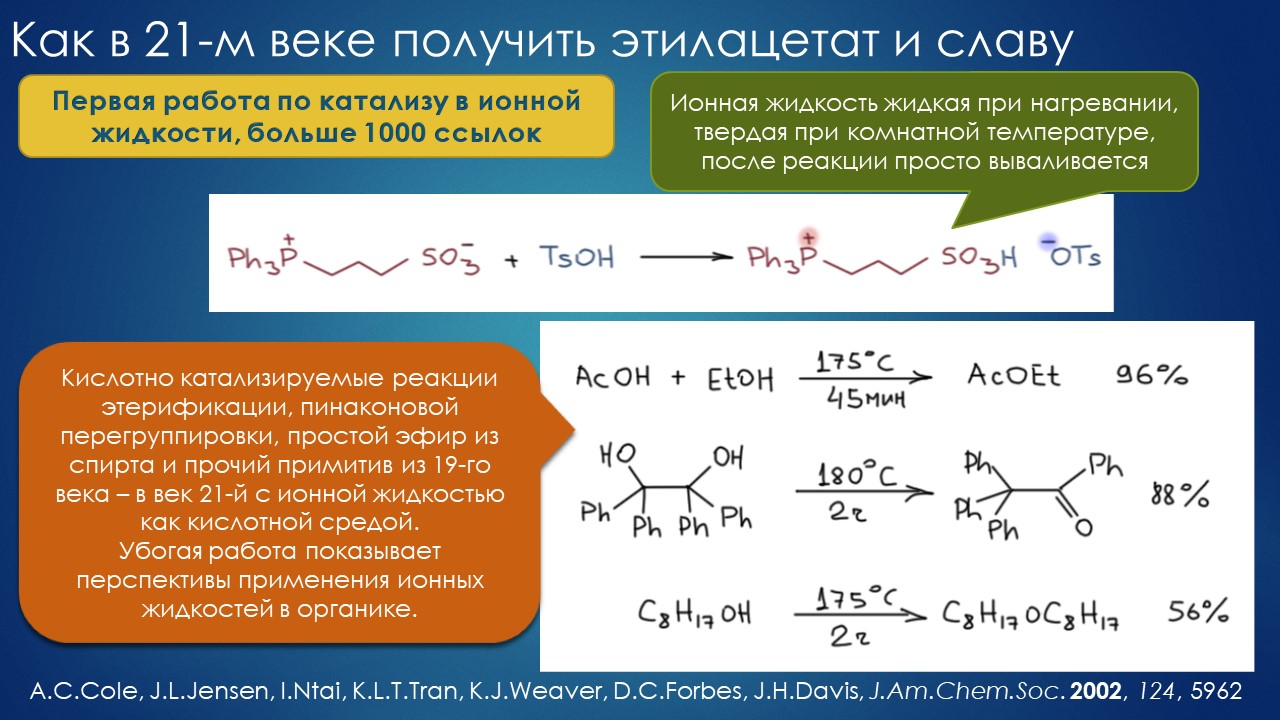
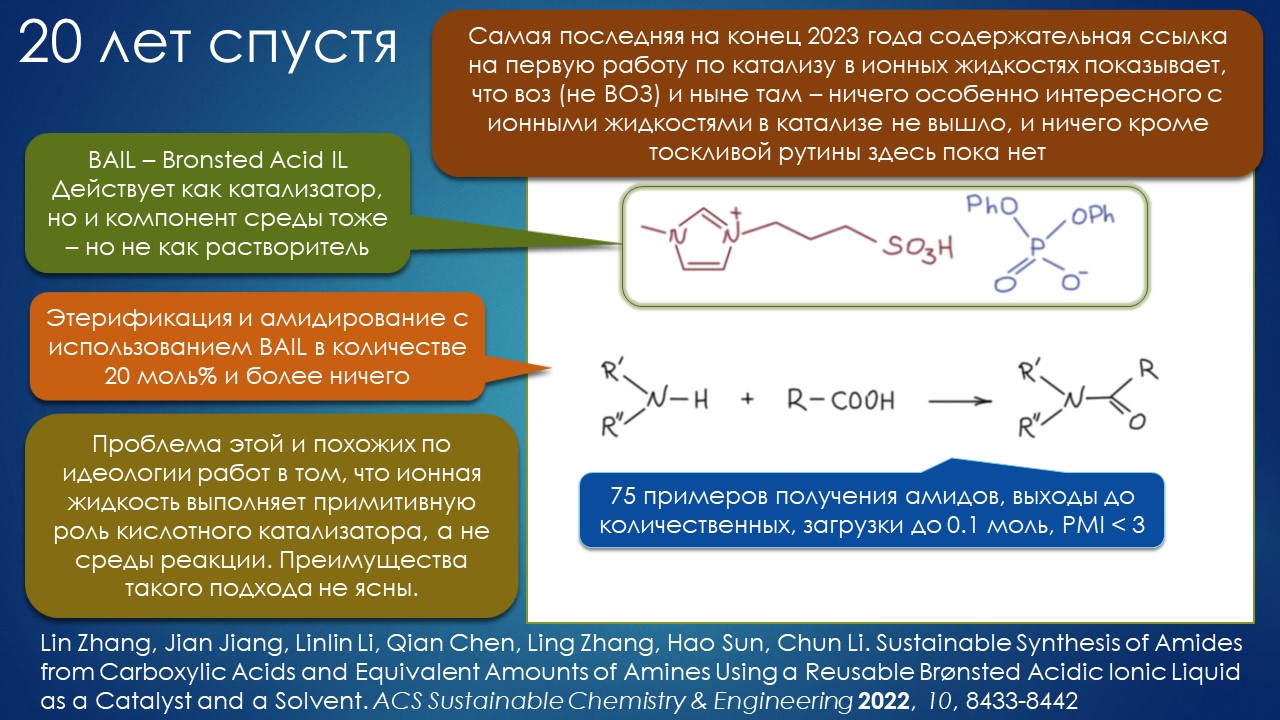
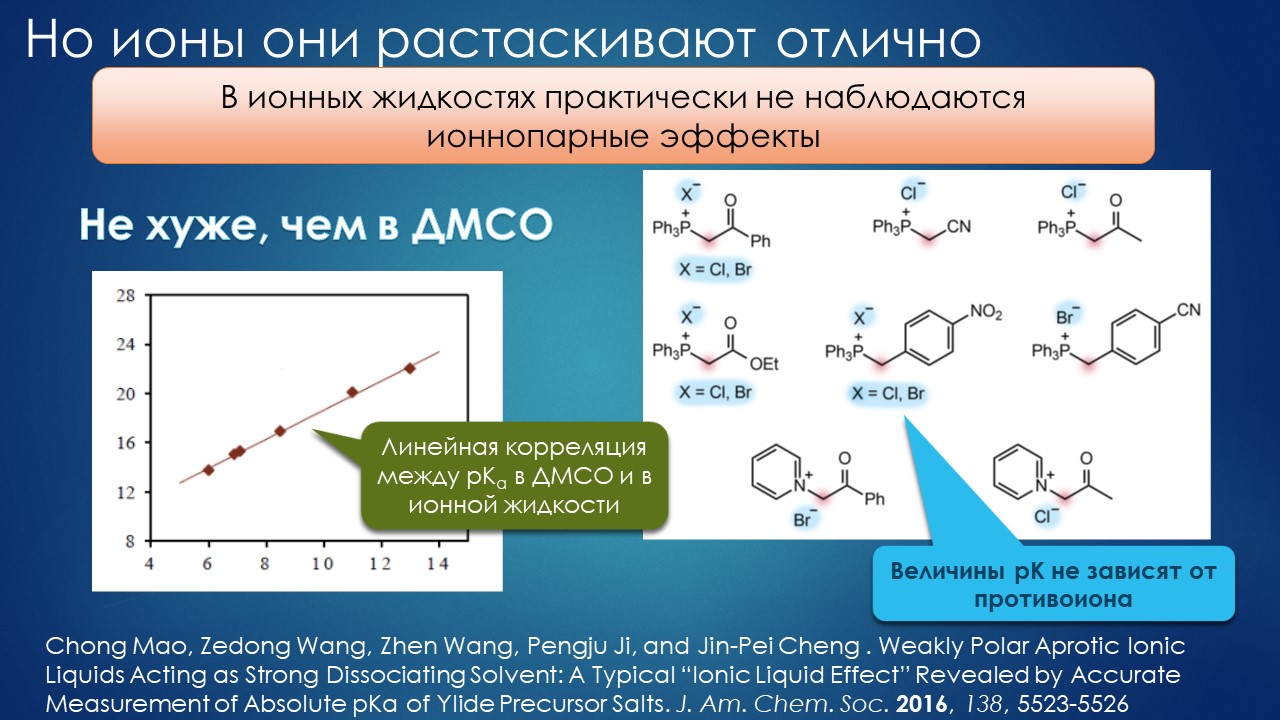
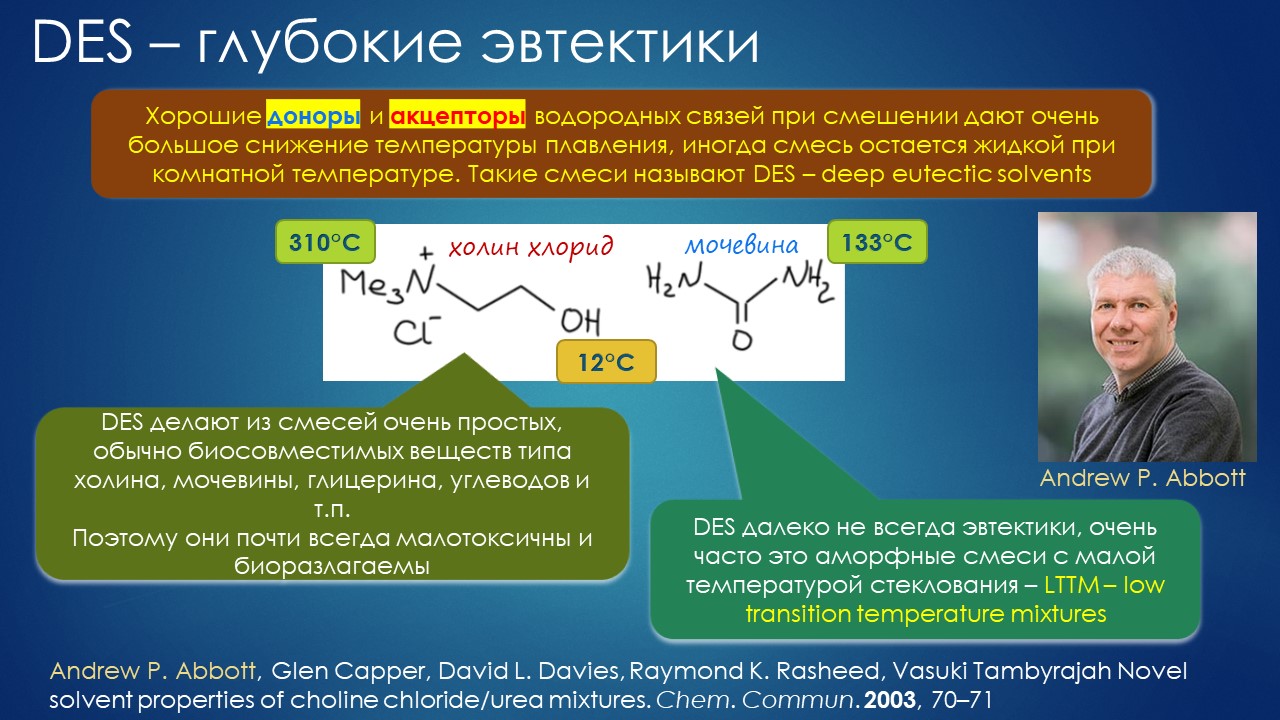
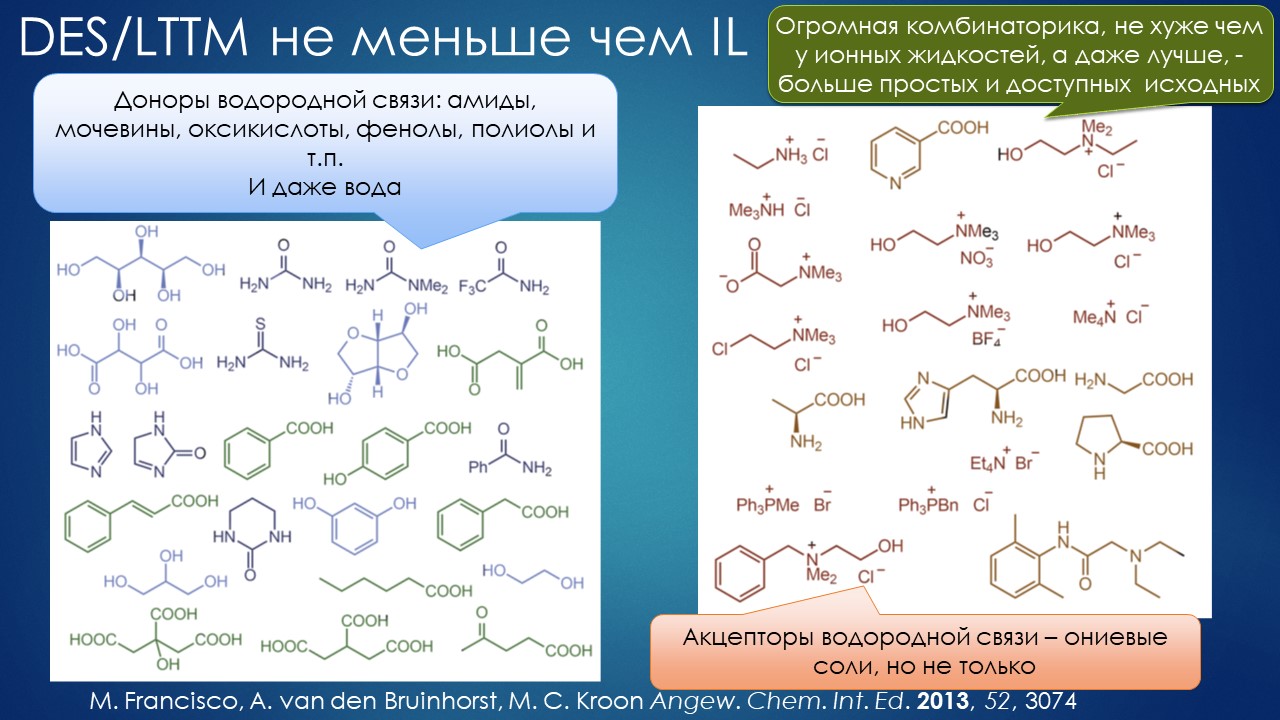
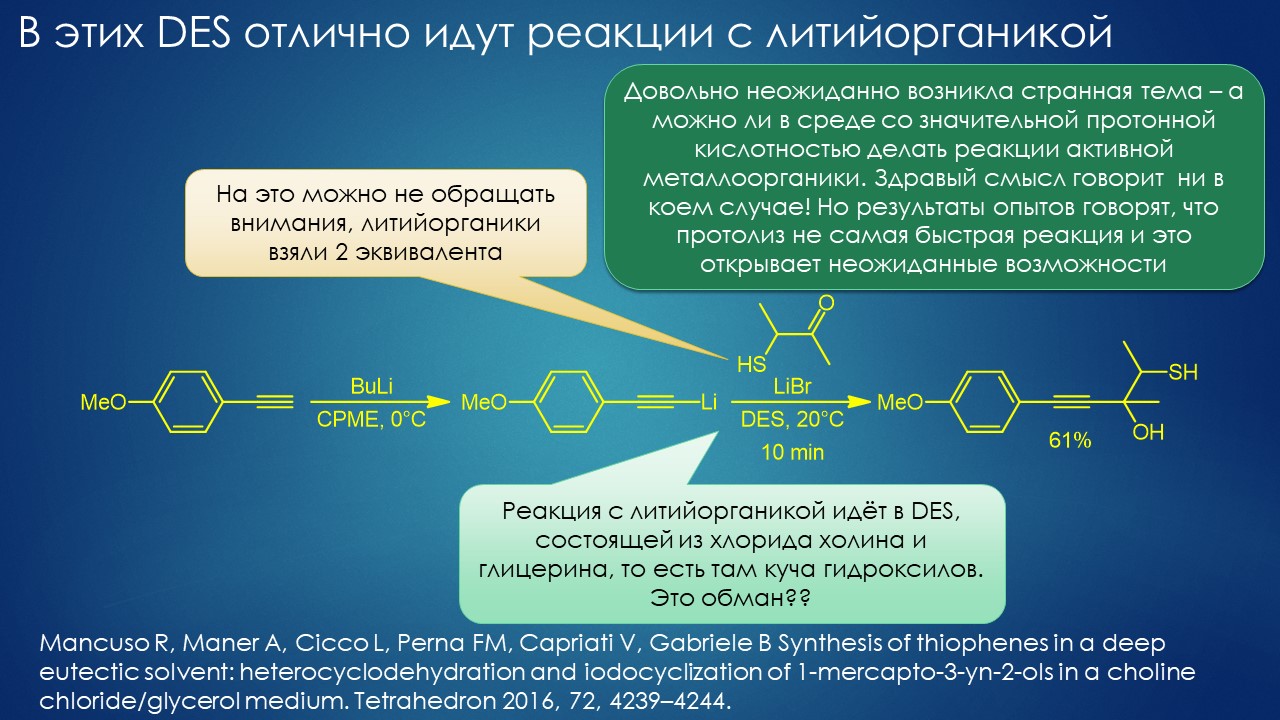
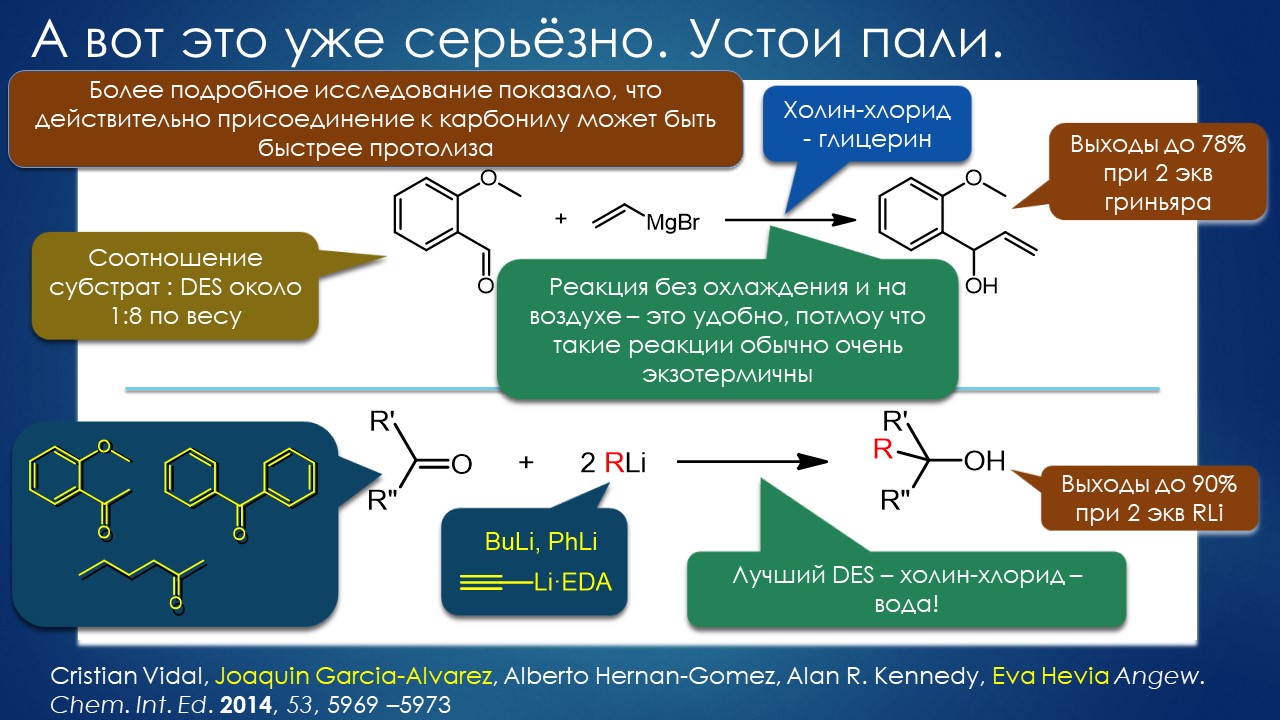
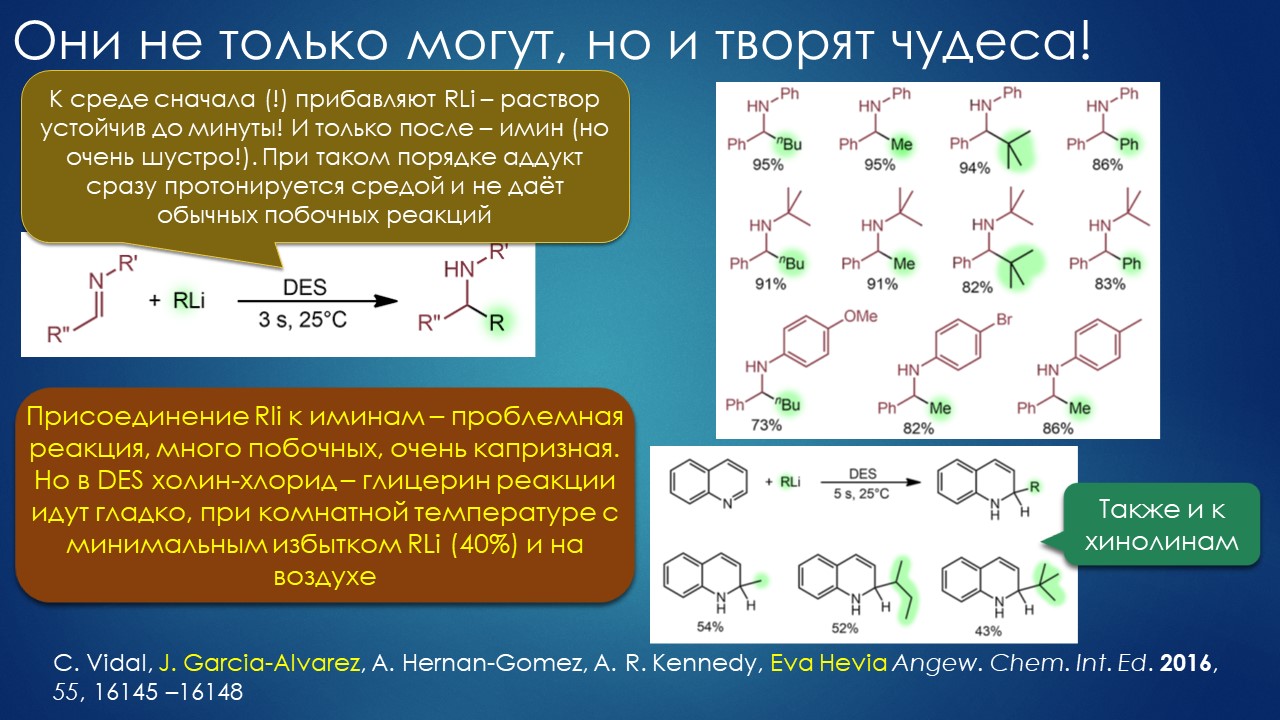
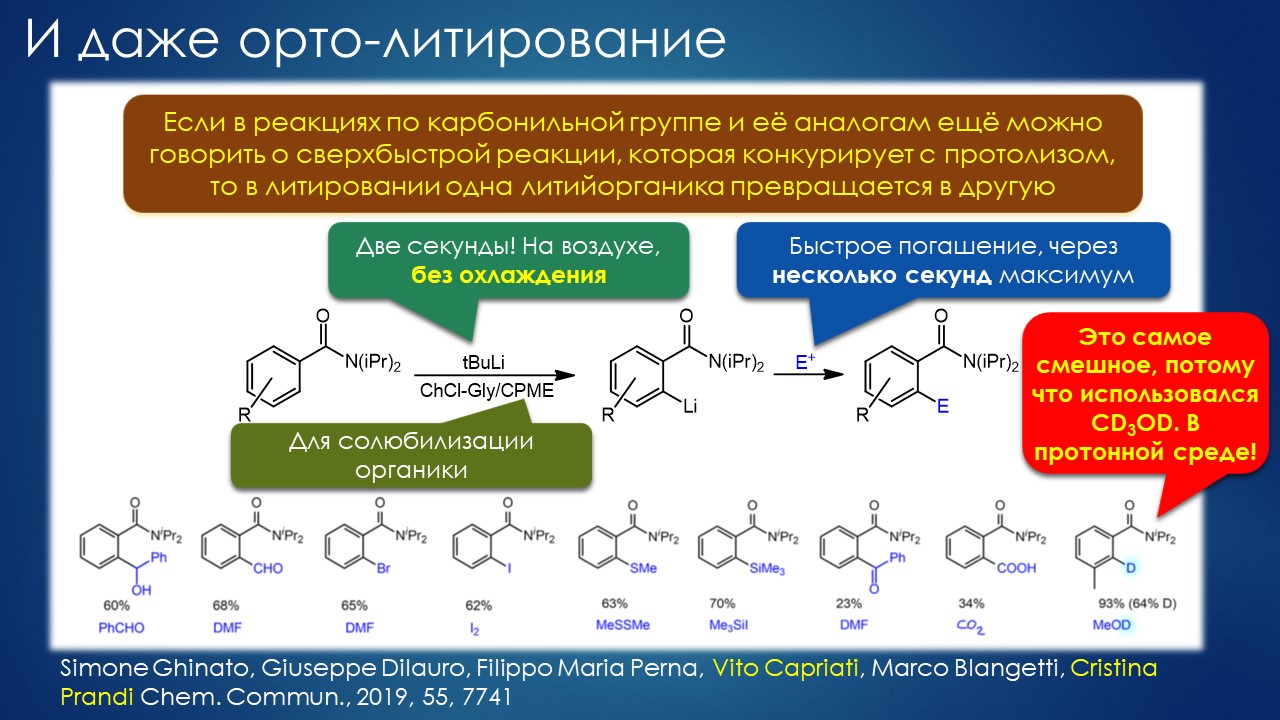
Но вода водой, а по воде в химии далеко не уплывёшь. В органической, по крайней мере. Даже если Шарплесс и правда гений, пророк и визионер, то мы получим занятную и нескучную химию; найдется некоторое количество реакций, в которых такой режим – Шармплесс остроумно предложил назвать его “на воде”, неужели он знает русскую поговорку “на воде вилами писано” – будет хорошо работать и станет любим и желанен. А вся остальная органическая химия всё равно останется с растворителями предыдущих веков. Но нашлись даже не отдельные растворители, а целые классы жидких сред, которые сразу на старте обещали прибавку каждая в триллион новых: ионные жидкости и некоторое развитие этой идеи, глубокие эвтектики и прочие незастывайки. Предлагаю так окрестить то, что по-английски назвали DES, а по-русски получается скучно и двусмысленно – глубокие эвтектики, сказывается всё же разница смысловых полей в языках. Пусть будут незастывайками, ведь в этом и есть смысл – это жидкие смеси, не желающие при охлаждении ни закристаллизовываться, ни даже стекловаться. Предвкушаю масштабную государственную программу “Развитие импортозамещающих незастываек десятого поколения в интересах народного хозяйства”. И то, и другое (ионные жидкости и DES-незастывайки) штуки занятные, им нашлось много настоящих применений, например, в экстракции, работ и патентов полно. Но с органической химией получилось сложнее, прежде всего из-за того, что крайне трудно понять, как их можно применять и каковы их настоящие свойства именно как растворителей. Выяснилось, что те параметры, которые с грехом пополам применялись для обычных растворителей, для растворителей нового типа работают, выявляя то, что зашифровано в этом “пополам” – и смех, и грех, но никакой пользы. Как-то по-другому надо их характеризовать, а как? Первоначальный вал работ, а так всегда бывает с новой идеей – все бросаются пробовать, не представляя как и зачем – быстро иссяк, именно потому что нормальный химик не может понять, как их нужно подбирать из триллиона возможных. Старые растворители всё же все на одной полке помещались – а здесь что нужно, пришвартовать к лаборатории океанский контейнеровоз с баночками? И начались мучительные поиски того, для чего это и правда можно приспособить, забыв про модные лозунги про “дизайнерские растворители на любой вкус” – хоть на какой-нибудь, но по-настоящему. Кое-что нашлось, и довольно удивительное, расширяющее сознание, привыкшее к стереотипам. Мне кажется, что у этих сред будет жизнь в органике, но старые и увы недобрые растворители они не заменят. Надо ещё искать.