Ароматичность
Ароматичность – одна из самых важных теоретических концепций в органической, а на самом деле не в органической, а просто в химии. И одна из самых спорных концепций. Если захотите в этом разобраться подробнее и полнее, вас ждут нелегкие испытания – вопросов в этой области до сих пор больше чем ответов. При этом изложение этой темы в учебниках часто весьма поверхностно и противоречиво, настолько что вопросы возникают даже у самых неискушенных и доверчивых читателей, обычно благодарно воспринимающих любую информацию. Не будем отчаиваться, и все же попробуем разобраться с основами и добиться хотя бы некоторой ясности в том, что такое ароматичность и антиароматичность, и зачем это нужно.
Обновления
10.12.2020 – Добавлен для любопытных небольшой раздел не про химию, а про вопросы языкознания и немного истории. В самом конце.
Ароматичность: программа-минимум
Простой, но широко распространенный взгляд на эту проблему можно выразить несколькими предложениями:
- ароматичность – характеристика циклических молекул, имеющих замкнутые (циклические) сопряженные системы; цикл может быть или чисто углеродным (карбоцикл) или содержать любые другие атомы в любых комбинациях (гетероцикл); цикл может иметь заряд, делокализованный по всей сопряженной системе;
- для того чтобы быть ароматическим цикл должен быть плоским (не обязательно идеально плоским, например, знаменитые аннулены Фогеля, закреплённые метановыми или другими мостиками, довольно сильно неплоские, что не мешает им быть совершенно хрестоматийным примером 10- и 14-электронной ароматичности) и содержать на циклической сопряженной системе 4n+2 электрона (то есть число из ряда 2, 6, 10, 14, 18, 22, и т.п.). Числа более 22 очень редки и нам точно не встретятся, живые динозавры на Тверской попадаются намного чаще;
- ароматические циклы обладают полным или неполным набором особых свойств, которые можно легко понять, если принять, что ароматичность выгодна, а поскольку ароматичность следует из циклического сопряжения, то все факторы, увеличивающие это сопряжение, являются благоприятными. Тем не менее, и это важно понимать, хотя именно это часто ставит в тупик многих, обладание всеми этими свойствами совершенно не обязательно, вполне достаточно одного из этих свойств для того чтобы мы заподозрили то, что соединение проявляет ароматичность. Вот эти свойства в самом кратком изложении. Итак, соединения считаются проявляющими признаки ароматичности, если они:
- обладают высокой стабильностью, либо в строгом термодинамическом смысле, если мы можем сравнить это соединение с близкими по строению, измерив или рассчитав энтальпию образования. Поскольку такое количественное сравнение очень редко можно сделать реально, особую стабильность оценивают “на глазок”, замечая, например, что это соединение как-то подозрительно легко получается в реакциях, и наоборот, само проявляет меньшую реакционную способность, чем заведомо неароматические аналоги близкой структуры. Это особенно ярко проявляется для ароматических ионов, которые обладают аномально высокой стабильностью при сравнении их со структурно похожими ионами – карбокатионами или карбанионами, но не имеющими ароматического числа электронов на замкнутой сопряженной системе;
- обладают очень характерными спектрами протонного ЯМР, в которых протоны на атомах цикла, находящиеся с внешней стороны цикла, обычно смещаются в ароматическую область спектра 7-9 м.д.; в некоторых ароматических молекулах могут найтись протоны, располагающиеся над циклом или даже внутри цикла – такие протоны наоборот смещаются в сторону маленьких или даже отрицательных химических сдвигов;
- являясь непредельными соединениями, вместо обычных для таких соединений реакций присоединения предпочитают реакции замещения, в которых ароматическая система сохраняется; бывают и электрофильные, и нуклеофильные реакции ароматического замещения; заряженные циклы (ароматические ионы) в реакциях замещения участвуют редко по формальным причинам, но нас это смущать не должно – мы их ценим не за это, а за необычно высокую устойчивость;
- ароматические циклы, особенно состоящие только из атомов углерода (такие циклы называют аннуленами), часто представляют собой геометрически правильные многоугольники, все стороны которых (связи между атомами, входящими в цикл) одинаковы, несмотря на то, что в структурах на бумаге мы рисуем чередующиеся простые и двойные связи; эту выровненность связей часто изображают кружком внутри правильного многоугольника; такие правильные циклы известны для размеров от 3 до 9 атомов углерода; большинство этих идеальных ароматических циклов – ароматические ионы, и только 6-членный цикл это нейтральная молекула, бензол; ароматические циклы от 10 атомов и больше устроены сложнее и более никогда не бывают простыми многоугольниками с одинаковыми по длине связями; для начального знакомства с ароматичностью достаточно знать примеры 1-2 таких систем;
- циклические молекулы, имеющие замкнутые (циклические) сопряженные системы, но содержащие 4n электронов (ряд чисел 4, 8, 12, 16, 20) могут быть антиароматическими, но для этого они должны быть плоскими или почти плоскими. По геометрическим причинам это возможно только для циклов с 3-5 атомами. Такие циклы обладают не менее интересным набором свойств, которые можно очень легко понять, если принять, что антиароматичность – это невыгодно, это дестабилизация, и любая молекула или ион с антиароматическим счетом электронов в цикле делает все возможное, чтобы стать насколько возможно менее антиароматической. Удивительное дело, скажет иной скептик, а что ей мешает вообще перестать быть такой, если так все плохо. Геометрия, чертова геометрия, Евклидово изобретение, – от греков, мы знаем, одни проблемы, – что в приложении к химии означает, в частности, что три атома углерода всегда лежат на одной плоскости, а ненасыщенный цикл состоит из таких плоских кусочков, и если цикл маленький, то невозможно из плоских кусочков составить неплоский цикл, и если у такого цикла случилось антиароматическое число электронов, то у него, кажется, есть проблемы. Начиная с 6 атомов возможность сделать ненасыщенный цикл неплоским появляется – можно, например, согнуть цикл пополам книжечкой из двух плоских страничек под углом или просто изменить гибридизацию хотя бы двух атомов друг напротив друга, ну а для циклов побольше таких вариантов становится так много, что антиароматической молекула может стать только по большой дурости, а среди молекул сильно дураковатых не замечено. Реальная картина, конечно, немного сложнее, и желающие доберутся до этого в более подробной части, когда она наконец будет написана, но для минимума это вполне адекватное описание действительности. Итак, если молекула с маленьким циклом от 3 до 5 и замкнутой сопряженной системой имеет число электронов, соответствующее антиароматичности, то такие молекулы:
- чрезвычайно неустойчивы, и большинство циклических сопряженных молекул или ионов с 3-5 членными циклами и таким числом электронов или никогда не были получены, и даже не наблюдались спектроскопически, или были получены и наблюдались только в особых условиях, снижающих до минимума вероятность реакций – в газовой фазе и высоком вакууме, или при очень низких температурах в так называемых инертных матрицах, например, твердом инертном газе;
- чрезвычайная неустойчивость таких молекул или ионов имеет интересное следствие – невыгодность их образования делает невыгодным или даже совсем невозможным реакции с их участием, например, вы не можете оторвать протон от молекулы, если в результате получается антиароматический карбанион (в терминах констант основности или pK это означает, что таким карбанионам соответстуют абсурдно большие pK, большие даже чем pK простых алканов, то есть числа типа 60-80), или не можете осуществить реакцию (SN1-замещение, E1 элиминирование и т.п.) с участием антиароматического карбокатиона; то есть в отличие от ароматических молекул реакции их наоборот тщательно избегают; а как же их тогда вообще получают? – оставим это до подробной части;
- если антиароматическая молекула или ион все же получены и исследованы в особых условиях, то они всегда показывают сильное отклонение от симметричной структуры аналогичного ароматического соединения, то есть от правильного многоугольника с одинаковыми связями и углами, например, вместо квадрата мы имеем вытянутый прямоугольник; связи в таких циклах имеют четкую тенденцию к сильному различию по длине, почти возвращаясь в нормальным значениям для простых и двойных связей, тем самым уменьшая степень сопряжения;
- в тех случаях, когда антиароматическую молекулы или ион удается получить и зарегистрировать ЯМР спектр, сдвиги в нем будут иметь противоположные направления по сравнению с ароматической системой, например, внешние протоны будут сдвигаться в сторону маленьких химических сдвигов;
- если антиароматичекую молекулу удается в редких случаях вытянуть на свет божий, например, взять ее в низкотемпературной матрице и оттаять, как мороженую курицу, то как только начнется хоть какое-то шевеление, она прореагирует с первой попавшейся молекулой, например, с другой такой же. Антиароматические молекулы всегда имеют огромную реакционную способность, а поскольку они все ненасыщенные, то первое, что они обычно делают, это реакция Дильса-Альдера или иное циклоприсоединение. Для антиароматической молекулы прореагировать – значит уйти от ненавистной антиароматичности, и мы понимаем, что такого шанса они не упустят.
- циклические молекулы, не подпадающие под описания ароматических или антиароматических, называются неароматическими. Неароматическими являются ненасыщенные циклы
- или вовсе не имеющие замкнутой системы p-орбиталей,
- или имеющие ее с антиароматическим счетом электронов и циклами от 6 и более атомов,
- или имеющие ароматический счет электронов, но гибкие, от 10 атомов и более без специальных элементов структуры, обеспечивающих плоскостность и жесткость, а именно всякие перемычки или тройные связи, или что-то подобное – в программе-минимум это не расшифровывается, а если захотите подробностей, то пожалуйте почитать то, что написано в подробной части, которая пока еще не закончена и не выложена, извиняюсь).
Также неароматическими будут сопряженные циклы, содержащие нечетное число электронов (особый и очень редкий случай) и/или хотя бы одну двойную связь между атомом цикла и атомом вне цикла (экзоциклические двойные связи). Этот интересный случай в минимуме не раскрывается, но в подробной части мы это обсудим.
Неароматические молекулы не имеют особых свойств, а ведут себя так, как и положено обычным ненасыщенным молекулам – легко вступают в реакции присоединения, в ЯМР показывают все сигналы соответствующих фрагментов на соответствующих местах спектра без каких-то особых сдвигов, и т.д.
После того как мы более-менее разобрались чем отличаются ароматические, антиароматические и неароматические циклы, поучимся считать электроны, и разберемся еще в нескольких деталях. Кроме этого рекомендуется почитать отдельную страничку про ароматические ионы, потому что это очень важная и очень яркая часть ароматической химии. Более подробное, объемное и неоднозначное обсуждение проблем ароматичности появится на отдельной странице в свое время, но это благословенное время ещё не наступило. Введение в строй более подробной странички про ароматичность в очередной раз откладывается. Поскольку страничка эта будет очень большой, это, несомненно, очень хорошие новости.
Правила Хюккеля для одного цикла: как считать электроны
Правило Хюккеля проще всего и надежнее работает для отдельных циклов. Собственно именно и только для этого случая оно и было сформулировано. Для полициклических соединений правило тоже работает, но требует намного более аккуратного отношения, и мы займемся этим отдельно.
Итак, у нас есть цикл, который мы хотим классифицировать как ароматический, антиароматический, или неароматический. Обратите на это внимание – сейчас мы просто хотим дать прогоноз, исходя из абстрактного описания цикла – сколько в нем атомов, какие они, какими связями связаны. Как это работает в реальной жизни, мы поговорим отдельно. Для того чтобы правило Хюккеля было применимо, мы должны убедиться в том, что:
- каждый атом цикла имеет орбиталь π-типа, то есть перпендикулярную к плоскости цикла. Для этого каждый атом должен
- или входить в одну изолированную кратную связь, двойную или тройную (изолированную – значит не две или более подряд, как в алленах и других кумуленах, но этот сложный случай в программу-минимум не входит, а кому захочется узнать, что с этим делать, можно посмотреть в подробном обсуждении ароматичности ниже);
- или иметь неподеленную пару как атом углерода с отрицательным зарядом (карбанион), или как гетероатом 5 или 6 группы (азот, кислород, сера в первую очередь; все остальное нам не встретится, и очень хорошо, потому что там много странных фокусов);
- или быть атомом с неполной электронной оболочкой, чаще всего 6-электронной (такие атомы называют секстетными), а это или углерод с положительным зарядом (карбокатион), или гетероатомы из 3 группы, прежде всего бор (нужно убедиться, что свободную орбиталь бора не забили координационной связью, в этом случае атом бора должен получить отрицательный заряд и лишиться своей π-орбитали; любители экзотики могут найти еще и всякие другие металлы, могущие участвовать в сопряжении, но мы не будем.
Обратите внимание, что атомы могут принадлежать одновременно к кратным связям и одному из двух других типов (например, иметь неподеленную пару и входить в двойную связь, быть гетероатомом и входить в двойную связь) – в этом случае учитывается только принадлежность к кратной связи.
Как только мы обошли цикл и пометили все атомы одним из трех типов (и еще раз убедились, что по дороге нам не встретился ни один атом, не имеющий π-орбиталей, то есть не принадлежащий к одному из этих типов), мы считаем π-электроны.
- атом первого типа (входящий в кратную связь) дает один электрон;
- атом второго типа (не входящий в кратную связь и несущий неподеленную пару) дает два электрона;
- атома третьего типа (не входящий в кратную связь и имеющий 6 валентных электронов) дает ноль электронов – он предоставляет пустую π-орбиталь.
Давайте потренируемся считать электроны, но перед этим подчеркнем еще раз – это формальное упражнение, которое оценивает, к какому типу, скорее всего, относится тот или иной цикл, а что в реальности для каждого цикла нужно устанавливать отдельно с помощью поиска его описания в научной литературе.
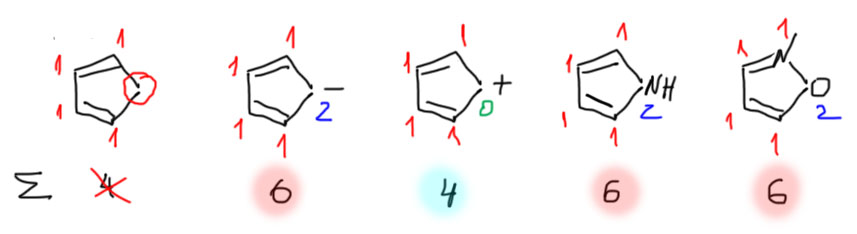
Вот три трехчленных цикла, в первом из которых нет замкнутой сопряженной системы, и он неароматичен, во втором катионе 2 электрона и он ароматичен, в третьем гетероцикличесом соединении 4 электрона и он антиароматичен. Четырехчленные циклы: циклобутадиен антиароматичен, а три следующие молекулы и иона ароматичны.
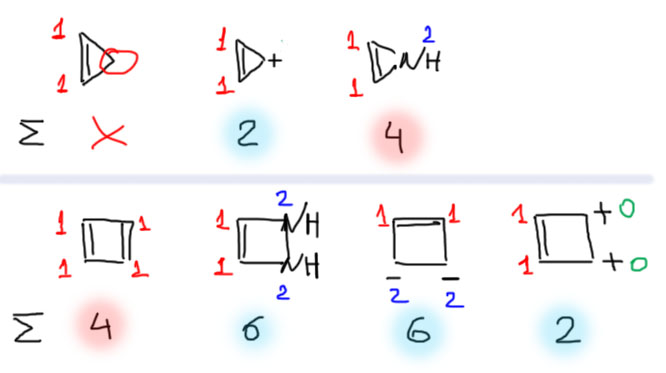
Теперь пятичленные. В первом сопряженный цикл разорван – это неароматический диен, В катионе 4 электрона – антиароматический карбокатион. Остальные дают 6 электронов – ароматические карбанион и гетероциклы.
Переходим к шестичленным. начиная с этого размера цикла, антиароматический счет электронов почти наверняка означает, что молекула неплоская и неароматическая. Три первые молекулы, в том числе катион, в котором атом азота сидит на двойной связи, следовательно дает 1 электрон независимо от того, есть на нем заряд или нет. Три последние дают антиароматический счет электронов, но имеют возможность стать неплоскими и уйти от антиароматичности. Есть и другой способ – просто изменение гибридизации атомов с парой электронов с sp2 на sp3, выводящей электронные пары из эффективного сопряжения пр формальном сохранении плоскостности. Они так и сделают, тем или другим способом. Это интересная проблема, и мы ее когда-нибудь обсудим подробнее. Дианион этот кстати промежуточно образуется в восстановлении бензола по Бёрчу, и если бы он был антиароматическим, могу уверить, что мы не знали бы никакого такого восстановления – не пошло бы оно через антиароматический интермедиат. Молекула с двумя кислородами (1,4-диоксин) не менее интересна: ее производными являются одни из самых гнусных загрязнителей окружающей среды, образующиеся при горении всякой дряни на свалках и заводских печах. Были бы они антиароматическими, мир был бы избавлен от большой гадости, они бы просто не получались.
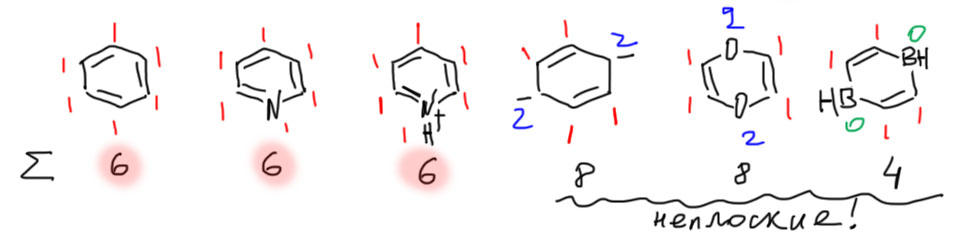
И циклы от 7 до 9. Здесь мы продолжаем считать ароматическими циклы с ароматическим счетом электронов, но неплоскими и неароматическими циклы с антиароматическим счетом электронов.
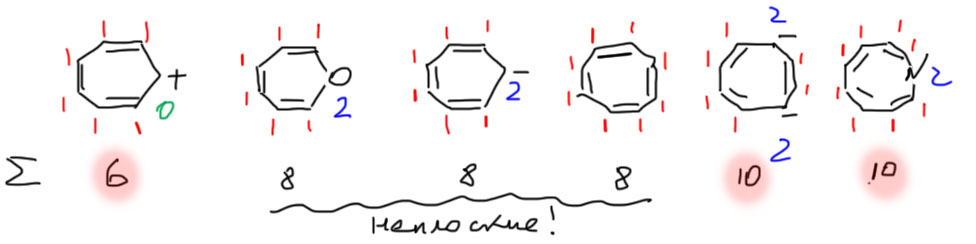
Дальше не пойдем, потому что начиная с 10-членных циклов простая схема работать перестает, и нужно разбираться подробнее, чем мы займемся в подробной части. Простой рецепт состоит в том, что подавляющее большинство молекул с циклами от 10 и более являются неплоскими и неароматическими независимо от того, сколько электронов мы насчитаем в таком цикле.
Полициклические молекулы, состоящие из шестичленных колец
Пока ограничимся только самыми распространенными системами такого типа, состоящими из шестичленных колец, похожих на бензольные. Забегая вперёд, скажем, что большинство таких молекул ароматичны в том или ином варианте. И это одно из проклятий человечества. Мы уже много наслышаны про особую стабильность ароматических соединений, про то, что такие соединения легко получаются в разнообразных реакциях, а сами не очень торопятся превращаться во что-то другое. Увы, это приводит к тому, что такие соединения образуются из всевозможных отходов на свалках и помойках, особенно когда всё это горит. То же происходит и при тлении табака при курении. Немногие соединения выдерживают высокую температуру пламени, а эти как раз образуются при пиролизе многих материалов и выживают, рассеиваясь по всему свету. Такие полициклические соединения (они называются обобщённо ПАУ – полициклические ароматические углеводороды, по-английски PAH) являются одними из самых зловредных загрязнителей окружающей среды. Некоторые из них канцерогенны, в частности известный всем хотя бы по названию бензпирен. Здесь надо точно сказать, что канцерогенность как раз не связана с ароматичностью, она определяется другими структурными особенностями некоторых молекул такого типа. С ароматичностью связана лёгкость их образования и устойчивость, в том числе в окружающей среде, где свет и кислород понемногу уничтожают все органические соединения, и опять, ароматические выживают лучше других. Нам на погибель.
Циклы можно соединять друг с другом в более сложные молекулы. Количество вариантов соединения огромно, но мы ограничимся самыми распространенными. Главная проблема полициклических сопряженных молекул состоит в том, что нужно понять, где в них живет ароматичность, а жить она может как в самом большом цикле, охватывающем всю полициклическую молекулу (внешнем сопряженном контуре), так и в отдельных циклах или кусках большой молекулы. Может даже и так, и так. Не нужно забывать, что хотя мы говорим “ароматическая молекула”, но ароматичность всегда связана не со всей молекулой, а только с циклами, и если в молекуле несколько циклов, то проверять на ароматичность нужно каждый из них.
Конденсированные бензольные кольца
Конденсированными называются соединения колец по одной связи (по ребру, если с точки зрения геометрии). Если соединять таким образом бензольные кольца, получается огромное количество молекул, среди которых есть несколько очень важных. Что там с ароматичностью? Все довольно просто. Есть два и только два способа соединять конденсированные кольца – в линеечку и уголком. Друг на друга еще можно ставить, – скажет кто-нибудь. Нет, это уже другой способ, потому что в нем найдутся кольца, соединенные более чем по одной связи. Таких структур тоже много, но с точки зрения ароматичности там все очень непросто, простых рецептов там нет, и в минимум мы их не возьмем.
В линеечку
Такие штуки называются аценами. Самая простая из таких молекул нафталин, затем идет антрацен, после просто по порядку тетрацен, пентацен, гексацен и т.п. Если не уходить совсем далеко, а там быстро начинаются чисто экспериментальные сложности, то каждый ацен имеют единый ароматический внешний контур с 10 (нафталин), 14 (антрацен), 18 (тетрацен) и т.п. электронами, и соответствующие ароматические свойства (выровненность длин связей, склонность к реакциям замещения, изрядную устойчивость, смещения сигналов в спектрах ЯМР и т.п.). Электроны считаем как обычно, не забывая заходить на атомы сочленения циклов.
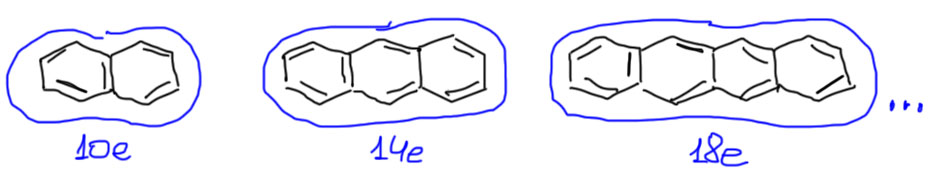
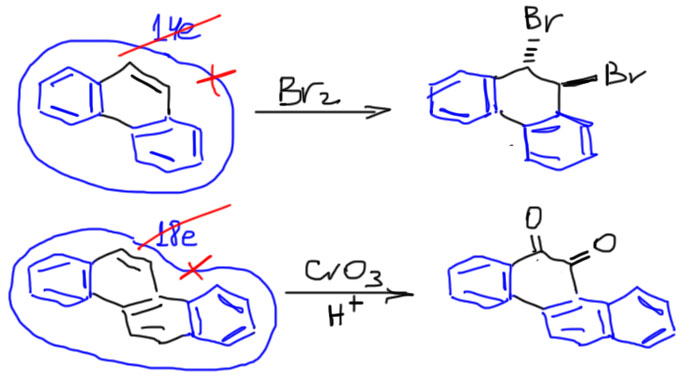
У всех аценов есть еще одно общее свойство – при том, что для них вполне характерны реакции ароматического замещения, сохраняющие в целостности аценовую систему, они не против реакций, в которых одно из колец выпадает из общего ароматического контура при условии, что оставшиеся кольца становятся ароматическими системами поменьше, а это выгодно. Выпадающее кольцо при этом выбирается так, чтобы в результате получить побольше меньших ароматических систем. У нафталина выбора нет, жертвуем одним кольцом, остаемся с настоящим бензольным. Но антрацена уже есть – получить один нафталин или два бензола. Выбираем два бензола, пожертвовав средним кольцом. Тетрацен получит бензол и нафталин. И т.д. Из-за этого ацены лешко окисляются в хиноны (хинонное кольцо неароматическое), частично гидрируются, присоединяют бром, и вступают в реакцию Дильса-Альдера как диены (кроме нафталина). Получается такой обмен жилплощадью – ароматичность меняет одну большую и неуютную квартиру на две поменьше, но в хорошем районе, у настояших бензола и нафталина. В современной химии такие реакции аценов стали любимой игрушкой архитекторов и дизайнеров замысловатых молекулярных конструкций.
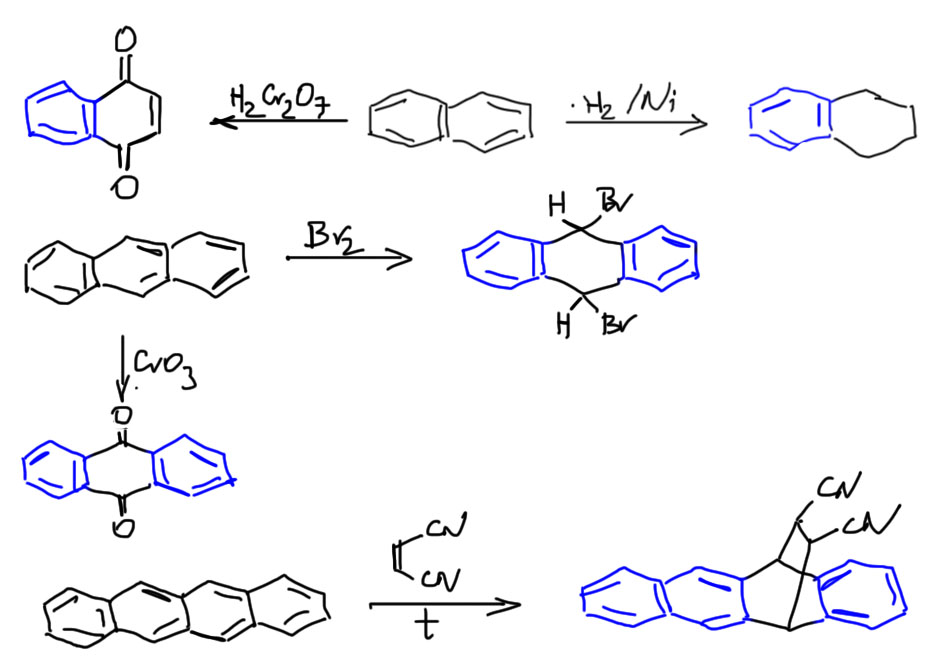
Уголком
Соединение уголком дает большое разнообразие новых молекул. Их общее свойство резко отлично от свойств линейно-конденсированных аценов – они сразу же разделяют общую сопряженную систему на две или несколько ароматических поменьше, а кольцо, на котором как раз и образуется уголок выпадает из общего ароматического контура. Если в этом кольце есть двойная связь, то она становится обычной двойной связью, прост сопряженной с ароматическим кольцом, как в стироле. Она легко гидрируется, присоединяет бром, эпоксидируется, и вообще не проявляет никакой вовлеченности в ароматическое дело. Вот, например, первая из таких молекул, фенантрен, изомер антрацена, но в фенантрене нет общего ароматического контура на 14 электронов, о чем свидетельствует, в частности, его структура – в крайних кольцах связи выровнены по длине, а в среднем кольце связи имеют практически нормальные для двойных (около 1.36 Å) и одинарных (около 1.47 Å) связей. Фенантрен – это фактически два бензола плюс обычная двойная связь посредине. В другом примере, это называется хризен, ситуация та же, но в нем не одно, а два угловых кольца, и они оба имеют те же характеристики, что среднее кольцо фенантрена: хризен это два бензола, и кольца с двойными связями посредине. Но как только мы сломаем двойную связь, из оставшейся части молекулы сформируется полноценный нафталин, и дело на этом закончится.
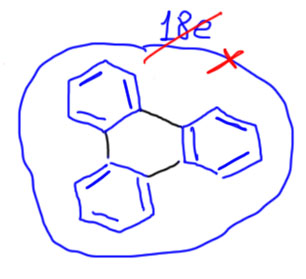
Если соединим уголком больше колец, как например в трифенилене, то получим не один 18-электронный общий ароматический контур, а просто три соединенных бензола – связи между кольцами будут такие же как в банальном дифениле.
Полициклические системы с антиароматическим счетом электронов на внешнем контуре
Да, такое бывает и довольно часто. С такими молекулами все очень просто, и даже удивительно, почему они иногда ставят в тупик простым вопросом: “А они что, антиароматические???”
Нет конечно. В большинстве таких молекул есть нормальная ароматическая часть или части, имеющая ярко выраженные и типичные ароматические признаки. А все остальное становится обычным сопряженным заместителем. Одна из самых популярных из таких молекул – аценафтилен (не путать с аценафтеном, у которого нет двойной связи в 5-членном цикле). Внешний контур имеет 12 электронов, но по всем свойствам это просто ароматический нафталин и обычная двойная связь, которая охотно присоединяет бром, мягко гидрируется (как раз в аценафтен) и все остальное.
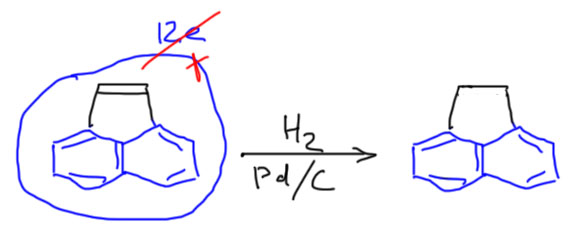
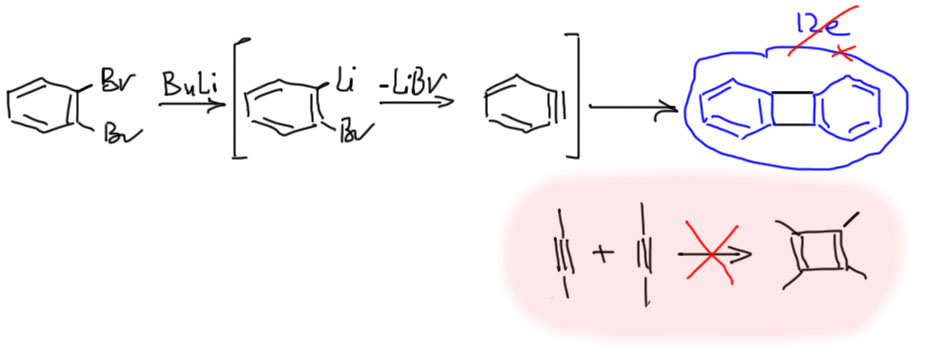
Те же 12 электронов на внешнем контуре у дифенилена, очень часто образующегося в виде побочного продукта в реакциях с участием бензина (дегидробензола). Бензин очень реакционноспособен и обычно находит, с чем прореагировать, с нуклеофилом или диеном. Но если быстро не найдет ничего другого, то просто димеризуется в дифенилен. Дифенилен – это просто два бензола, соединенные двумя простыми связями. Ничего особенного. Кстати, обратим внимание, что обычные ацетилены так димеризоваться не могут, и не только по квантовым причинам, которые прямо запрещают такие реакции, но и потому что в этом случае образовался бы уже по-настоящему антиароматический циклобутадиен.
Можно найти и еще немало примеров таких молекул. Просто упомянем еще одну, точнее даже целый класс больших гетероциклических полициклических молекул порфиринов, также имеющих внешний контур с антиароматическим счетом электронов, но и множество циклов поменьше с вполне ароматическими характеристиками. Здесь обойдемся без подробностей.
В конце этого раздела маленькое замечание. Наличие внешнего антиароматического контура все-таки нельзя считать совсем незначимым обстоятельством. Сопряжение там есть, все циклы имеют непрерывные цепи сопряжения, а значит антиароматический контур в таких молекулах все же есть. Его влиянием на фоне хорошо выраженных ароматических можно пренебречь, но все же в таких молекулах всегда есть что-то необычное, какая-то тайна. Вот, аценафтилен, например, имеет желтый цвет. Откуда? Нафталин совершенно бесцветен, и одна сопряженная двойная связь в цветность тоже добавляет немного. Откуда тогда цвет – не от антиароматической ли дестабилизации? Оставим этот вопрос без ответа, просто чтобы напомнить, что в химии много всяких любопытных вещей.
Откуда вообще взялась эта ароматичность? Хорошо ли пахнут ароматические соединения?
Почему мы вообще ассоциируем это сложное явление с обонянием? Откуда взялся этот научный термин, за которым стоит настолько нетривиальное содержание, что до сих пор побуждает исследователей осмысливать и переосмысливать, искать новые интерпретации и глубокие теоретические обоснования. Почему путь к нему лежит через нос? Может быть, надо вообще перестать искать новые критерии ароматичности, а натаскать на неё животных, обладающих острым обонятнием, собак, например, или свиней – свиньи ведь ищут трюфели в лесу, очень острый у них нюх, помогающий разбираться в сортах и видах разнообразных помоев. Заведём специальную сертифицированную хрюшку, назовём Кекулией, и будем подносить ей новые соединения, об ароматичности которых нам нужно узнать, и научим ее, понюхав, хрюкать: один раз – слабая ароматичность, два – посильнее, три – бензол, четыре – что-то совсем выдающееся. А если не захочет нюхать и повернётся задом – это антиароматическое соединение.
Я, кстати, совершенно уверен, что это не пустые фантазии. Давно замечал, что ароматичность и правда что-то делает с запахами. Ароматические соединения пахнут совсем не так, как их ближайшие неароматические аналоги. Вот если мы, например, пойдём от циклогексана – у насыщенных углеводородов запахи очень слабые, что вполне понятно – они и к обонятельным рецепторам не могут как-то пристроиться, настолько инертны. Но стоит вставить двойную связь, как мы будем поражены резким и очень неприятным запахом – как будто организм даёт нам понять, что с ненасыщенными веществами связываться не стоит. Вставим две двойные – запах станет совсем невыносим – как будто нам хотят выесть мозги этой непероносимой вонью. Это очень правильно: диены – плохие вещества, канцерогенные и так далее. Но бензол – формально три двойные связи, и запах стихает до очень слабого, даже немного приятного. Эх, организм-организм, который якобы не ошибается, прямо как органы госбезопасности, – а вот ошибочка и вышла – бензол ведь хуже их всех, канцероген совершенно доказанный, одно из безусловно вредных веществ, не работайте с ним никогда без хорошей тяги. А если метильную группу воткнуть – запах изменяется, становится резким и тяжёлым. Больше всего остального ненавижу запахи простых метилбензолов, толуола и ксилолов – ощущение всегда такое, как будто мозги плавтся. Но и здесь ошибочка – они намного менее вредные, чем сам бензол, и чем больше метильных групп, тем слабее токсичность. У тетраметилбензолов она настолько слабая, что кажестся, что вред можно нанести только если съесть их столько, сколько весишь сам – по крайней мере, на такие мысли наводят опубликованные характеристики токсичности типа LD50. Метильные группы драматически изменяют биохимию ароматических соединений и вместо страшного эпоксидирования, порождающего в клетке канцерогенные напряжённые оксираны, происходит безобидная разборка с боковой цепью. В гетероциклическом ряду что-то похожее происходит. Как пахнут сульфиды – ужас, выворачивает наизнанку от одной капли в ста метрах. Тиофен же пахнет настолько слабо, что можно подумать, что вообще ничем не пахнет, на самом деле, что-то похожее на бензол, – молекулы тиофена и бензола почти неотличимы по размеру. Амины – брр…, гадость, запахи гнили и распада. Пиррол – слабый, почти приятный запах. Правда, пиридин – вот уж вонючка мерзейшая, и отлично, токсичен он настолько, что печень, стоит только в воздухе почуяться пиридину, начинает разбухать и вылезать наружу, вопя, чтоб убрали это немедленно, а то она не справится и откажет в обслуживании. Но нюхали ли вы когда-нибудь пиперидин? И не надо – сочтете после, что уж лучше пиридин (на самом деле, это не так, пиридин хуже, нос опять подводит).
Но если серьёзно – откуда взялся термин ароматические соединения. Автор этого термина достоверно известен и вряд ли вызовет удивление – да, это тот самый Фридрих Август Кекуле (ударение на первый слог, а не на последний, как иногда считают из-за написания фамилии Kekulé c несвойственным немецкому языку значком французского острого ударения – по легенде этот значок добавил отец основоположника, когда их родина, княжество Гессен, вошла в империю Наполеона, чтобы по-французски фамилию не сокращали в Кекюль). Проблема в том, что он никак не объяснил, почему он это сделал. Просто он долго ломал голову над свойствами салициловой кислоты, и над тем, почему она ведет себя не так, как гидроксиуксусная (гликолевая), например, при действии пятихлористого фосфора не дает хлорбензойную. Голову ломать пришлось очень сильно, потому что в это время не было еще никаких представлений ни о структуре, ни о заместителях, ни о функциональных группах, и все умозаключения строились на элементном составе и аналогиях. И написал про это большую статью по-французски в бельгийском журнале в 1860 (он в эти годы работал в бельгийском Генте и часто писал статьи по-французски), дословно повторив ее по-немецки в Annalen в 1861 году, просто признав, что салициловая кислота относится к другому ряду органических соединений, названному им ароматическим, в противовес жирному, к которому принадлежит уксусная кислота. Именно тогда Кекуле задумался о необычных свойствах производных бензола, что и привело его через пять лет к знаменитой формуле с чередующимися связями, которой мы неизменно и пользуемся с тех пор.
Кекуле не объяснил, почему взял этот термин по очевидным причинам – в те времена научные дискуссии еще не обязательно публиковались, многое оставалось в письмах между учёными, которых было так мало, что они все друг друга знали, и хорошо представляли, что каждый думает и предлагает. Да и ездили друг к другу тогда очень много, те же Бутлеров с Марковниковым в эти годы часто бывали в Германии и других ведущих научных странах Европы, и лично все проблемы перетирали. Именно поэтому так трудно установить приоритет важных идей и подходов тех лет, а именно тогда и формировался язык химии – тот же спор о том, кто является отцом структурной теории органической химии и когда появились общепринятые структурные формулы, легко заходит в тупик, потому что основная работа над этим никак не отразилась в научной литературе тех времйн, а так и осталась в очных и эпистолярных дискуссиях между Кекуле, Кольбе, Купером, Бутлеровым, Дюма и еще десятком Отцов-Основателей химии.
И, скорее всего, этот выбор был очевиден тогда всем. Точно так же как термин “жирные”, или чуть формальнее и научнее “алифатические” (это то же самое, только с греческим корнем, означающим тот же жир, и ксати, кто изобрёл этот термин тоже не совсем ясно, вроде бы Гофман, но где и когда?) взялся от того, что химики тех времен видели прямую связь между всякими реальными жирами и маслами и соединениями этого ряда.
Родоначальники ароматического ряда точно так же вышли из всяких приятно пахнущих веществ. Прямо с самого начала. Откуда взялось слово бензол (первооткрыватель бензола Майкл Фарадей назвал новое вещество просто по составу бикарбюретом водорода, второоткрыватель бензола Митшерлих предложил слово Benzin, Либих тут же предложил Benzol, и это слово осталось в немецком и у нас; французы долго использовали слово phen – фен, откуда пошли фенил, фенол и тиофен, ну а в английском закрепилось benzene)? И почему карбоновую кислоту от бензола называют не бензольной, а бензойной? Это вообще однокоренные слова?
Да, безусловно. Но происхождение у них не совсем такое, как обычно – производное производится от углеводорода. Здесь всё наоборот. Все названия происходят из бензойной кислоты, откуда Митшерлих и получил бензол, как учат в нашей школе, нагреванием с известью. Именно так – не бензойная кислота произошла от бензола, а бензол – от бензойной кислоты. А она откуда? А она – из благовоний. Из ароматического растения стиракс, которое еще в средние века привезли в Европу арабы под названием “благовоние с острова Ява”, что в латинской транскрипции выглядело как-то типа luban jawi. Поскольку арабы в основном имели дело с романскими народами, у которых в ходу артикли типа la, le, lo, il и т.п. из арабского слова удалили первый слог, посчитав его таким артиклем, и по языкам европейского Средиземноморья пошли гулять слова на мотив этого banjawi типа бенджавина, бенджоина и т.п. пока уже в новое время не образовался benzoin, и когда появилась научная классификация растений, исходное растение назвали Styrax benzoin L. – по-нашему Стиракс бензойный. Засохшая смола этого дерева – весьма популярное благовоние, называемое по-разному, и бензойной смолой, и просто бензоем, и стираксом, и ещё росным ладаном, а это дешёвая разновидность настоящего ладана, знаменитого церковного благовония. Настоящий ладан воскуряет разве что Вселенский патриарх, а в остальных храмах используют как раз этот росный ладан, а то и еще что подешевле типа сосновой смолы. Еще в алхимические времена (якобы, первый раз это сделал сам Нострадамус – получается, что этот средневековый проходимец снабдил нас не только дурацкими предсказаниями всего на свете на все времена, но и химией ароматических соединений) возгонкой из бензойной смолы получили бензойную кислоту, – в ранней химии это было одно из любимых соединений, с которым что-то делал каждый известный в истории химик, пока наконец его состав точно не установили Вёлер и Либих в 1832. Так что бензол в истории химии непосредственно связан с благовониями, можно даже сказать, с ладаном.
Если бы только бензол. Уже по называнию смолы стиракс становится ясно, что где-то тут и стирол. Точно так и есть. Только ладаном тут не пахнет. Вообще, стираксами или стораксами называли несколько разных растительных смол или бальзамов, всегда пахучих. В этом случае речь идёт о смоле азиатского дерева с пышным названием ликвидамбр восточный, это дерево и у нас иногда можно встретить в парках на юге. Само ботаническое название говорит о пахучей жидкости, выделяемой разными видами рода ликвидамбр. Ими давно интересовались химики и фармацевты. В 1827 французский фармацевт Жан-Франсуа Бонастр выделил из масла ликвидамбра некое вещество, при нагревании которого он и получил стирол. Вещество из смолы, скорее всего, было сложным эфиром коричной кислоты и коричного спирта, и при нагревании подверглось син-элиминированию с образованием стирола. Фармацевт, правда, этого не понял, но в деле разобрался через несколько лет берлинский аптекарь и химик-любитель Йохан Эдуард Симон. Он повторил эксперимент и определил элементный состав жидкости, которая оказалась точно такой же, как и у открытого недавно бензола – в это время еще не умели определять молярную массу, но находили только соотношение элементов. Симон и дал название стирол, и ещё он обнаружил, что полученная жидкость через некоторое время застыла в прозрачную массу. Так он заодно открыл и полистирол, впрочем в то время понять, что случилось и зачем это может понадобится, не смог бы установить никто.
Толуол не менее ароматичен. Вообще во всяких ароматических маслах в растениях содержатся разные производные бензилового спирта, в основном эфиры. При сильном нагревании они расщепляются, и бензильный радикал дает толуол. Вот так его впервые и обнаружил при сухой перегонке смолистой сосновой коры первый польский химик Филип Нериус Вальтер, участник польской войны за независимость 1830 года. После подавления восстания русскими войсками Вальтер эмигрировал во Францию и работал там вместе с французским фармацевтом Пьером-Жозефом Пеллетье, вот они первыми и получили толуол. Сосновая кора – штука ароматная, но немного тривиальная, впрочем, толуол получил название от более экзотического вещества. Второй раз его получил гораздо более знаменитый французский химик Анри Этьен Сент-Клер Девиль из ароматной смолы южноамериканского дерева Мироксилон бальзамический, известной как толуанский бальзам (по городку Толу в Колумбии). Источником явно тоже был пиролиз бензиловых эфиров, содержащихся в бальзаме.
Хороший уже диапазон ароматов мы видим в ароматических углеводородах – от Явы и Суматры до Передней Азии и Южной Америки.
К сожалению, ксилолы не поддержат эту тенденцию видеть в исторических названиях ароматических углеводородов сплошь всякие изысканные ароматы. В этом названии мы тут же видим банальный корень ксил-, то есть дерево. Ксилолы впервые получили из древесного дёгтя, сразу несколько исследователей. Трудно понять, откуда они там берутся, видимо, это какое-то очень глубокое пиролитическое превращение углеводов древесины, не лигнина – в лигнине ароматические кольца всегда содержать фенольные или метоксильные заместители, которые вряд ли могут куда-то пропасть.
Из триметилбензолов с мезитиленом мы уже разобрались в самоконденсации ацетона на страничке про альдольную конденсацию. Есть ещё 1,2,4-триметилбензол. Он так и называется, но иногда его называют псевдокумол. Это отголосок тех давних времен, когда не могли понять, как устроен настоящий кумол и думали, что это он и есть.
А вот настоящий кумол тоже отсылает нас к ароматическому растению, да ещё какому! Более того, это растение дало названия даже не одному, а сразу двум ароматическим углеводородам. Растение это должно быть знакомо всем, потому что его высушенные семена – это знаменитая пряность зира или кумин, без которой не приготовить ни плов, ни много других восточных блюд. Растение называется Cuminum cyminum (читается Куминум циминум), а по-русски Кмин зира или просто зира. Это небольшая трава семейства зонтичные (по современной номенклатуре – сельдерейные), ароматное эфирное масло которой и является источником двух углеводородов – кумола и цимола. Внимательный взгляд тотчас распознает в этих названиях обе части ботанического названия, а это тоже своего рода игра слов – это историческое греческое название (циминум) и его латинская форма (куминум). Цимол (п-изопропилтолуол) содержится прямо там, в эфирном масле, и в больших количествах, что позволило его оттуда достать перегонкой ещё в 1841 году французскому химику Огюсту Кауру. Дальше он стал всячески издеваться над полученным соединением, а это в те годы означало погреть с кислотами, посмотреть, что будет, еще погреть. Вот так ему и удалось сначала окислить метильную группу, а затем декарбоксилировать – получился просто изопропилбензол, но в то время это понять было невозможно, и это было просто названо кумолом. Поскольку эксперименты тогда описывали весьма расплывчато, скорее даже кумол был получен из другого важного компонента куминового эфирного масла, куминового альдегида. Ведь понять, как Кауру удалось окислить метил, не затронув изопропила, с нашей точки зрения категорически невозможно. Правильную структуру установил только Фиттиг реакцией бромбензола и изопропилбромида с натрием. В совсем современной химии цимол неожиданно стал очень модным лигандом для комплексов рутения. Кумол – промышленный полупродукт, его делают в огромных количествах для кумольного метода ситеза фенола. 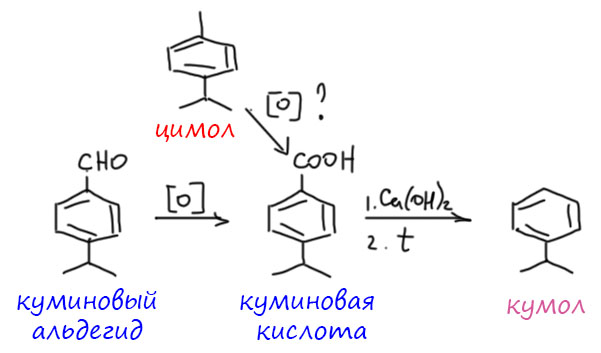
На этом ароматические называния роматических углеводородов заканчиваются. Есть еще одно тривиальное название – 1,2,4,5-тетраметилбензол называется дуролом (английское durene лучше не читать дурен, а тем более, дурень). Но это просто потому, что среди обычно жидких углеводородов это первый твёрдый, по-латински durum, да еще и не очень легкоплавкий, образующий красивые большие кристаллы.
Вот такие названия у ароматических углеводородов. Душистые. Не у всех, но у большинства. И это очень хорошо знали величественные основоположники, в первую очередь, Август Кекуле, потому что всё это открывали и доставали из благовонных масел и смол как раз в его время. Так что ассоциация бензола и его производных (еще очень много ароматических, в прямом смысле, веществ среди ароматических альдегидов и фенолов, попадаются еще и другие ароматные производные) с ароматическими веществами была практически неизбежной. В тех же растениях еще полно других сильно-пахнущих веществ, но это в большиснтве терпены с очень непростыми структурами, установить которые удалось лишь намного позже. Терпены не имеют никакого отношения к бензолу. Да и вообще запахи – явление сложное, в наше время довольно неплохо изученное, связанное с взаимодействием молекул с рецепторами запахов – для этого важна форма молекулы и некоторые группы, обеспечивающие связывание с рецептором.. Само по себе ароматическое кольцо мало что для этого даёт. Ну и уже в 20 веке, когда появились мощные методы разделения и идентификации, в приятных запахах стали массово открывать гетероциклические соединения, тоже ароматические, производные тиофена, фурана, тиазола, пиразола, пиразина и пр., но эти соединения обычно не содержатся прямо в ароматных растениях, а образуются при кулинарной обработке, термическом разложении и реакциях углеводов, аминокислот и прочего.
