Алкены
Очень “жирный” раздел, просто забитый всякой информацией. Алкены, в отличие от алканов, очень часто используются в лабораторном синтезе – двойная связь имеет разнообразную реакционную способность, и на реакциях двойной связи основаны многочисленные методы. Программа обширная. Сразу обратите внимание на то, что в программе есть много вещей, которые нам сейчас просто “не взять” – сил не хватит (и знаний). Они выделены рыжим курсивом. На коллоквиуме их обсуждать не будем. Возможно, их придется подобрать ближе к экзаменам, и только тем, кто хочет от жизни все и даже больше.
Сразу определимся со словами. Во-первых, алкены часто называют по-старому олефинами. Эти два термина можно считать полными синонимами и использовать попеременно. Никакой смысловой разницы между ними нет, хотя есть небольшое преимущество у слова “олефин”, просто потому что в нем нет вообще никаких намеков на углеводородную природу молекулы, в то время как “алкен” неявно соотносится с “алканом”, а последним словом точно принято называть только насыщенные углеводороды. Это такая прикладная, и во многом бессмысленная филология, но нельзя не обратить внимание на то что ни этилбензол, ни пропионовую кислоту никло никогда не назовет алканами ни в каком контексте, в то время как стирол или акриловую кислоту мы спокойно назовем алкенами или олефинами, когда рассуждаем про реакции на двойной связи. В органике алкенами или олефинами называют любые органические соединения, в составе которых есть двойная C=С связь. Поэтому не удивляйтесь, когда увидите что олефином называют спирты, кислоты, кетоны, амины, аминокислоты и все остальное только потому, что где-то в структуре нашлась двойная связь. Так будет всегда и с любым классом органических соединений.
Под программой как всегда разобраны важные вопросы в раскрывающихся блоках.
Подробная программа раздела
Программа по разделу – часть первая
1. Электронное строение двойной связи С=С. Гибридизация атома углерода. Строение этилена длины связей, углы). Энергия π– и σ – связи в этилене. Геометрическая изомерия. (цис-транс– и Z/E- номенклатура). Отличие конформеров (алканы) и геометрических изомеров. Относительная термодинамическая стабильность цис- и транс- изомеров бутена-2.
2. Зависимость стабильности алкенов от степени замещения двойной связи (бутен-1 и бутен-2) – оценка относительной стабильности из теплот гидрирования. Факторы, влияющие на энергию двойной связи – гиперконъюгация и стерические факторы (в цис-алкенах).
3. Гетерогенное и гомогенное гидрирование алкенов. Гетерогенные катализаторы на основе соединений металлов платиновой группы. Пример гомогенного катализатора – комплекс Уилкинсона (работает при 20оС, 1 атм). Никель Ренея. Стереохимия гидрирования.
4. Понятие о нуклеофильных и электрофильных и реагентах.
5. Электрофильное присоединение к алкенам. Почему именно электрофилы, а не нуклеофилы легко присоединяются по неактивированной С=С связи? Объяснение “школьное” и с использованием метода МО. ВЗМО и НСМО этилена. Общее представление о механизме реакций, π- и σ-комплексы, ониевые ионы, скоростьопределяющая стадия. Стереоселективность процесса. AdE2 и AdE3 механизмы. Мостиковые и открытые ионы. Когда они бывают?
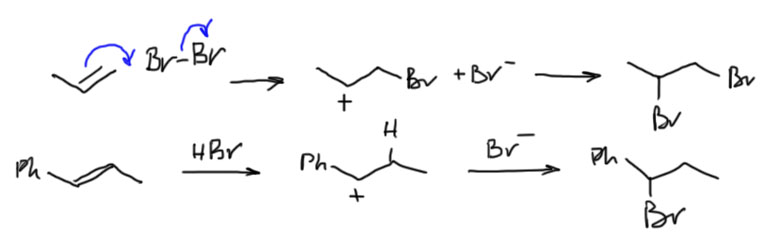
6. Присоединение хлора и брома к алкенам. Механизм, стереохимия, влияние заместителей на стереохимию присоединения (1-фенилпропен). Связь стереохимии присоединения с возможностью существования мостиковых ионов. Пример – присоединение брома к цис- и транс-бутенам-2. Образование мезо- формы (эритро-изомеров) и рацемата (трео-изомеры).
7. Гидрогалогенирование. Региоселективность электрофильного присоединения к алкенам. Правило Марковникова. Примеры. Поляризация исходной молекулы алкена. Стабильность интермедиата (карбокатиона). Влияние заместителей при С=С связи на скорость присоединения. Откуда электрофил “знает” куда ему идти – т.е. какой атом углерода атаковать? Пример применения постулата Хэммонда для стадии присоединения положительно-заряженного электрофила к двойной связи – стабильному катиону соответствует более выгодное переходное состояние. Примеры: присоединение галогеноводородов к стиролу, виниловым эфирам и винилхлориду.
8. Исключения из формальногоправила Марковникова (1)присоединение к электронодефицитным алкенам, (2) присоединение боранов, (3) радикальное присоединение. Различные формулировки правила Марковникова:
9. Электрофилы, отличные от протона. Почему RSCl даёт М+АМ?
10. Выводы по стерео- и региохимии электрофильного присоединения к алкенам. Образование циклических ониевых ионов при электрофильном присоединении к алкенам постулируется на основании кинетических и стереохимических исследований для случаев, когда электрофилом является Br+, Cl+, I+, AcOHg+, RSCl, RSeCl и т.п. В некоторых случаях удается наблюдать образование таких мостиковых ионов спектрально (в случае Br+, RS+, AcOHg+), что, однако, не является доказательством, что подобные “мостики” образуются всегда.
Можно вывести следующие закономерности AdE реакций, проходящих через мостиковые ониевые катионы или ациклические карбокатионы: Симметричный “мостик” → анти- присоединение, региоселективности нет. Несимметричный “мостик” → анти- присоединение, возможно появление син- продукта, региоселективность есть (правило Марковникова). Нет “мостика” (например, для протона) → региоселективность есть (правило Марковникова), стереоселективность есть для AdE3 (анти-), стереоселективности нет для AdE2 (смесь син- и анти-). Мостика может не быть и в том случае, когда возможно образование стабильного карбокатиона, например, в случае присоединения Br2 к 1-фенилпропену – стереоселективности нет, образуются син- и анти- аддукты.
12. Побочные реакции при электрофильном присоединении к алкенам: сопряжённое присоединение нуклеофила (например, образование бромгидринов при взаимодействии олефинов с бромом в водной среде), перегруппировки интермедиатов, карбениевых ионов (гидридные и алкильные сдвиги).
13. Кислотно-катализируемая гидратация алкенов. Условия и ограничения. Альтернативный непрямой метод гидратации – гидроксимеркурирование. Алкоксимеркурирование.
14. Регио- и стереоселективное присоединение гидридов бора (боранов). Региоспецифические гидроборирующие агенты (дисиамилборан, тексилборан, 9-ББН). Какие функциональные группы могут и не могут быть в молекуле алкена, которая подвергается гидроборированию? Превращение борорганических соединений в алканы, спирты, алкилгалогениды. Селективное введение дейтерия как демонстрация возможностей метода.
15. Озонолиз алкенов. Окислительное и восстановительное расщепление озонидов.
16. Окисление алкенов до диолов (гидроксилирование) по Вагнеру (перманганат калия, 1-2% раствор рН 7-8), Криге (тетраоксид осмия, затем NaHSO3, желательно также иметь представление о каталитическом варианте гидроксилирования OsO4 с использованием дешевых стехиометрических реокислителей, например, N-оксидов аминов или красной кровяной соли). Принципы и катализаторы стереоселективного гидроксилирования по Шарплесу. Гидроксилирование через гидролиз эпоксидов по Прилежаеву. Стереохимия гидроксилирования алкенов. Доказательства отдельных стадий син- и анти- гидроксилирования промежуточные продукты при син- и анти- гидроксилировании.
17. Свободнорадикальные реакции: История вопроса, присоединение бромистого водорода по Харашу, инициаторы реакции, механизм. Почему не присоединяются радикально HF, HI? Присоединение H2S, RSH к алкенам. Аллильное галогенирование: получение хлористого аллила из пропилена в газовой фазе, аллильное бромирование по Волю-Циглеру.
18. Молекулярные π-орбитали аллильной системы.
19. Карбены. Методы генерирования. Понятие о синглетных и триплетных карбенах, их строение, гибридизация, углы между связями, Стереохимия присоединения к алкенам. Карбеноиды. Реагент Симмонса-Смита.
20. Полимеризация алкенов (катионная, анионная, радикальная).
Двойная связь
Как устроена молекула этилена (название этилен, а не формальное этен, можно применять совершенно законно – ИЮПАК рекомендует оставить это привычное название, как и многие другие) поняли независимо друг от друга в начале 1930-х Эрих Хюккель и Лайнус Полинг, и именно эта молекула оказалась первой органической молекулой, к которой были применена новая квантовая теория строения молекул. Полинг одновременно придумал и гибридизацию, и тот способ, которым мы и сегодня обычно рисуем электронную структуру этилена.
Молекула этилена плоская и жесткая. Это радикально отличает ее от насыщенных углеводородов, например, от своего ближайшего родственника этана – этан и неплоский, и нежёсткий, вокруг C-C связи происходит практически свободное вращение (об этом подробнее в другом месте). Из того факта, что молекула плоская следует очень важный для химии вывод – у молекулы есть верх и низ, в том смысле что к плоскости можно подойти сверху или снизу (для этилена и большинства простых алкенов, с которыми мы и будем иметь дело, верх и низ это одно и то же, но у более сложных алкенов может быть разница между верхом и низом, этим активно пользуются в так называемом асимметрическом синтезе, но мы не будем – в нашем курсе этого нет).
Когда мы про молекулу говорим “плоская”, понятно, что молекула – всё равно штука трехмерная, а плоскостью молекулы называют только математическую абстракцию, проходящую через центры атомов; слово “плоская” в применении к молекуле означает только эту абстракцию, и то практическое следствие, что у молекулы есть те самые верх и низ, а не то, что на молекулу наехал асфальтоукладчик. Более того, когда мы проводим эту абстрактную плоскость, обычно пренебрегаем атомами водорода, в органической химии играющие роль заполнителя для неиспользованных на что-то более серьезное валентностей. В этом смысле и молекулы пропена, изобутилена (2-метилпропена), 2-бутенов вполне плоские, хотя в них полно атомов водорода, не находящихся в плоскости.
Более того, бывают реакции в которых к двойной связи подходят две молекулы (или части молекул) и тогда может быть две возможности – обе сверху, или одна сверху, другая снизу, и в таких случаях получаются разные молекулы, и эти молекулы по отношению друг к другу являются диастереомерами. Если в какой-то реакции такого типа получается преимущественно один из диастереомеров, реакцию называют диастереоселективной.
Еще одной важной особенностью этилена, отличающей ее от насыщенных углеводородов, является то, что валентные электроны находятся на двух разных и не взаимодействующих электронных системах: системе σ-связей в плоскости молекулы и π-системе.
Атомы углерода в молекуле этилена находятся в sp2-гибридном состоянии, что означает, что а) у атома углерода три непосредственно связанных с ним атома, в этом случае это два водорода и углерод; б) все четыре атома (их центры) лежат в одной плоскости и это та же плосковть, что и плоскость всей молекулы. Для связи в σ-системе используются не чистые атомные, а гибридные орбитали, которые, по Полингу, принято изображать восьмеркой с сильно неравными долями – большой, которая используется для перекрывания и образования связи, и маленькой, которая просто так торчит с другой стороны и ждет, не обратит ли на неё кто-нибудь внимания (увы, никому это и в голову не приходит). Гибридных орбиталей sp2-типа как раз три штуки (из одной s- и двух p-орбиталей получаются три гибридных одинаковых по форме орбитали).
По одной чистой p-орбитали (всего p-орбиталей три, а две из них использованы на sp2-гибридные орбитали) на каждом атоме углерода находятся как раз в пространстве над и под плоскостью, и плоскость является единственным местом, где их нет – это называется узловой плоскостью. В молекуле этилена узловая плоскость совпадает с плоскостью молекулы. Эти орбитали перекрываются, образуя связь, вне плоскости, тоже над и под. Такая связь называется π-связью, главным отличительным признаком которой является то, что перекрывание осуществляется строго вне линии связи – абстрактного геометрического отрезка, связывающего центры связанных атомов. Это очень точный критерий – поскольку эта линия лежит в узловой плоскости, там по определению нет и духа p-орбиталей. И отсюда ясно, что σ-связью называется как раз такая, у которой линия связи находится внутри орбиталей, обслуживающих эту связь. Отсюда понятно, почему используются эти названия – это просто греческие буквы, соответствующие латинским s и p в обозначении атомных орбиталей. Аналогия очевидная – у s-орбитали электронная плотность не равна нулю в центре атома, так же как в связевой σ-орбитали она не равна нулю на линии связи. А у p-орбитали электронная плотность строго равна нулю в центре атома, так же как в связевой π-орбитали она равна строго равна нулю на линии связи. Более серьезно можно было бы использовать орбитальное квантовое число, но это бы означало, что мы хотим вылезти из квантовой химии с весёлыми картинками и лёгким трёпом в настоящую квантовую механику с устрашающими уравнениями и принципиально полным отсутствием любого визуального воплощения. Нам там было бы страшно, а нам там были бы не рады – они вообще никому не рады, даже самим себе. Не пойдеммы туда. Нарисуем лучше весёлые картинки:
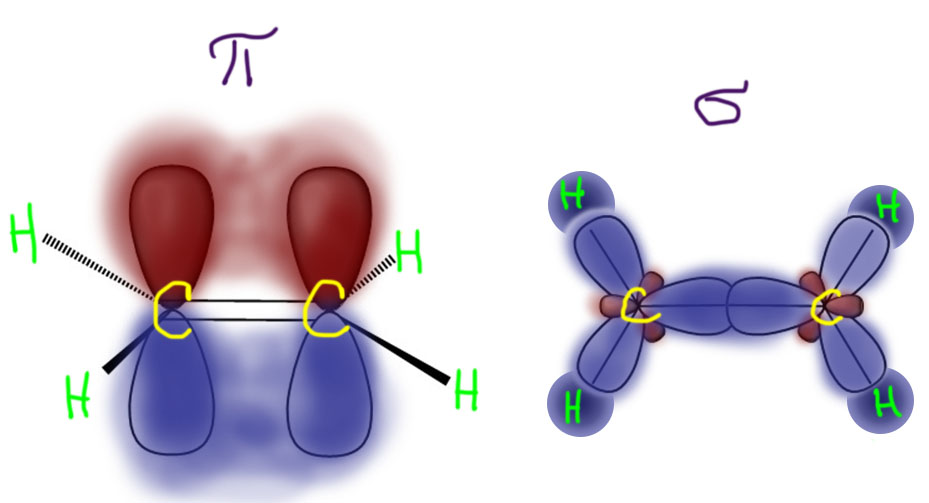
Итак, в молекуле этилена π- и σ-связи полностью разделены и не взаимодействуют, при этом π-связь гораздо более доступна для атаки разными реагентами.
Еще одно важное следствие, на которое часто не обращают внимания – CH-связи в этилене сильно отличаются от CH-связей в алканах.
Это связано с той же гибридизацией атома углерода, sp2 против sp3-в алканах. В sp2-орбиталях больше вклад s-орбитали углерода (совершенно формально этот вклад принимают равным 1/3 – в гибридной орбитали участвуют поровну три атомных, одна s и две p). В sp3-орбитали тогда вклад s-орбитали всего одна четвертая. Фокус в том, что s-электроны находятся в среднем ближе к ядру атома, чем p-электроны, они сильнее связаны, их сложнее оторвать, связи с их участием короче, а значит прочнее. Всё это относится и к гибридным орбиталям с большим вкладом s-электронов. Это не количественная, а качественная картина, в терминах больше-меньше. Но этого вполне достаточно именно для качественных тенденций. Связь, обслуживаемая sp2-гибридной орбиталью короче и прочнее, чем связь за счет sp3-орбитали. Только нужно всякий раз не забывать, что прочность связи играет первостепенную роль в свободнорадикальных реакциях – только в них связи именно рвутся пополам, и каждый атом остается со своими электронами. Прямое следствие этого – атомы водорода на двойных связях практически никогда не отрываются радикалами, нет у этилена такой химии. А у пропилена? У пропилена есть, но там используются атомы водорода на sp3-атомах углерода, и это другая проблема. Свободнорадикальные частицы охотно реагируют с этиленом, но только по π-связи в реакциях свободнорадикального присоединения.
Но CH-связь можно разорвать и по-другому, по другому пути – оставив электроны у более электроотрицательного атома углерода, иными словами, оторвав протон основанием. И здесь уже другие законы: важна не прочность связи, а относительная стабильность карбаниона. Вот от алканов протон оторвать в сколько-нибудь заметной степени невозможно, нет таких оснований на свете. А от этилена трудно, но можно. Это серьезная и важная проблема, и мы обсудим ее подробнее на отдельной странице.
Стабильность алкенов. Изомеризация.
Органическая химия (да и любая другая наука) любит основывать любые рассуждения на небольшом наборе коротких заявлений, имеющих статус постулатов или даже абсолютных истин. Большинство таких заявлений, на самом деле, основаны на безосновательном обобщении на все множество органических веществ и реакций некоторых наблюдений, сделанных для нескольких (одного-двух, но бывает даже целых 10-15!) простых веществ и реакций. Как ни странно, эта сомнительная практика действительно неплохо работает, если не требовать от нее слишком многого. Некоторым особо наивным и доверчивым людям кажется, что это настоящие законы Природы. Ничего подобного! Чтобы время от времени не садиться в лужу, полезно помнить о весьма нечетком, относительном характере таких заявлений, и понимать, как каждое из них получено. С первым таким обобщением – более реакционноспособные реагенты менее селективны и наоборот, – мы уже знакомы и вполне убедились, что некоторой, и то минимальной предсказательной силой это глубокомысленное высказывание обладает только по отношению к близкородственным реагентам с одинаковым механизмом действия.
Сегодня к органическому символу веры добавим второе и очень популярное заявление, кстати, гораздо более полезное чем сказка про реагенты:
Более замещенные олефины более устойчивы!
Учтите, что это всегда звучит только так, и не нужно заменять это на “менее замещенные олефины менее устойчивы” или тем более на “незамещенные олефины вовсе неустойчивы”. Или поймут, но неправильно. Некоторые могут даже понять буквально, тем более что последнее заявление, а незамещенный олефин это просто этилен, в буквальном смысле совершенно верно – этилен действительно формально неустойчив, потому что обладает положительной энтальпией образования, а следовательно просто мечтает превратиться в составляющие его элементы – водород и углерод. К счастью, он не знает, как это сделать, поэтому и не превращается, а то ведь мог бы.
Сразу возникает два вопроса: во-первых, что это вообще значит, и во-вторых, “более устойчивы” чем что?
Первую вещь нужно понять очень точно – речь не идет о любых олефинах, и более того, речь вообще не идет в общем об олефинах. Бесполезно сравнивать по устойчивости этилен и пропилен, или стирол и циклогексен, или акриловую кислоту и аллиловый спирт. Все эти соединения вполне устойчивы, в том практическом смысле, что их можно положить в банку и оставить на столе или в крайнем случае, в холодильнике, и ожидать увидеть их вновь в добром здравии и в том же или почти в том же состоянии, в котором их туда положили, по прошествии разумного времени. Строгие термодинамические функции энтальпии и энергии Гиббса образования для этих веществ совершенно различны и не показывают никаких осмысленных тенденций изменения, вернее, показывают, конечно, но такие, которые могут взволновать человека, занимающегося термодинамикой или еще какой-нибудь физхимией, – но не органика. Нам, органикам, это точно до лампочки. Органик редко имеет дело с молекулами как таковыми, нас почти всегда интересует взаимопревращения молекул, их реакции, сопоставление молекул по реакционной способности или относительной устойчивости.
Вместо этого речь идет об оценке энергии двойной связи, и даже не всей двойной связи, а только ее π-части. Впрочем, это очень важная оценка, так как реакций, в которых двойная связь рвется целиком немного, а в большинстве реакций происходит присоединение и простая связь C-C остается целой.
Проделаем (мысленно) следующий эксперимент. Берем два олефина, которые мы хотим сравнить. Гидрируем их по очереди в калориметре (приборе, позволяющем точно измерить тепловой эффект происходящей внутри реакции), измеряем тепловой эффект каждой реакции в расчете на моль вступившего в реакцию олефина. Полученные величины, даже если олефины разные, будут отличаться не очень сильно, в пределах нескольких килокалорий на моль.
Чем определяется эта разница. При гидрировании разрывается как раз π-часть двойной связи и образуются две связи C-H. Реакция гидрирования всегда экзотермична, то есть энергия образования двух C-H больше энергии разрыва π-части двойной связи. Чем эта двойная связь (ее π-часть) прочнее, тем экзотермичность гидрирования меньше, и тем труднее разорвать эту двойную связь – а олефин с более прочной двойной связью называют более устойчивым.
В нулевом приближении можно считать, что все C-H связи одинаковы (здесь вы конечно же сразу вспомните про различия в энергии C-H связей, ведь мы только что в алканах усердно мусолили эту проблему, но эти различия количественно не очень велики и в контексте гидрирования олефинов этим можно пренебречь). Все остальное в молекулах тоже можно считать неизменным, хотя и это не совсем правда – меняется хотя бы гибридизация этих двух углеродов, а следовательно и длины и энергии связей на них, меняется форма молекулы и всякие взаимодействия между частями молекул (стерическая часть энергии). Но мы договорились про самое грубое приближение, и в нем мы и останемся, и в этом приближении вполне разумна идея о том, что вся разница сидит только в разнице энергий π-частей связей. В этом приближении сравнение энергий гидрирования (не сами эти энергии, а только их разность!) и показывают относительные прочности этих связей.
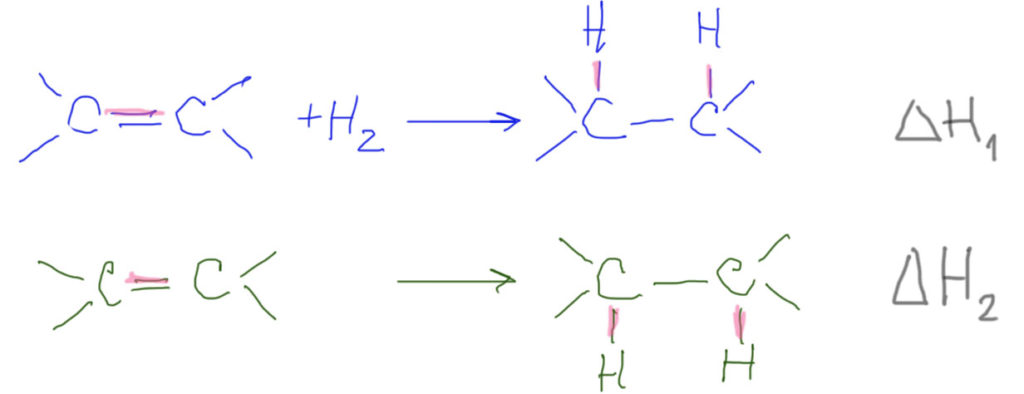
Общая тенденция получается такая – для простых алкенов (этилен, пропилен, бутилены) чем больше заместителей (метилов), тем стабильнее (прочнее) двойная связь.
Это экспериментальное наблюдение обычно объясняют с помощью той же самой гиперконъюгации, что и стабильность радикалов. Только здесь придется подумать серьезнее, что с чем сопрягается. Проблема в том, что просто так перенести схему для радикалов на олефин нельзя. Сопряжение π-орбиталей двойной связи с гибридной орбиталью C-H связи рядом выглядит точно так же, как и сопряжение орбитали неспаренного электрона с той же гибридной орбиталью в радикалах. Но – здесь на этой системе 4 электрона (два с одной связи, два с другой), а это, как мы уже однажды видели, приводит не к стабилизации, а к дестабилизации. Выходят из этой ситуации довольно просто – во взаимодействие вовлекают не обе связывающие, а связывающую и разрыхляющую орбитали тех же связей – тогда во взаимодействии 2 электрона (разрыхляющие орбитали пусты). Этот вид гиперконъюгации поэтому является σ-π* сопряжением. Ехидный и недоверчивый человек (эти качества совершенно необходимы любому, кто серьезно решит заниматься наукой, но одних их, увы, недостаточно) непременно спросит, а почему это мы в одном случае (стабилизация радикалов) выбираем σ-π-сопряжение, а в другом σ-π*? Что за произвол – что хотим, то и выбираем. Не совсем так, на самом деле, так как в каждом случае речь идет о балансе всех возможных взаимодействий, и стабилизирующих, и дестабилизирующих. Кто-то проделал эту кропотливую работу за нас, и выяснил, какие взаимодействия вносят наибольший вклад в каждом случае. А мы просто пользуемся результатами этих трудов, выдавая их за глубину собственного анализа. Итак, нарисуем орбитали фрагментов
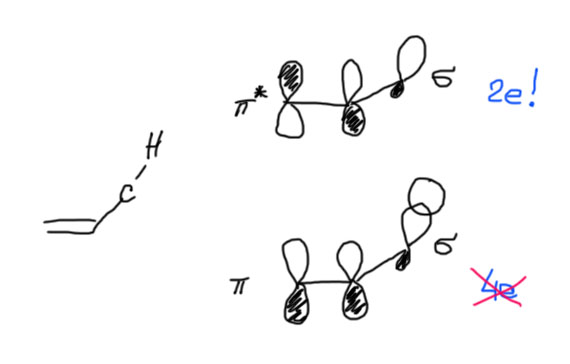
Как и в случае стабилизации алкильных радикалов, и здесь эффект гиперконъюгации невелик, но за неимением других вполне заметен.
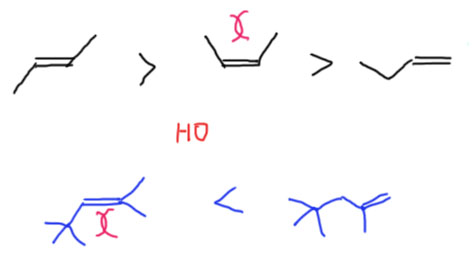 Сверху на этот эффект накладывается стерический эффект – если в олефине какие-то заместители на двойной связи сближены, то они отталкиваются, что приводит к дестабилизации. Это очень хорошо видно при сравнении цис- и транс-изомеров – первые всегда менее стабильны чем вторые. Если заместители довольно крупные, то дестабилизация цис-изомеров может быть настолько велика, что перекроет эффект гиперконъюгации. Второй пример показывает это – здесь трет-бутильная группа дестабилизирует более замещенный олефин, и более стабильным оказывается менее замещенный олефин. Обратите внимание на смешной значок, похожий на букашку, – так принято обозначать стерическое отталкивание.
Сверху на этот эффект накладывается стерический эффект – если в олефине какие-то заместители на двойной связи сближены, то они отталкиваются, что приводит к дестабилизации. Это очень хорошо видно при сравнении цис- и транс-изомеров – первые всегда менее стабильны чем вторые. Если заместители довольно крупные, то дестабилизация цис-изомеров может быть настолько велика, что перекроет эффект гиперконъюгации. Второй пример показывает это – здесь трет-бутильная группа дестабилизирует более замещенный олефин, и более стабильным оказывается менее замещенный олефин. Обратите внимание на смешной значок, похожий на букашку, – так принято обозначать стерическое отталкивание.
Все это имеет вполне конкретное количественное измерение. Стабилизация более замещенного алкена на самом деле очень мала. Например, преимущество транс-2-бутена над 1-бутеном в энтальпии образования всего 2.8 ккал/моль (при комнатной температуре, термохимические данные из D.M.Golden, S.W.Benson Chem. Rev. 1969, 69, 125-134). Эта вполне жалкая цифра вряд ли может удивлять – что вы хотите от такого слабого эффекта, как гиперконъюгация. Да, повторяю это еще раз, гиперконъюгация несмотря на обманчивою приставку “гипер” – довольно слабый эффект, который можно заметить только когда сравнивают очень похожие молекулы. Более того, если сравнивать не энтальпии, а свободные энергии образования, в которые входит еще и энтропийный вклад, то мы увидим еще меньшее число, меньшее 2 ккал/моль, и это тоже не удивительно, ведь с энтропийной точки зрения 1-бутен лучше чем 2-бутен, потому что это более гибкая, менее упорядоченная молекула – при переходе от 1-бутена к 2-бутену энтропия уменьшается, а это плохо, хотя в этом случае энергетическая выгода перевешивает энтропийную невыгоду.
C другой стороны разница в энергии между транс-2-бутеном и цис-2-бутеном чуть больше 1 ккал/моль (в этом случае на энтропийный вклад можно не смотреть, он очень мал) – вот и вся разница! Понтяно, что в таком случае сравнение 1-бутена и цис-2-бутена даст совсем незначительную величину, и сравнение будет бессмысленным.
Это довольно важный вывод – когда мы говорим о том, что более замещенные олефины более устойчивы, чем менее замещенные, нужно помнить, что это, во-первых, касается только транс-изомеров, и, во-вторых, хорошо работает для двойных связей с одним-двумя заместителями, а для три и тетразамещенных алкенов нужно смотреть конкретные молекулы, находить их термохимические характеристики, и не удивляться, что все может быть с точностью до наоборот.
Теперь самое главное – зачем нужно знать про “стабильность олефинов”. Ответ такой – в большинстве случаев совершенно незачем. Нет никакой радости в том, что двойная связь в циклогексене (дизамещенном олефине) стабильнее связи в этилене. Как мы уже, надеюсь, поняли, тем более совершенно ни из чего не следует, что циклогексен стабильнее этилена – более того, это не имеет смысла. Когда разберетесь в термодинамике, поймете почему. Но информация о стабильности становится очень важной, когда сравнивают изомерные алкены с разным положением двойной связи относительно заместителей, но с сохранением скелета (изомеры положения). Тогда все остальное в молекуле одинаково (как всегда в некотором приближении), и вся разница кроется только в двойной связи. В этом случае можно в прямом смысле говорить о стабильности алкенов. А стабильность прямо связана с равновесием. Если существует реакция, в которой один изомер превращается в другой, то такая реакция обратима, и положение равновесия смещено в сторону более стабильного алкена (то есть, в большинстве случаев более замещенного). Такие реакции действительно существуют, и называются равновесиями изомеризации. Изомеризация алкенов, например, часто вызывается небольшим количеством молекулярного иода. Очень важно не забывать, что в равновесных условиях изомеризация всегда превращает менее стабильный изомер в более стабильный. Степень превращения редко бывает стопроцентной, или даже хотя бы >90%, чаще получается смесь с преобладанием более стабильного изомера. Для того, чтобы это оценить точно, нужно знать константы равновесия в каждом случае. В принципе, эта информация вполне доступна, если разобраться в термодинамике и в том, откуда берутся значения термодинамических функций для разных веществ. Мы этого делать не будем, поэтому и не имеем права использовать простую равновесную изомеризацию для превращения одного изомера в другой, если это, например, понадобится в какой-нибудь задаче. Есть более надежные неравновесные способы изомеризации, более того, раз они неравновесные, то могут работать в обе стороны. Мы обязательно изучим такие реакции.
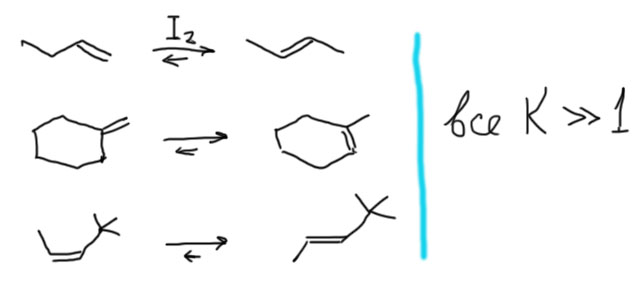
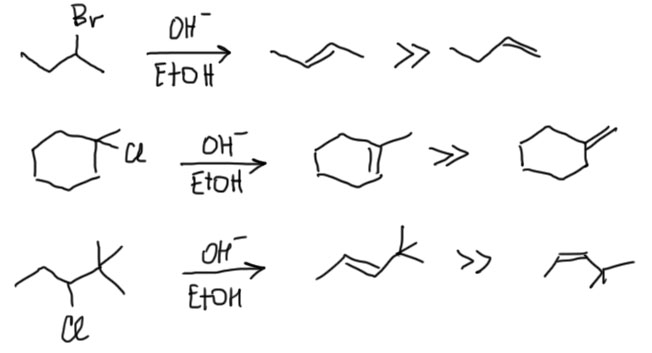
Второе важное применение знания об относительной стабильности изомерных алкенов – предсказание того, какой олефин образуется в реакциях отщепления (элиминирования), например, отщепления галогеноводородов от галогенпроизводных, или воды от спиртов. Подробнее мы это рассмотрим позже, но сейчас отметим, что в большинстве случаев образуется как раз наиболее устойчивый олефин из возможных. Эта важная закономерность называется правилом Зайцева. В отличие от равновесной изомеризации этим можно и нужно пользоваться.
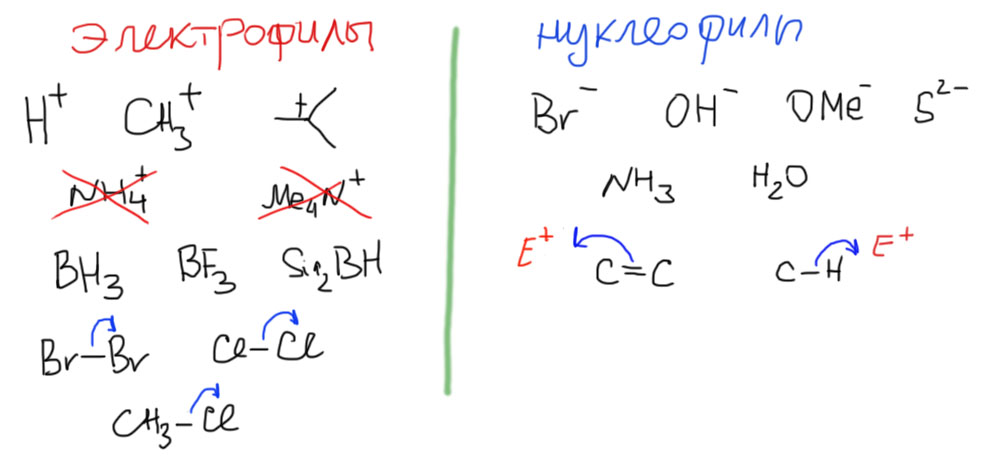
Что такое электрофилы и нуклеофилы?
Множество реакций в органической химии – это реакции между электрофилами и нуклеофилами. В реакциях образуются ковалентные связи, и пара электронов на их образование может быть дана либо поровну каждым из реагентов – это свободнорадикальные реакции; либо пара от одного реагента и пустая орбиталь от другого – это как раз и есть электрофильно-нуклеофильные реакции. Знатоки неорганической и координационной химии немедленно воскликнут – да так же образуется координационная связь, а реагенты, которые ее образуют называются кислоты и основания Льюиса!!! – Зачем новые слова и понятия?!
Можно и так посмотреть, но на самом деле, понятия электрофилов и нуклеофилов не сводятся к кислотам и основаниям Льюиса – они шире и удобнее. Итак, как образуется ковалентная связь? Самый простой случай вполне похож на координационную связь из неорганики: катион плюс анион. Катион – электрофил, анион – нуклеофил. Катион при этом должен быть секстетным (посмотрите еще раз вводный концентр, если забыли, что это такое), октетные (они же ониевые) катионы не являются электрофилами. Электрофилом является и самый маленький катион – протон, у которого вообще 0 (прописью – ноль) валентных электронов. Вообще, в этом месте можно было бы серьезно испугаться – как это ноль? – как же он вообще существует такой? А протон из таблицы субатомных частиц в учебнике физики и химический протон это одно и то же? Формальный ответ да, и если бы мы занимались реакциями в газовой фазе, мы могди бы столкнуться с настоящим протоном, и понять, что это действительно нечто страшное и загадочное. К счастью, мы почти не касаемся реакций в газовой фазе, а работает только в так называемых конденсированных фазах, в основном в жидкости (в растворах), но иногда в ситуации, когда жидкость (раствор) соприкасается с твердой поверхностью. И в таких системах протон никогда не бывает свободным – он только передается от одной молекулы к другой, от кислоты Бренстеда-Лоури к основанию. И обратно. Из этого следует один практический вывод – кислота Бренстеда-Лоури это всегда электрофил, а основание – нуклеофил.
Дальше, как это принято в серьезных науках, начинаем дальше обобщать и дообобщаемся до того, чтобы сказать: Электрофил не обязательно должен иметь положительный заряд, – он может быть нейтральной молекулой с вакантной орбиталью на каком-нибудь атоме. Боран, например, электрофил. Бор, элемент третьей группы, имеет всего шесть валентных электронов и в молекулах типа BH3 или BF3 атом бора электрофилен (и является кислотой Льюиса).
Обобщаем дальше, это самое сложное. Оказывается, даже не обязательно иметь такую орбиталь, но можно иметь возможность ее образовать прямо в процессе реакции. Бром или хлор, например, электрофилы, потому что в реакции могут развалится на две части, отдав пару одной половинке. Мы уже видели как они разваливаются ровно пополам в свободнорадикальной химии, но распад может быть и гетеролитическим. Это выгодно тогда, когда эта уходящая половинка радуется приобретенной электронной паре, то есть является элементом с высокой электроотрицательностью или его производным. Такая часть молекулы называется уходящей группой. Фокус здесь в том, что если уходящая группа уйдет до следующей реакции, мы получим обычный электрофил. Но это происходит далеко не всегда, потому что это часто очень невыгодно энергетически. Далеко не все молекулы, формально способные к гетеролитическому распаду на ионы, фактически могут это сделать. Мы увидим много таких примеров.
Нуклеофил не обязательно анион, но может быть и просто молекулой, имеющей атом(ы) с неподеленной парой. Аммиак или вода, например, нуклеофилы. Не обязательно даже неподеленной парой, но можно и кратной связью – обслуживающие ее пару электронов амбициозный электрофил может вытянуть целиком. Алкены поэтому тоже нуклеофилы. Некоторые, особенно крутые электрофилы могут вытягивать пару не только с кратной, но даже и с простой связи, обычно C-H. Это редкий случай, но мы его знаем. Метан и другие алканы – тоже нуклеофилы.
 Теперь, когда мы успешно разделили все реагенты на две большие кучи, затвердим еще один важный (важнейший!) лозунг органической химии. Он состоит из трех частей – одного разрешения и двух запретов:
Теперь, когда мы успешно разделили все реагенты на две большие кучи, затвердим еще один важный (важнейший!) лозунг органической химии. Он состоит из трех частей – одного разрешения и двух запретов:
Электрофилы реагируют с нуклеофилами
Электрофилы не реагируют с электрофилами
Нуклеофилы не реагируют с нуклеофилами
Пожалуйста, пропитайтесь этим как следует. Неумение отделять нуклеофилы от электрофилов и попытки устроить реакцию между реагентами одного типа – один из важнейших источников глупейших и заведомо неисправимых ошибок в химии. В таких случаях даже спорить не с чем. Реакции всегда бывают только между реагентами разных типов. Это очень похоже на другие священные пары в химии – кислота/основание, окислитель/восстановитель. Поэтому если вы анализируете какую-то реакцию, и точно знаете, что она идет, но вам кажется, что оба реагента принадлежат к одному типу (оба электрофилы, например), то это значит, что один из реагентов в данной реакции выступает в роли нуклеофила, и вам нужно понять какой и почему. По аналогии с парой окислитель-восстановитель мы отлично знаем такие ситуации: вроде бы реагируют и оба окислители, и мы тогда точно знаем, что один из реагентов в данном случае восстановитель. Совершенно школьный пример – реакция перекиси водорода и перманганата калия: оба реагента классические и бесспорные окислители и поэтому не должны были бы реагировать, но они реагируют, как известно уже из средней школы, и тогда приходится признать, что перекись водорода в этой реакции работает как восстановитель, и в соответствии с этим балансировать реакцию и писать ее продукты. В мире электрофильно-нуклеофильных реакций такие фокусы чрезвычайно редки, я даже прямо сейчас не смогу привести ни одного примера, но совсем исключить этой ситуации нельзя, так что будьте бдительны. Выработайте привычку в любой реакции электрофильно-нуклеофильного типа, а таких реакций в органической химии большинство почти подавляющее, в уме или на бумаге определять тип для каждого реагента и проверять, чтобы в реагирующей паре был и электрофил и нуклеофил.
И еще одна важная вещь. В реакциях электрофилов и нуклеофилов обычно (то есть почти всегда) образуются заряженные частицы, катионы и анионы. Гетеролитический распад связей с полным смещением пары на один центр, всегда происходящий в таких реакциях, гораздо сложнее чем гомолитический, с которым мы вроде бы уже лихо разобрались. Это связано с тем, что заряженные частицы очень сильно взаимодействуют как друг с другом, так и с другими веществами, прежде всего с растворителями, и пренебречь этими взаимодействиями нельзя даже в самом грубом приближении. Здесь уже не обойтись простыми энергиями связей, а придется думать еще и о других ионах и о растворителях. Мы пока вообще не умеем это делать, и научимся только в самых общих чертах.
Электрофильное присоединение к алкенам: краткий курс
В самом общем виде механизм формулируется так. Он двухстадийный, первая стадия – присоединение электрофила к двойной связи с образованием карбокатиона или мостикового иона. Пока отложим в сторону мостиковый ион, потому что в первом приближении проще обходиться без него. Присоединение почти всех электрофилов кроме гидридов бора (гидроборирования) можно рассмотреть в самом общем виде через карбокатион.
Это даже удобнее почти во всех отношениях, потому что получается одна общая схема для всех реакций, а когда мы тянем мостиковые ионы, эта схема разрушается и концы с концами сводятся только с помощью не очень приличных манипуляций с данными. Поэтому в этой вкладке я сведу все реакции к одной схеме, и это позволяет решать практически все задачи, всплывающие в этой теме кроме стереохимических. Но это не очень большое упущение, потому что в анализе стереохимии мы не используем механизм, а просто сводим все реакции к одному стереохимическому шаблону. Практическая стереохимия присоединения разобрана на странице про методы.
Тем не менее для желающих поподробнее разобраться ниже будет отдельный блок, где будут разобраны важнейшие реакции и механизмы гораздо подробнее, и где мы найдем, как коррекстно совместить карбокатионный механизм и механизм с участием мостиковых ионов, которые не выдуманы, а хорошо и убедительно доказаны, только картина там немного сложнее, чем это принято рисовать.
Итак, присоединяем некий обобщенный электрофил, для простоты представив его положительным ионом E+. Еще нам нужен какой-нибудь нуклеофил, и его мы для простоты представим ионом Y–.
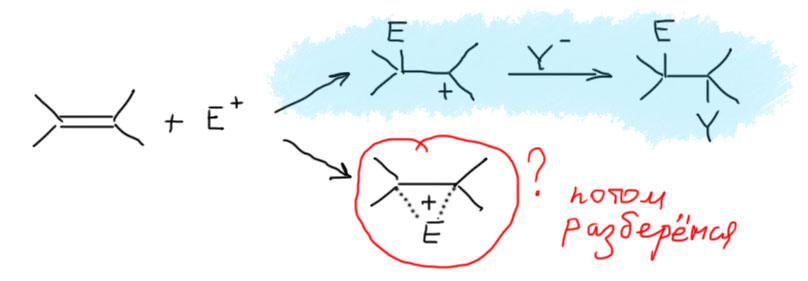
Механизм двухстадийный
- на первой стадии электрофил присоединяется к двойной связи с образованием карбокатиона. Это медленная стадия, определяющая скорость всей реакции присоединения. Именно на этой стадии определяется почти все:
- скорость реакции, реакционная способность алкена (кто быстрее, кто медленнее) – субстратная селективность,
- место присоединения электрофила, если алкен несимметричный – региоселективность,
- побочные реакции (перегруппировки карбокатиона).
- на второй стадии карбокатион присоединяет нуклеофил. Это быстрая стадия, не влияющая на скорость присоединения. На этой стадии тоже кое-что определяется, а именно:
- какой нуклеофил присоединяется, если в реакции их несколько – это тоже селективность, без особого названия.
- стереохимия присоединения – стереоселективность, точнее диастереоселективность – анти, син, или реакция неселективна.
Карбокатион – тоже электрофил, и очень реакционноспособный, он немедленно реагирует с первым попавшимся нуклеофилом. Это важно – какой попадется, с тем и прореагирует. Карбокатион не выбирает, с каким нуклофилом реагировать. Если их в системе несколько, то прореагирует со всеми и приблизительно в тех же соотношениях, в которых нуклеофилы присутствуют в реакционной смеси.
Первая стадия определяет, к какому из двух углеродов присоединится электрофил. Критерий – устойчивость карбокатиона. Нужно посмотреть все электронные эффекты. В вводном концентре мы это делали вполне успешно. Всегда нужно выписать оба катиона и посмотреть эффекты. Здесь часто возникает некоторая неопределенность потому что в карбокатионе будет или будут те заметители, которые были в исходном алкене и еще один новый, образовавшийся из самого электрофила и атомв углерода, к которому он присоединился – а какой эффект у этого нового куска. Вообще-то это легко прикинуть в конкретных случаях, когда известно, что является электрофилом. Большинство электрофилов – производные электроотрицательных неметаллов (галогенов, кислорода, серы, азота), поэтому этот кусок с гарантией будет индуктивным акцептором, довольно слабым, потому что собственно акцептор отделен от места приложения эффекта 9карбокатиона) атомом углерода, который, как мы выяснили, смягчает индуктивный эффект, но не изменяет его знак. Обычно этим можно даже и пренебречь – в этой части молекулы редко бывают определяющие эффекты, к тому же такой заместитель с гарантией будет у обоих изомерных карбокатионов. А вот второй заместитель как раз обычно и является определяющим. Собственно вариантов всего два – если там индуктивный, а еще лучше мезомерный донор, то там и будет карбокатион. Если -I/-M-акцептор, то он будет дестабилизировать, и катион наоборот быдет стремиться убраться подальше от такого подарка.
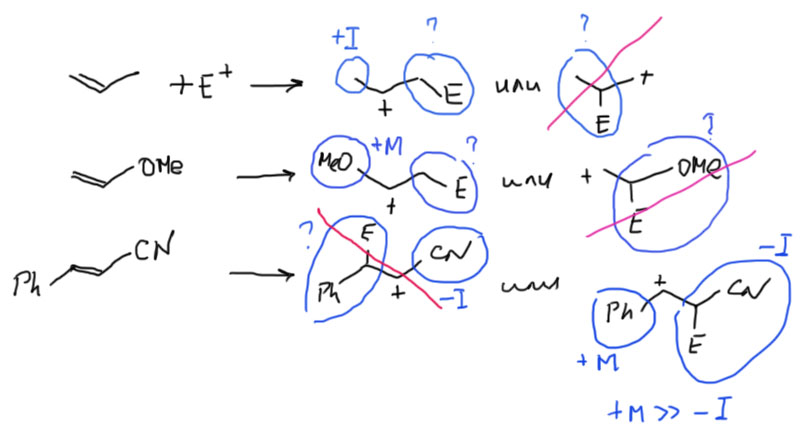
Разобрались с катионом, переходим к второй стадии и ищем нуклеофил, который заткнет карбокатионный центр. Так как мы договорились, что катион нуклеофил не выбирает, выбираем мы из всех нуклеофильных частиц, которые мы находим в системе. Варианты здесь такие.
1 Нуклеофил пришел вместе с электрофилом, и в системе больше ничего нет. Тогда они по очереди садятся, куда положено, и все просто. Заодно посмотрите как рисуются стрелки смещения электронной плотности в сокращенной записи механизма – мы показываем, какие связи рвутся и какие образуются, при этом направление стрелок всегда от нуклеофильной части к электрофильной.
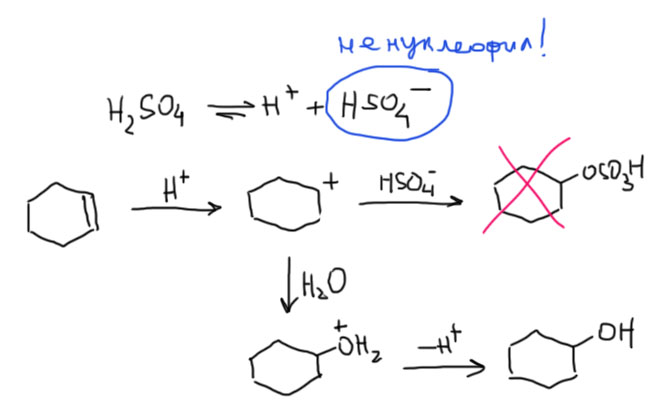
2 Второй важный случай. С электрофилом не пришел нуклеофил. Как это???! А очень просто. Возьмем сильную кислоту. Если это соляная или бромистоводородная, то в них есть нормальный нуклеофил – галогенид. А если серная? Анионы сильных кислородных кислот не являются нуклеофилами (точнее, являются, но такими слабыми, что на это можно не обращать внимания – в реальности это не совсем так, о чем можно прочитать в подробной части на вкладке про гидратацию олефинов). Тогда мы смотрим повнимательнее и находим воду – вода есть даже в концентрированной серной кислоте, а в реакции используют даже немного разбавленную. Затыкаем карбокатион водой, и обращаем внимание, что от первоначального продукта этой реакции нужно для порядка отобрать протон. Это происходит само собой, но иногда требует подщелачивания при обработке реакционной смеси Для этого используют питьевую соду. В схемах реакций допустимо просто писать -H+. Внимание: это плохая реакция, которой не нужно пользоваться для решения задач на синтез. Основная причина этого – низкие выходы спиртов, перегруппировки и другие побочные реакции карбокатионов. При желании можете почитать об этом в подробной части.
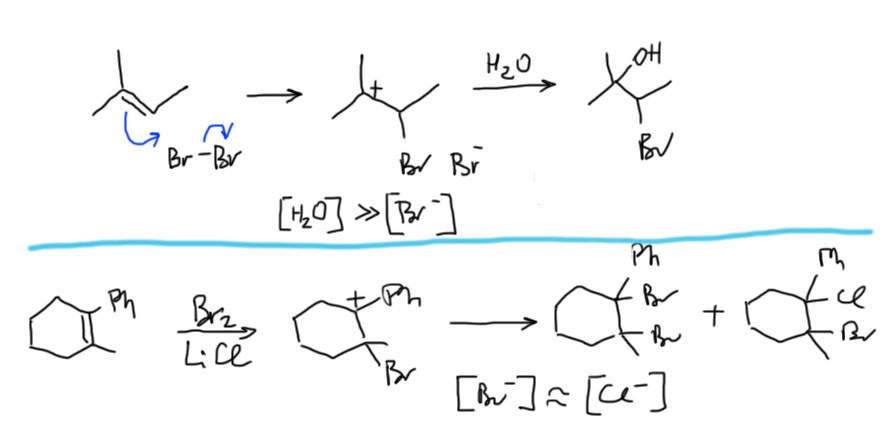
3 Третий вариант. Нуклеофил таки пришел с электрофилом, но в реакционной смеси есть еще что-то, например, вода. Очень распространенный случай – используют бромную воду (раствор брома в воде). В таком растворе брома мало, а воды много, поэтому карбокатион будет связывать воду, а не бромид (которого мало потому что брома мало). А могут и специально что-нибудь добавить, например, к галогену галогенид, только другой. Тогда получим или только продукт с посторонним нуклеофилом (если его намного больше), либо смесь, если взяли сравнимые количества. Важно внимательно следить за тем, что куда присоединяется, не забывая об стойчивости промежуточного карбокатиона.
4 Четвертый вариант. Нуклеофил обнаружился в молекуле олефина. Так как мы договорились, что олефином называют все, что угодно, если где-то в молекуле есть двойная связь. А еще там может оказаться, например, спиртовая группа. Возьмем хотя бы пент-4-ен-1-ол и присоединим к нему бром. Сначала образуется, как и положено, карбокатион, и будет искать себе нуклеофил. Нуклеофил есть в самой молекуле. Но, казалось бы, в этот раз у него нет никакого преимущества в концентрации. Мы точно можем сказать, что концентрация бромида просто точно равна “концентрации” гидроксила – на каждый образующийся карбокатион в системе есть один бромид и один гидроксил. Тогда, наверное, как мы уже привыкли, карбокатион будет поровну связывать один и другой. Но нет, в этот раз у гидроксила есть огромное преимущество – он в той же молекуле, рядом. Только очень важно понять, что значит “рядом”. По стереохимическим причинам “рядом” означает, что между двумя центрами (в данном случае между карбокатионом и кислородом с неподеленной парой) расстояние равно пяти или шести атомам, включая центры. Тогда внутренний нуклеофил затыкает карбокатион с образованием 5- или 6-членного цикла. В данном случае цикл 5-членный, и это хорошо. На схеме красненьким подсвечен образующийся цикл, и показано, как образуется продукт.
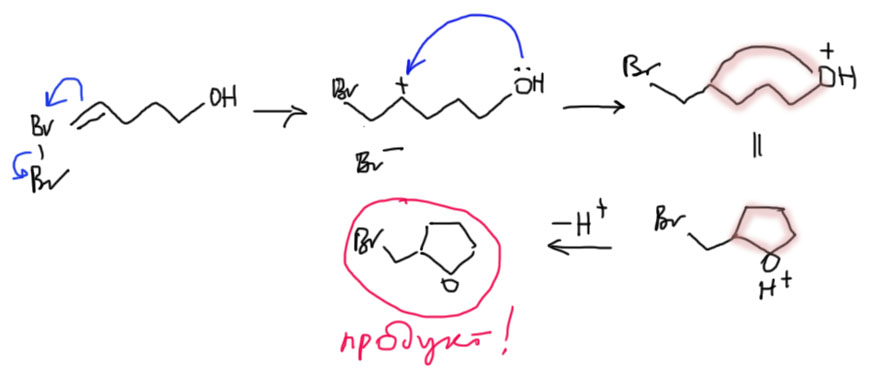
Такая реакция называется внутримолекулярной. Запомним – внутримолекулярная реакция имеет огромное преимущество перед реакциями между двумя разными молекулами (межмолекулярными реакциями), если в ней может образоваться 5-и или 6-тичленный цикл. В остальных случаях преобладают межмолекулярные реакции.
Электрофильное присоединение к олефинам: проблемы
Простая картинка электрофильного присоединения к олефинам неплохо описывает многие аспекты этой реакции. Ей вполне можно пользоваться, по крайней мере, в учебных целях, и решать почти все задачи, которые в связи с этой темой возникают. На этом вполне можно остановиться.
Но более внимательный подход к этой теме показывает, насколько эта простая картинка далека от реальности. Даже наша программа поднимает как минимум еще несколько вопросов –
- что такое AdE2 и AdE3 механизмы?
- что такое мостиковые ионы и зачем они нужны?
Если же мы попробуем оторваться от учебников и загдянуть в реальную научную и препаративную литературу, мы найдем немало сюрпризов. Один из них – почему так редко в реальных синтезах используются реакции присоединения галогеноводородов? Ну хорошо, про гидратацию нам уже наговорили много гадостей, но уже присоединение HBr-то точно должно быть самой простой из всех возможных реакций. Разве не она использована Марковниковым для открытия своего великого правила, которое уже 150 лет с нами, а мы с ним. Если кому-то кажется, что 150 лет это немного, хотя бы по сравнению с завоеваниями Г. Юлия Цезаря, спешу напомнить, что всей органической химии как науке и есть приблизительно столько лет, ну лет 20-30 можно еще накинуть, и то с трудом. И, да, то есть нет, не использовал Марковников присоединение HBr для правила. Судьба Владимира хранила. Если бы случайно использовал, правило могло бы или совсем не сформулироваться, или быть строго противоположным. Если не верите, посмотрите хорошо известный сборник методик Препаративную Органическую Химию Титце и Айхера, методика Б-2 (стр.65) – синтез 1-бромгептана присоединением HBr к 1-гептену. Никаких перекисей! Условия реакции как нарочно такие, чтобы максимально исключить даже подозрение на свободнорадикальную реакцию – в темноте, атмосфере азота, на холоду.
Это ошибка? Галлюцинация?! Ущипните меня! Сгинь, наваждение!! Ничего подобного, это вполне надежный и проверенный источник методик, и эта реакция с разными простыми 1-алкенами и именно с таким результатом многократно описана в оригинальной научной литературе. Да и в описании методики авторы сетуют на то, что должно бы присоединяться по правилу Марковникова, – а присоединяется наоборот. И ничего с этим не поделать. Эксперимент важнее любых теорий и интерпретаций. Тогда что это? Сенсация?! Правило Марковникова опровергнуто!? Опять ничего подобного. Правило Марковникова на месте. Его вообще невозможно опровергнуть, – оно всесильно, потому что верно, и верно, потому что всесильно, о чем подробнее на отдельной вкладке. А вот с самим гидробромированием действительно есть проблема, которая заслуживает обсуждения.
Далее, что такое мостиковые ионы и зачем они нужны. Нас уверяют, что без них невозможно объяснить анти-присоединение брома и других электрофилов с галогенами или серой к двойной связи. Это не так. Галогеноводороды (опять они!) очень часто также присоединяются анти-способом. Но уж здесь-то мостиковые ионы точно ни при чём. Протон чисто умозрительно мог бы образовать мостиковый ион, но, во-первых, он этого не делает (подробнее почему не делает можно прочитать на вкладке про гидрогалогенирование), а во-вторых, если бы делал, то протон настолько мал, что какое-либо стерическое препятствие создать не может. Значит может быть и другое объяснение анти-присоединению. А если оно есть здесь, то зачем нам мостиковые ионы в бромировании? Ответ простой – они в нем есть, их существование доказано, и не один раз, а пренебрегать существенной научной информацией неприлично. Хорошо, пусть будут. Но они же тащат за собой не только хорошее объяснение анти-стереохимии, но и новую проблему – если они выглядят так, как это обычно и рисуют в учебниках, то почему они присоединяют нуклеофил так, как будто вместо мостикового иона там обычный карбокатион, как у нас и написано в кратком курсе электрофильного присоединения. А почему бы им так и не делать? А потому что бромониевый (или хлоронивый, или иодониевый, или сульфониевый и т.п.) ионы по структуре должны быть аналогичны оксиранам – все это трехчленные гетероциклы с одним гетероатомом. Но оксираны раскрываются нуклеофилами по законам SN2-замещения (это мы все очень скоро будем разбирать), то есть с атакой на менее, а не на более замещенный атом углерода, то есть против правила Марковникова. Но бромониевые ионы почему-то ведут себя не так – нуклеофил раскрывает их по более замещенному атому.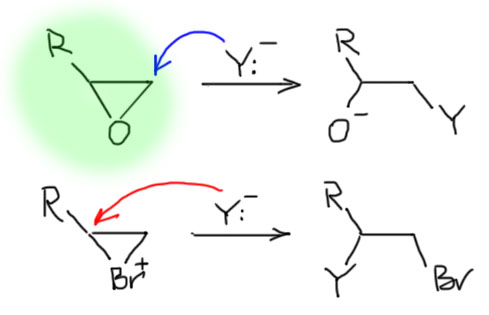
В чем дело? Разберёмся. Это весьма интересная проблема, которая неожиданно стала источником многих интересных результатов в совсем современной органической химии. Так далеко нам лезть не положено, но в основных вещах разобраться стоит хотя бы для того, чтобы один раздел органической химии не противоречил другому.
Двойная связь: гибридизация
Еще раз посмотрим на картинку π- и σ-связей в этилене.
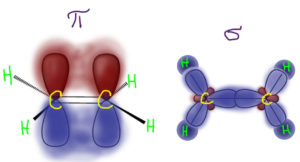
И зададим простой и наивный вопрос: А что это вообще такое? Это электронная структура этилена? Нет?? А что это тогда?
А это просто картинка, показывающая, как в принципе могли бы быть устроены химические связи в этилене. Есть такое замечательное понятие – валентные возможности. Это понятие строго не определено и довольно сильно попахивает замшелой стариной, но оно очень полезно. Смысл его в том, что в химии есть представления о том, каким образом атомы элементов образовывают химические связи с другими атомами. После работ Полинга и других классиков квантовой химии сформировался вполне разумный и простой подход к тому, как это сделать. У атомов каждого элемента есть набор валентных состояний, обычно очень небольшой. Откуда берутся эти состояния в голове Полинга и его последователей? Из двух источников:
- анализа структуры большого количества реальных соединений этого элемента, который всегда дает одно и то же – сколько бы ни было взято соединений для этого анализа и как бы ни были разнообразны их структуры, атомы рассматриваемого элемента всегда встроены в несколько легко узнаваемых типичных фрагментов, различающихся по числу близких атомов и их расположению в пространстве. У углерода, например, таких типичных фрагментов три – четыре атома в вершинах тетраэдра, три атома в вершинах треугольника, два атома на одной линии с углеродом.
- представления о числе валентных электронов и атомных орбиталях. У того же углерода до 8 валентных электронов (в соединениях – не в изолированном атоме!), одна s- и три p-орбитали.
Чтобы объяснить, как из суммарно четырех s- и p-орбиталей получаются эти структурные типы фрагментов Лайнус Полинг как раз и придумал гибридные орбитали, чтобы объяснить, отчего рельные связи с соседями направлены в пространстве не так, как p-орбитали (между p-орбиталями углы 90º, а между атомами либо 180º, либо 120º, либо 109º). Нужно понимать, что гибридные орбитали Полинг именно придумал – это гениальное по простоте и эффективности решение, взятое целиком из головы (Полинга). Гениальность этой идеи не только в том, что она очень удобна, но и в том, что она невероятно проста. И это невозможно переоценить. Квантовая теория тогда только-только появилась, и ее пригодность для повседневных нужд обычных практикующих химиков, работающих с веществом, а не с формулами и уравнениями, была не просто не очевидна, но скорее даже сомнительна. Классические химики тех времен отнеслись к новой теории равнодушно, скептически и даже брезгливо. Что было делать с этими заумными нерешаемыми уравнениями было совсем непонятно. Вообще нормальным химикам просто претит сами главные принципы квантовой теории, которая имеет дело с вещами, которые невозможно наблюдать непосредственно, глазами – вместо этого необходимо научиться мыслить исключительно с помощью совершенно абстрактных математических понятий, к тому же сильно выходящих за рамки обычного университетского курса высшей математики. Это был совершенно беспросветный тупик, и энтузиазм отцов квантовой науки, уверявших, что не пройдет и 10 лет, как они объяснят с помощью новой науки все на свете, и все остальные науки, начиная с химии и биологии, либо отомрут за ненадобностью, либо просто превратятся в упражнения квантовой науки, воспринимался как навязчивый бред опасных сумасшедших. Отцы, прямо сказать, в любом случае промазали – скоро будем отмечать череду столетий великих открытий квантовой физики, а все остальные науки не только не отмерли, а цветут и пахнут, все сильнее и сильнее. Но и квантовая наука тоже оказалась небесполезна, но чтобы это понять потребовались незаурядные усилия.
Так вот, способность упрощать сложное до уровня среднего ума, оставаясь при этом в рамках корректности – совершенно потрясающее качество для ученого.
объясняющая, почему молекула плоская, а каждый из атомов углерода имеет три соседа, расположенных мерседесной звездой с углами мезду связями в 120º. Для этого и было введено понятие гибридизации и гибридных орбиталей. Всё замечательно и наглядно, но это просто картинка. Химия всё же наука из семейства естественных, а в этих науках главным считаются не красивые картинки, а эксперимент, возможность измерения и наблюдения. И если мы утверждаем, что у нас есть теория, на основании которой мы нарисовали эти картинки, то возникает вопрос, можем ли мы из этой теории получить и что-то измеряемое, например, энергию образования молекулы (а еще лучше термодинамические функции вещества, составленного из этих молекул), и еще что-нибудь полезное – трудно даже представить себе, сколько всяких разных свойств и характеристик можно намерить даже для такой простой молекулы и вещества.
пока не возникает потребность применить уравнения квантовой химии для настоящего расчета
Для желающих разобраться подробнее и в некоторых спорных вещах предназначен следующий раздел. Всё это строго факультативно и только для самых любознательных и для тех, кто ответственно относится к знаниям. Избыточной информации нужно обязательно найти достойное место на своём чердаке, иначе получается бесполезная каша. Никогда не забивайте голову лишними сведениями, если не чувствуете непреодолимой потребности в них! Лучше меньше, да лучше. Это последняя мысль одного печально знаменитого деятеля, и единственная разумная мысль в его ужасающем наследии.
Двойная связь - подробнее - незакончено!!!
Понятие о ненасыщенных углеводородах появилось очень давно, и структуры с двойными связями рисуют с тех времен, когда вообще появились общепризнанные структурные формулы – где-то в начале 1870-х. Было понятно, что соединения с двойными (и тройными) связями имеют общее свойство – они присоединяют разные другие реагенты, образуя продукты по составу соответствующие точной сумме составов исходных. Но как устроена двойная связь оставалось неясным очень долго. Двойная черта, которой изображают двойную связь, состоит из двух одинаковых связей, или разных? А как это вообще можно узнать? Для нас идея о том, что двойная связь это сочетание σ- и π-связей, кажется банальной и очевидной. Трудно поверить, но эта общепризнанная теория возникла совсем недавно, еще и ста лет не исполнилось. Немецкий физик Эрих Хюккель (с ним уже встречались в физхимии в теории растворов электролитов, уравнение Дебая-Хюккеля это фактически его диссертация; а совсем скоро мы еще раз встретимся, он придумал самую удобную теорию ароматичности) думал-думал, куда применить только появившуюся квантовую теорию, и обратил внимание, скорее всего с помощью старшего брата Вальтера, отличного химика-органика, оторому я лично очень благодарен за одну отличную методику, – на цис и транс-изомеры алкенов. Вопрос опять вроде бы простой: а почему простая связь C-C крутится, а двойная нет? Это только сейчас кажется, что это очевидно, но тогда это было совсем непонятно. Оттого, что мы рисуем две черточки, а не одну, никак не следует, что вокруг этих черточек нельзя крутиться. Вот в ацетиленах аж три черточки, а крутится как бешеное, правда это непросто заметить. А двойная связь ни в какую. Энергию, необходимую для прокрутки одного атома углерода относительно другого в двойной связи оценивали много раз разными методами в том числе и совсем недавно, и получали величины до 95 ккал/моль, а это огромная, почти непреодолимая энергия. Формально эту величину все равно называют барьером вращения, но барьер этот так высок, что никакого вращения не получается даже при весьма высоких температурах. У замещенных олефинов барьер иногда довольно сильно снижается, и пара хороших акцепторов делает его минимум в два раза меньше, и в этих случаях превращение менее устойчивого цис-изомера в транс- может происходить при хорошем нагревании, например, при перегонке. Но даже в этом случае в обычных условиях никакого вращения нет.
Решая эту задачу чисто абстрактно математически исходя прежде всего из симметрии, Хюккель в 1930 году и пришел к выводу о двух типах связей в молекуле этилена. У Хюккеля терминология была другая, будучи физиком он и помыслить не мог ни о какой “химической” связи – в этот термин неявно заложена мысль о том, что в Природе существует какой-то особенный, химический, тип взаимодействия частиц, а это совершенно немыслимая ересь и вздор. Результатами работы Хюккеля нормальные химики вряд ли смогли бы воспользоваться.
К счатью, почти одновременно за дело взялся один из самых знаменитых химиков 20 века, Лайнус Полинг. Полинг проявил совершенно невероятное чутье и способности быстро осваивать самые новые течения в химии и физике, и, что самое главное, и что и по сей день отличает американских ученых от всех остальных – они умеют не только двигать вперед науку, но и ярко подавать результаты, делать понятными и даже захватывающими самые сложные выводы, находить правильные слова и картинки, писать исключительно ясные и прекрасно структурированные учебники. Учебник химии Полинга и его же книга от химической связи фактически создали язык современной химии, удобный и доступный всем. Полинга считают отцом-основателем квантовой химии, такой адаптированной для химиков версии совершенно неудобоваримой и непостижимой квантовой механики, своеобразной квантовой механики в картинках, квантовой механики вообще без формул и уравнений, доступной совершенно всем прямо со школы.
Итак, вернемся к Хюккелю и Полингу в начало 1930-х, в то, что теоретически предсказал Хюккель и нарисовал понтяной картинкой Полинг. Причина высокого барьера кроется в устройстве именно π-связи. …………………и исходя из этого получил то, что рисуют привычными нам картинками орбиталей, показав только π-связь, точнее только заполненную связывающую π-орбиталь. Связь π-типа получается перекрыванием p-орбиталей атомов углерода, и в связывающей орбитали перекрывание максимальное, что мы обозначаем показав красненькое-к-красненькому, синенькое-к-синенькому. Если мы начинаем крутить связь, одна p-орбиталь постепенно уходит из перекрывания: связь ослабевает и это невыгодно. Самая плохая картинка получается, когда один атом свёрнут на 90º относительно другого – тогда орбитали строго перпендикулярны, ортогональны и π-связь вообще разрывается, исчезает. Это хорошо или плохо? – однозначно плохо, связь она на то и связь, чтобы связывать, притягивать атомы друг к другу. Нет связи, пропала и энергия связи, молекула стала выше по энергии, менее устойчива по сравнению с исходной, связанной. И это должна быть значительная энергия, несколько десятков килокалорий на моль. Не будем приводить конкретные цифры, потому что там все немного сложнее, и на место порванной π-связи приходит стабилизирующая энергия гиперконъюгации, которая все равно далеко не компенсирует потерю, но несколько облегчает процесс. Если мы крутим дальше, то перекрывание понемногу восстанавливается, и по прибытии в плоскую форму дает полноценную π-связь – мы возвращаем назад энергию связи, с некоторой небольшой разницей, если, как на картинке, цис-изомер превращается в транс-изомер, чуть более выгодный по стерическим причинам, но это ничтожная разница по сравнению с тем энергозатратным путем через скрученную на 90º форму. Эта скрученная форма посредине пути не что иное как переходное состояние реакции цис/транс-изомеризации. На картинке сверху вид сбоку, снизу вид вдоль, как на проекции Ньюмена. 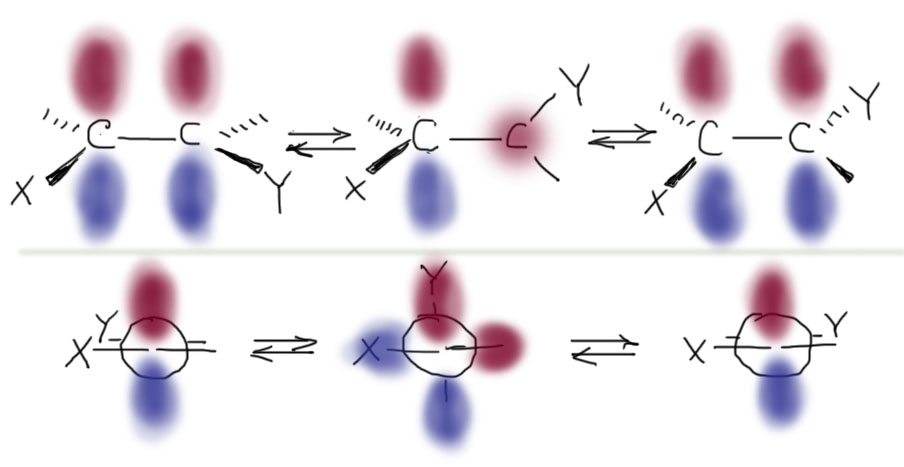
Такую теоретическую модель придумал Эрих Хюккель в 1930 году. Так получилось, что это вообще первая органическая молекула, которая удостоилась описания с помощью тогда только что появившейся квантовой теории, даже не молекула, а конкретно двойная связь в молекулах олефинов. И это было, как и положено для физика (а статья появилась не в химическом, а в чисто физическом журнале, так и называвшемся “Физический журнал”, по-немецки, естественно (Zeitschrift für Physik, 1930, 60, 423), и там не было ничего, кроме заумных рассуждений по-немецки и некоторого количества сильно обобщенных формул. Картинки, к которым мы привыкли, с символическими рисунками орбиталей в виде шариков и восьмёрок, появились ещё намного позже, уже после войны. Но сама идея π-связи химикам очень быстро приглянулась, и ее стали использовать, чтобы объяснять уже не только изомеризацию, но и химические свойства, реакции олефинов. Надо правда сразу сказать, что химикам только англоязычным, британцам и американцам, а в самой Германии, как и в Советском Союзе к квантовым затеям отнеслись очень прохладно, а лучше сказать враждебно. Это очень сказалось и на судьбе самого Эриха Хюккеля, и на своеобразном пути развития органической химии в этих двух странах, которые чуть не уничтожили друг друга в страшной войне, но во многом были удивительно похожи.
Квантовохимическая модель структуры должна объяснять свойства и реакции молекулы.
Самая высоколежащая заполненная орбиталь (ее принято называть высшей занятой, ВЗМО) овечает за основной тип реакционной способности. У олефинов эта орбиталь – π-МО, и в полном соответствии основной реакцией олефинов являются реакции, начинающиеся с атаки на двойную связь. Вот в алканах, а это единственный класс, который мы уже знаем, ВЗМО – это орбитали C-H связей (не C-C), и точно – реакции алканов – это реакции C-H связей, а не C-C связей. Работает! В 60-80-е годы прошлого века из этой идеи развилась очень популярная и удобная теория, в которой все реакции пытались описывать с помощью граничных орбиталей – высшей занятой (ВЗМО, по-английски HOMO) и низшей свободной (НСМО, по-английски LUMO) и многое получалось, за что даже отписали в 1981 нобелевскую премию.
ВЗМО участвует в реакции с электрофильными реагентами и свободными радикалами, но не с нуклеофилами (и ВЗМО и нуклеофил имеют по паре электронов, в сумме четыре
Можно даже посмотреть поближе. Как должна происходить реакция
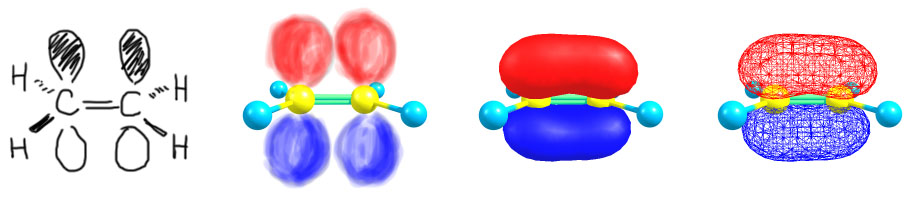
Двойная связь: молекулярные орбитали этилена
Электронная структура этилена – это отличный повод немного разобраться с тем, как вообще органическая химия представляет себе структуру. Вот эти картинки с восьмерками, представляющими π-орбитали, это уже электронная структура или еще нет? А гибридизация – это электронная структура?
Вот четыре картинки, две слева это привычные нам π-орбитали в виде восьмерок, или черно белых, или цветных. Справа – связывающая молекулярная орбиталь π-типа. Напомню, что орбиталь – это просто математическая функция, а картинка орбитали это просто ее трехмерный график. Трехмерный график довольно трудно себе представить в полном виде, потому что мы ристуем трехмерное пространство, в которое помещаем молекулу, и еще нам бы потребовалось еще одно измерение, чтобы показать значение функции для каждой точки пространства, в которой она, функция, определена. Увы, мы во-первых, не умеем рисовать четвертое измерение, а во-ввторых эта чертова функция определена везде, у нее нет границы: в километре от молекулы она тоже имеет значения. Понятно, что она быстро уменьшается с расстоянием и не только километрами, но и микронами можно не заморачиваться. Но для изображения графика проблема есть. Было бы совсем плохо, если бы нас действительно интересовали значения этой функции. К счастью, они нам совершенно до лампочки. Нас интересует только форма этой функции, ее графический образ, в каком-то смысле икона. Господа Бога мы тоже себе представить не можем, но взглянув на настоящую икону или свод Сикстинской капеллы некоторое представление получаем, естественно приложив к видимому изображению львиную долю собственных размышлений или фантазии. Вот картинка молекулярной орбитали и есть такой графический образ – обычно просто берут так называемую изо-поверхность, геометрическое место точек с одинаковыми значениями функции. C какими значениями? С любыми, какие понравятся. Фокус в том, что функция вроде бы с виду сложная, но у нее есть одно простое свойство – она быстро убывает с увеличением расстояния от молекулы и делает это гладко и без фокусов. Иными словами, если мы нарисуем две такие изо-поверхности, одну для значений побольше, другую – поменьше, то фома будет практически одинакова, только изоповерхность для значений поменьше будет более объемной. Вот на картинке нарисованы изоповерхности для какого-то значения – видим две такие сардельки сверху и снизу. Если бы нарисовали для значений поменьше, были бы такие же сардельки, только побольше. Взяли бы совсем малую величину – сардельки бы надулись до угрожающих величин, и наконец, если бы мы взяли совсем-совсем малые величины, почти неотличимые от нуля, сардельки раздулись бы на весь мир, достали бы до Вашингтона и в них утонул бы целиком даже вашингтонский обком вместе с Пентагоном. Мечта… Но и при этом они остались бы этими же сардельками… сарделищами, и важно то, что плоскость молекулы осталась бы местом точек со значениями функции равными нулю, не приблизительно, а точно – осталась бы узловой плоскостью. Поэтому мы и не будем раздуваться, а ограничимся такой изо-поверхностью, которую легко изобразить и соразмерной собственно молекуле. В любом случае это стоит иметь в виду, потому что молекулярные орбитали рисуют в разных местах разными изоповерхностями – никаких сограшений или стандартов на эту тему нет, – поэтому не стоит возмущаться, если в одном месте сардельки окажутся намного крупнее чем в другом. Еще раз – важен не размер, а форма (и то приблизительно) и даже еще точнее, симметрия. Про это поговорим чуть ниже. Пока же заметим еще и то, что изо-поверхность можно рисовать по разному. Можно отрендерить ее так, как будто это и правда поверхность, надувная резиновая сарделька. Красиво, и это многие любят. Цвета выбирают, что кому нравится. Проблема таких картинок в том, что эти сардельки и подушечки заслоняют молекулу, и это очень неудобно. Мне поэтому больше нравится такой проволочный каркасик, через который молекула просвечивает. Буду именно так рисовать.
Два особых типа олефинов - донорные и акцепторные олефины
Как мы договорились, электронные эффекты не изменяют природу явления (например, не делают двойную связь тройной, кислоту основанием, а катион анионом), а только в некоторой, большей или меньшей степени изменяют количественные характеристики, например, оставаясь в теме про двойную связь, мы можем говорить о большей или меньшей реакционной способности по отношению к электрофилам, к появлению частичных зарядов на углеродах, связанных двойной связью, и т.п. Занудство, в общем, страшное, но неизбежное.
Но, как учили нас (к вашему счастью не вас) классики марксизма-ленинизма и пролетарского интернационализма, количество однажды переходит в качество. Так как они это не сами придумали, а просто слямзили у нормальных философов, эта идея не лишена смысла. Вот и олефины остаются олефинами, пока на двойной связи обычные доноры и акцепторы (алкилы, другие углеводородные группы, галогены, и т.п.), но чрезвычайно сильно меняют свойства и даже фактически свою природу, когда заместителями служат или сильнодонорные, или сильноакцепторные заместители с мезомерным эффектом. Получаются два особых класса олефинов, играющие просто неприлично колоссальную роль в органической химии. Оба этих класса прочно и неразрывно связывают химию олефинов с химией карбонильных соединений. Почему – узнаем в свое время, а пока ограничимся простым описанием этого явления.
Олефины с сильнодонорными +М-заместителями, они же донорные олефины, они же нуклеофильные олефины на двойной связи несут еще одну (можно больше, но это не так принципиально) +М-группу, например, амин (тогда соединение называется енамин), гидроксил (тогда это енол), алкокси-группу (эфир енола), или даже кислород с отрицательным зарядом (такой ион называют енолят-анионом). Нарисуем просто структуру с обобщенным заместителем, имеющим неподеленную пару, которая легко смещается в сторону двойной связи, а та, в свою очередь, смещается на дальний атом углерода, создавая там приличный отрицательный заряд. Если нарисовать граничные структуры, то в таких олефинах вклад второй граничной структуры с отрицательным зарядом на дальнем углерода и двойной связью на заместитель, всегда значителен, но основной граничной структурой, ближе отражающей реальную струткру олефину остается первая – это все же олефин. 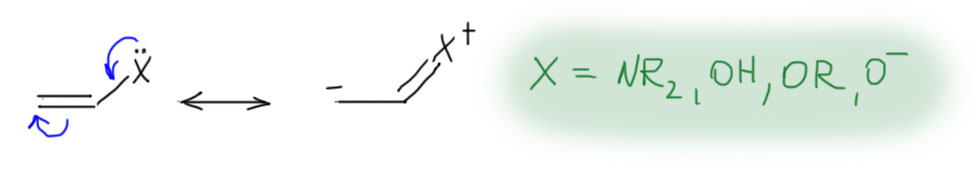 Но главное даже не это, хотя это очень важно, а то, что такие олефины обладают огромной реакционной способностью по отношению к электрофилам, и в таких случаях никогда не идет никаких разговоров ни про какие мостиковые ионы, потому что карбокатион после присоединения электрофила надежно стабилизирован мезомерным донорным эффектом. Более того, это уже и не карбокатион никакой, а просто какой-то аммониевый или оксониевый ион, или даже вовсе нейтральная молекула (если исходный олефин – анион енолята). Такому катиону не обязательно спешить искать себе нукелеофил хоть какой завалящий, а можно просто подождать, когда дядя или тётя над колбой решит, что реакция прошла, и выльет всех в воду – они всегда так делают, мы знаем. В этом случае это обычно заканчивается гидролизом и образованием карбонила, но подробнее мы в этом разберемся в химии карбонильных соединений. Согласитесь, что хотя эта картина в общих чертах тоже электрофильное присоединение к двойной связи, развивается реакция совсем не так, как там – здесь присоединение электрофила быстрое, нет никакого карбокатиона, ни мостикового иона, а нуклеофила, как учил бессмертный Винни Пух, можно совсем не давать.
Но главное даже не это, хотя это очень важно, а то, что такие олефины обладают огромной реакционной способностью по отношению к электрофилам, и в таких случаях никогда не идет никаких разговоров ни про какие мостиковые ионы, потому что карбокатион после присоединения электрофила надежно стабилизирован мезомерным донорным эффектом. Более того, это уже и не карбокатион никакой, а просто какой-то аммониевый или оксониевый ион, или даже вовсе нейтральная молекула (если исходный олефин – анион енолята). Такому катиону не обязательно спешить искать себе нукелеофил хоть какой завалящий, а можно просто подождать, когда дядя или тётя над колбой решит, что реакция прошла, и выльет всех в воду – они всегда так делают, мы знаем. В этом случае это обычно заканчивается гидролизом и образованием карбонила, но подробнее мы в этом разберемся в химии карбонильных соединений. Согласитесь, что хотя эта картина в общих чертах тоже электрофильное присоединение к двойной связи, развивается реакция совсем не так, как там – здесь присоединение электрофила быстрое, нет никакого карбокатиона, ни мостикового иона, а нуклеофила, как учил бессмертный Винни Пух, можно совсем не давать. 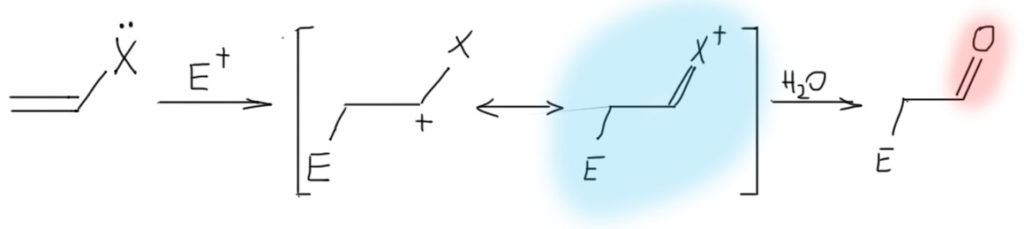
Олефины с сильноакцепторными -М-заместителями, они же электронодефицитные олефины, они же электрофильные олефины, они же акцепторы Михаэля. На втором полюсе находятся олефины с двойной связью, с которой электронную плотность хорошенько стянули. По-английски они называются образнее – electron-poor olefins, но мы не любим простых слов особенно с нежелательным социальным контекстом, и называем их электронодефицитными, что, если вдуматься, довольно смешно и двусмысленно: отчего это олефины вдруг стали дефицитными? ах, это не они дефицитные, а у них связи с дефицитом, то есть недостатком электронов. Ладно, сойдет. В любом случае, это даже более необычный тип олефинов, потому что двойная связь в них радикально меняет реакционную способность. Обычные олефины, в принципе, тоже можно заставить присоединять нуклеофилы, но это требует очень больших усилий, и поэтому такие реакции считаются нехарактерными. Обычные олефины легко присоединяют электрофилы и радикалы, но не нуклеофилы. А эти наоборот предпочитают нуклеофилы, а электрофилы присоединяют тяжело и далеко не любые.
В этих олефинах к двойной связи сопряжены разные -М-группы, чаще всего карбонил (в альдегидной, кетонной, карбоксильной, сложноэфирной и т.п. группах), но может быть и нитрил, и нитро, и много чего еще. В структуре таких олефинов значительную роль играет граничная структура с плюсом на дальнем атоме углерода. Для примера нарисуем именно карбонил. 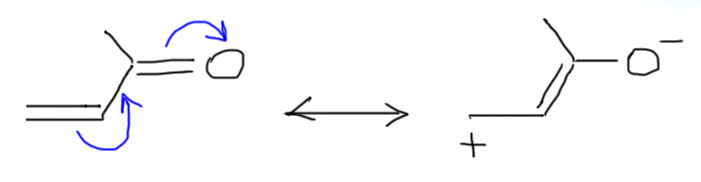
Ясно, что в этих олефинах дальний углерод имеет частичный положительный заряд и поэтому электрофилен, поэтому и предпочитает реагировать с нуктеофилами. Мы подробно будем разбираться с такими реакциями – обобщенно они называются присоединением по Михаэлю, откуда и название акцепторы Михаэля – в разделе про карбонильные соединения. И даже если такой олефин реагирует с электрофилами, то атака электрофила направляется на углерод, ближний к акцепторной группе, поэтому получаются продукты присоединения против правила Марковникова. Более того, скорее всего даже электрофильное присоединение может идти, как нуклеофильное. Подробнее в другом месте.
Что такое правило Марковникова (не закончено!!!)
Если совсем коротко, то правило Марковникова – это действительно правило Марковникова, ровно то самое правило, которое было предложено Владимиром Васильевичем Марковниковым 150 лет тому назад (в 1869 году) в диссертации, а затем и в коротком приложении к статье на немецком языке. Звучит оно для современного уха немного архаично, но, как ни странно, именно это оказалось его главным достоинством спустя полтора века, в течение которых сначала оно было основательно забыто, затем столь же основательно переосмыслено и приспособлено к конкретным механизмам органических реакций, и в конце концов вернулось к первоначальному виду. В современной химии определения “марковниковское” и “антимарковниковское” присоединение стали общеупотребительными и очень популярными. Эти определения в современной химии применяются ко всем без исключения реакциям присоединения без связи с конкретным механизмом присоединения. Именно это очень удобно, потому что в современной химии механизмов стало так много, что уследить за ними может далеко не каждый, а большинство интересует только практический результат – как идет присоединение и какой продукт получится. И вот эти ярлыки – “марковниковский” и “антимарковниковский” как раз и решают эту задачу совершенно замечательно, так что любому без объяснений ясно, что имеется в виду. Единственный секрет состоит в том, что не нужно умничать и пытаться наполнить правило новым содержанием.
Оригинальное правило читается приблизительно так:
Когда несимметричное ненасыщенное органическое соединение (имелся в виду олефин) реагирует с галоидоводородом, атом галоида присоединяется к наименее гидрогенизованному атому углерода
Единственное отклонение от первоначальной формулировки состоит в обобщении на любое присоединение формального реагента HX, где X-ом может быть все, что угодно, – не обязательно галоген, не обязательно даже один атом, но может быть и остаток любой сложности. И второе усовершенствование относительно оригинала состоит в том, что подразумевается возможность и другого пути присоединения, когда X присоединяется к наиболее гидрогенизованному атому углерода. Такой продукт называется “против правила Марковникова” или, особенно в англоязычной литературе “антимарковниковским”. И архаичное более/менее гидрогенизованный заменим на более привычное нам менее/более замещенный. Получается такая формулировка:
Несимметрично замещенный олефин присоединяет реагент HX так, чтобы X присоединился к более замещенному атому углерода. Если это так, то присоединение считается по правилу Марковникова, а продукт присоединения называется марковниковским.
В некоторых реакциях присоединения результат будет обратным – тогда о такой реакции говорят, что она идет против правила Марковникова, а продукт называют анти-марковниковским.
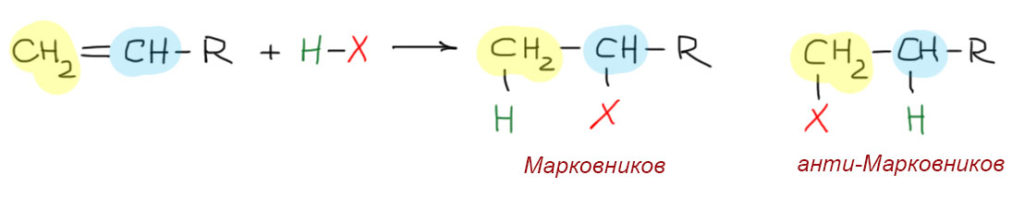
Такую же схему можно нарисовать для дизамещенного олефина с обоими заместителями на одном атоме углерода (геминальный тип замещения), а также для тризамещенного олефина.
Для дизамещенных олефинов с заместителями на разных атомах (вицинальный тип замещения) и тетразамещенных олефинов правило Марковникова смысла не имеет, и к таким случаям не применяется, так как оба углерода в этих случаях будут иметь одинаковую степеь замещенности (по-старому, гидрогенизованности). Это недостаток правила Марковникова? Нет.
Гидроборирование
Гидроборирование – одна из важнейших реакций в истории органической химии.
Это также очень важная реакция сама по себе, и мы будем ее использовать очень часто, и использование этой реакции всячески поощряется для селективного гидрирования, получения спиртов и бромпроизводных, а в химии алкинов еще и альдегидов. Ее использование как метода в синтезе мы разберем на страничке про методы. Но здесь поговорим именно о важности этой реакции, ее особенностях, и о том, почему эта реакция, с виду довольно частная, получила в 1979 году половину Нобелевской премии. Герберт Браун, получивший эту премию, а точнее сэр Герберт Чарльз Браун (1912-2004), английский по рождению химик, работавший всю жизнь в США, родился в 1912 году под фамилией Броварник (украинский аналог фамилии Пивоваров) в семье искусного столяра-краснодеревщика из Житомира, перебравшегояся вместе с семьей незадолго до рождения Герберта в Англию, а затем в США. Столяр-краснодеревщик, умевший делать красивую мебель, очень быстро понял, что не туда попал – дорогие стулья и комоды никому в глубинке США были не нужны, – зато сын его смог обычным образом, подрабатывая разносчиком газет и мойщиком окон, выучиться на серьезного химика. В истории химии немало имен выдающихся ученых, вовремя сваливших из очень плохого места, и это еще одно. Советские и украинские любители альтернативной истории любят числить Брауна-Броварника нобелевским лауреатом по происхождению от СССР или Украины, но останься его семья перед Первой мировой и 1917 годом в Российской империи, у будущего сэра Герберта было бы крайне мало шансов не то что на нобелевку, а и просто на жизнь.
Другая любопытная деталь состоит в том, что Браун не открывал гидроборирования. Реакция диборана с олефинами с образованием триалкилборанов была хорошо известна и до него, но о ее применении в органической химии никто даже не задумывался. Проблема в том, что боран существует в виде димера, диборана, не имеющего электрофильного атома бора, и поэтому реакция диборана требует довольно сильного нагревания для диссоциации диборана. Димеризация борана в диборан происходит за счет той же самой трехцентровой связи, что и те, что были рассмотрены в разделе про электрофильные реакции алканов, и это не удивительно, ведь боран, BH3 изоэлектронен и изоструктурен метильному катиону CH3+. Но два метильных катиона не могут подойти друг к другу хотя бы по причине ужасающего электростатического отталкивания, а два борана пожалуйста – вот и получается весьма прочный диборан, в котором каждый из электрофильных секстетных атомов бора наезжает на связь B-H второй молекулы, образуя с ней трехцентровую связь. Итого получаются две трехцентровые связи. Диборан обычно рисуют так, как слева, с двумя мостиковыми атомами водорода, и это правильно с точки зрения расположения атомов в постранстве – видно, что у атомов бора sp3-гибридизация и почти тетраэдрическая конфигурация. Но правильнее правая картинка, где ясно показаны трехцентровые связи, склеивающие два борана между собой.
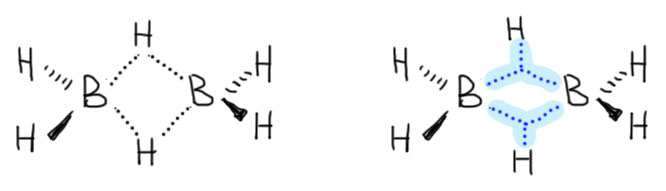
И вот такой димер борана, а это самый простой из устойчивых гидридов бора, как раз и не проявляет реакционной способности по отношению к алкенам потому что в нем, строго говоря, нет электрофильных атомов бора. Единственной причиной электрофильности бора является свободная орбиталь в соединениях типа BX3, и если эта орбиталь использована, например, как в диборане, то нет и электрофильности, ведь на боре нет практически никакого заряда, так как электроотрицательности бора и водорода очень близки (по Полингу, 2.0 и 2.1) и связь B-H практически неполярна. Это место нужно осознать особенно хорошо, так как в некоторых учебниках любят писать откровенный вздор про то, что в боранах эта связь поляризована в сторону водорода, так как водород имеет большую электроотрицательность. Эти рассуждения взялись потому что, как ни странно, многие, даже некоторые незадачливые писатели учебников, не понимают разницы между степенью окисления и реальными зарядами на атомах. Степень окисления – чисто формальная величина, и она всегда считается по разнице электроотрицательностей, как бы мала она ни была. В боране степень окисления бора +3, водорода -1. Но это не имеет никакого отношения к реальным зарядам на атомах, для которых важна именно величина разности электроотрицательностей (для простых бинарных молекул) и более тонкий учет смещений электронной плотности (электронных эфектов) в более сложных молекулах. И когда эта разница мала, то реальная полярность связи пренебрежимо мала.
Итак, чтобы заставить диборан реагировать с олефинами нужна довольно высокая температура, вызывающая диссоциацию на две реакционноспособные молекулы мономерных боранов, что делало всю реакцию сомнительным удовольствием, так как сам диборан – весьма неприятный по свойствам газ. Органики вообще не очень любят реакций с газообразными реагентами, когда нужно городить целый прибор для получения газа и его очистки, и подвода в колбу, где идет реакция. И когда газ еще и токсичный, самовоспламеняющийся, то желающих точно будет немного. К тому же, в те времена никому не пришло в голову, что первичные продукты этих реакций, экзотические для правоверного органика бораны, могут иметь какое-то применение в нормальной органической химии.
Браун к тому же даже не был органическим химиком – он с 1940 года работал в лаборатории знаменитого неорганика Шлезинджера, и искал новые удобные методы получения гидридов бора и их производных, борогидридов. Уже после, став самостоятельным ученым и продолжив эти исследования, он немного случайно обнаружил в 1956, что при взаимодействии борогидрида натрия с разными кислотами Льюиса в растворителях эфирного типа: самом эфире, ТГФ, диглим (диметиловый эфир диэтиленгликоля) и т.п., получается диборан, обладающий очень высокой реакционной способностью, драматически отличающейся от свойств диборана в других растворителях. Это очень интересный восстановитель (об этом в другом месте), и великолепный гидроборирующий агент, работающий при комнатной температуре. Быстро разобрались, что в таких растворах это уже не диборан, а просто боран, стабилизированный взаимодействием с растворителем. А можно просто делать это прямо на месте, и тогда не нужно ничего городить – просто прикапывай к раствору олефина растворы борогидрида натрия и эфирата трехфтористого бора. Эфирные растворители, которые являются основаниями Льюиса, стабилизируют мономерный боран в виде достаточно слабых комплексов с собой, и такой боран очень легко реагирует с двойной связью алкенов.
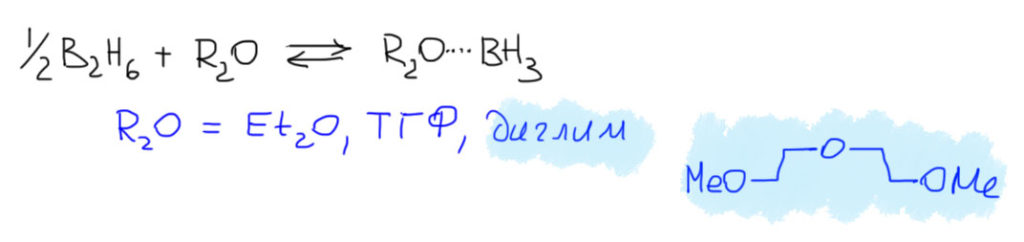
Почему реагирует? Очевидно, потому что такие комплексы диссоциируют на свободный боран легче, чем диборан, и уже при комнатной температуре в растворе есть некоторая концентрация свободного высокоэлектрофильного борана.
Механизм гидроборирования
Гидроборирование – это электрофильное присоединение к двойной или тройной связи. И да, и нет. В любом случае, механизм гидроборирования очень сильно отличается от уже привычного нам механизма электрофильного присоединения, в котором сначала присоединяется электрофил с образованием или карбокатиона, или мостикового иона, а затем это уже присоединяет нуклеофил. Боран присоединяется не в две, а в одну стадию, и это присоединение происходит не в согласованном механизме. Еще раз:
Присоединение борана к двойной или тройной связи – согласованная одностадийная реакция.
Напомню, что общим свойством согласованных механизмов является очень сильное влияние стерических факторов. Это совершенно общая идея – если вы имеете дело с согласованным механизмом, то главными будут не электронные факторы (индуктивный и мезомерный эффект заместителей в органической молекуле), а стереохимические, которые всегда упираются в так называемую стерику – минимизацию пространственных препятствий сближению реагентов и оптимизацию орбитальных взаимодействий. Последнее – про орбитальные взаимодействия – неизбежно вызовет у нас ужас, ведь мы ничего в них не понимаем. Это так, но пока успокоимся, возможно, это не так страшно, и многое вполне можно объяснить с помощью очень простых моделей.
Итак, мы решили, что боран, получающийся в небольшой равновесной концентрации диссоциацией комплекса с эфирным растворителем и имеющий пустую p-орбиталь на боре, является электрофилом, и как таковой взаимодействует с двойной или тройной связью. Остановимся пока на двойной. Итак, плоский боран подходит к плоскому же олефину так, чтобы зацепить π-орбитали двойной связи своей вакантной p-орбиталью – это ровно то, что мы называем электрофильной атакой. Это очень похоже на дозаправку истребителя в воздухе: боран в роли истребителя с пустыми баками подлетает так сверху и немного спереди к туше самолета-дозаправщика, то есть алкену, и опускает свой шланг (пустую p-орбиталь) в лоно дозаправщика (в богатую электронами толщу π-связи) и начинает качать топливо, то есть электроны c π-связи на бор. Если бы этот процесс дошел до конца, мы получили бы вот какую картинку: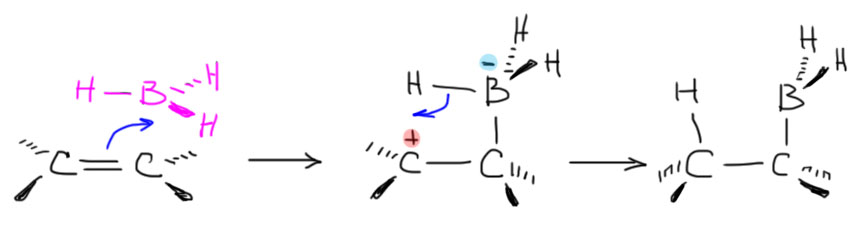
Образовалась бы промежуточная частица с плюсом на углероде и минусом на боре – такие анионы-и-катионы в одной молекуле в химии игриво называют цвиттер-ионами (от немецкого Zwitter – гермафродит, о чем свидетельствует одноименная песня модной группы Раммштайн). В таком цвиттер-иона соседствовали бы карбокатионный углерод и гидридный водород на боре, и естественно гидрид немедленно заткнул бы карбокатион. Если бы это было так, а ничего необычного в таком механизме нет, мы получили бы вполне типичное электрофильное присоединение с промежуточным карбокатионом, и стали бы применять обычные наши рассуждения о стабильности карбокатионов и т.п. Все бы сошлось, между прочим. Но вот незадача – все исследования, и экспериментальные, и теоретические, под которыми обычно понимают квантово-химические расчеты пути реакции, говорят, что это не так, и реально происходит нечто не стадийное, а согласованное. То есть начиается все ровно так же – подлетает, цепляет, начинает качать, но одновременно разрыхляется связь бор-водород и водород переселяется на так и не ставший карбокатионом атом углерода. В таких случаях вместо всяких ионов, хотя бы и цвиттер, рисуют переходное состояние – умозрительную конструкцию, показывающую взаимное расположение реагентов в самый волнующий момент реакции – на полпути от реагентов к продукту, когда старые связи еще не совсем порвались, а новые не совсем образовались – все это показывают пунктиром, а конструкцию заключа.т в квадратные скобки и помечают значком ≠. И дальше эта конструкция перестраивается в продукт реакции.
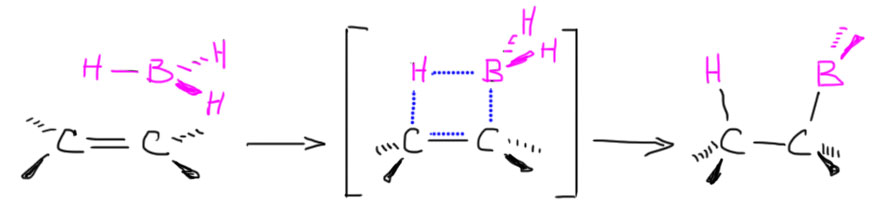
Что следует из этого механизма
Как мы договорились, механизмы нужны не просто так, а для объяснения наблюдаемых особенностей реакции. Что же объясняет этот механизм:
- син-присоединение – бор и водород присоединяются с одной стороны от бывшей двойной или тройной связи. В этом смысле реакция гидроборирования сильно отличается от реакций электрофильного присоединения с участием карбокатионов или мостиковых ионов, которые или имеют неопределенную стереохимию, или идут как анти-присоединение.
- раз в реакции не участвует настоящий карбокатион, то и электронные эффекты заместителей при двойной связи не должны сильно проявляться. Но они все же проявляются, и донорные заместители ускоряют реакцию, а акцепторные замедляют, но их эффект не так силен, как в обычном электрофильном присоединении. Что нужно сделать с механизмом, чтобы он объяснил эту тенденцию?
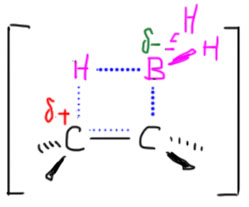 Очень немногое – представить себе, что связи рвутся и образуются не строго одновременно – если бы это было так, то на атомах вообще не было бы зарядов, и никакие эффекты заместителей не проявлялись бы. Но связи-то все разные – как они могут так строго синхронно рваться и образовываться? Скорее всего все же не строго синхронно, а одни чуть опережают другие. Механизм от этого не изменится, но если представить себе, что образование связи с бором идет чуть быстрее пересадки водорода с бора на углерод, мы получим небольшой положительный зяряд на том углероде, который в стадийном механизме был настоящим карбокатионом (в немного исправленном переходном состоянии пометим более редким пунктиром более слабые взаимодействия, а более жирным – более сильные). Заместители на углероде с частичным положительным зарядом будут влиять – доноры будут стабилизировать такое переходное состояние, а акцепторы дестбилизировать. Учтем, что там просто небольшой заряд, и нет никаких предпосылок сопряжения – поэтому эффекты имеются в виду только в смысле индуктивном. Скажем, алкилы ускоряют гидроборирование, а галогены замедляют. В гидроборировании нет большого ассортимента заместителей прежде всего потому что всякие сложные группы (карбонилы, карбоксилы и производные, нитро, циан и т.п.) сами реагируют с бораном.
Очень немногое – представить себе, что связи рвутся и образуются не строго одновременно – если бы это было так, то на атомах вообще не было бы зарядов, и никакие эффекты заместителей не проявлялись бы. Но связи-то все разные – как они могут так строго синхронно рваться и образовываться? Скорее всего все же не строго синхронно, а одни чуть опережают другие. Механизм от этого не изменится, но если представить себе, что образование связи с бором идет чуть быстрее пересадки водорода с бора на углерод, мы получим небольшой положительный зяряд на том углероде, который в стадийном механизме был настоящим карбокатионом (в немного исправленном переходном состоянии пометим более редким пунктиром более слабые взаимодействия, а более жирным – более сильные). Заместители на углероде с частичным положительным зарядом будут влиять – доноры будут стабилизировать такое переходное состояние, а акцепторы дестбилизировать. Учтем, что там просто небольшой заряд, и нет никаких предпосылок сопряжения – поэтому эффекты имеются в виду только в смысле индуктивном. Скажем, алкилы ускоряют гидроборирование, а галогены замедляют. В гидроборировании нет большого ассортимента заместителей прежде всего потому что всякие сложные группы (карбонилы, карбоксилы и производные, нитро, циан и т.п.) сами реагируют с бораном. - и самое главное – и региоселективность гидроборирования и скорость (или что то же самое, относительную реакционную способность различных олефинов) определяет энергетика взаимодействия борана и алкена, а это определенно зависит от двух факторов – энергии самой двойной связи и стерического фактора – препятствия сближению борана и алкена. Обсудим это в следующем разделе
Реакционная способность олефинов
Главный фактор – стерические препятствия. Поэтому монозамещенные алкены реагируют существенно быстрее дизамещенных, которые реагируют быстрее тризамещенных, а эти в свою очередь быстреее тетразамещенных. Естественно, это слишком формальное описание, и нужно мотреть еще и на размер заместителей, но когда речь идет об обычном боране, влияние оказывает только близкая стерика – разветвления на самом первом углероде от двойной связи. Дальше может быть что угодно, это никого не волнует. Для больших боранов требования к стерике более сложные. Совсем сильно это нас волновать не должно, так как реально трудно встретить случаи, когда такие различия действительно важны.
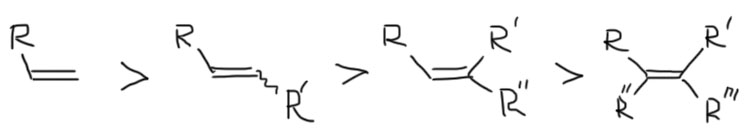
В этом ряду реакционная способность падает довольно сильно, на порядок, а то и на два на каждом знаке >, и это создает возможности для гидроборирования более реакционноспособных двойных связей в присутствии менее реакционноспособных, только для этого надо строго дозировать гидроборирующий реагент, так как в присутствии избытка гидроборирование пойдет дальше. И нужно не забывать, что на бор обычно садится три молекулы алкена (тризамещенных – два, тетразамещенных – одна). 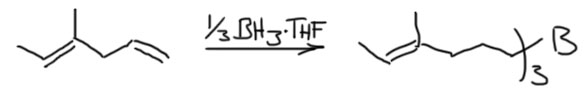
На этот довольно очевидный и следующий из механизма реакции ряд реакционной способности накладывается несколько занятных эффектов. В принципе, это не очень важно, и воспользоваться этим для селективного гидроборирования не очень получится. Просто для полноты картины, и чтобы было еще яснее, чем гидроборирвоание отличается от других реакций присоединения.
Во-первых, при прочих равных условиях начинает играть роль та самая стабильность двойной связи, которую мы разбирали. Скажем, если брать дизамещенные алкены, то цис-изомеры реагируют заметно быстрее транс-изомеров. Напомню, что в цис-изомерах двойная связь дестабилизирована относительно двойной связи в транс-изомерах, также за счет стерического отталкивания, причем чем больше группы, тем больше этот эффект. С тем же самым связана и повышенная реакционная способность напряженных циклических алкенов, но с напряжениями мы будем разбираться отдельно в теме циклоалканы.
Во-вторых, электронные эффекты все же играют некоторую роль, и акцепторы замедляют реакцию, а доноры ускоряют. Причина этого, как разобрано в предыдущем разделе, в том, что согласованный механизм не предполагает полной синхронности, и некоторый положительный заряд на втором углероде все же появляется, и на этот заряд действуют обычные стабилизирующие и дестабилизирующие эффекты. Обязательно только нужно не забывать, что стерика на первом месте, а эффекты на втором. Тем не менее, скажем, галогены весьма сильно замедляют реакцию. А атом кислорода непосредственно рядом ускоряет, как и положено мезомерному донору. Но эффекты очень маленькие, несравнимые с эффектами в электрофильном присоединении с участием карбокатионов и мостиковых ионов.
И еще одно яркое отличие гидроборирования от других реакций электрофильного присоединения – реакционная способность стирола (фенилэтена). В электрофильных реакциях с участием карбокатиона стирол намного более реакционноспособен чем монозамещенные алкены без ароматичского кольца по очевидной причине стабилизации бензильного катиона. В гидроборировании, напротив, стирол менее реакционноспособен, скорее всего, по тем же стерическим причинам.
Региоселективность гидроборирования
Обычный боран – очень маленькая и компактная молекула. Откуда же там берется стерика?? Все очень просто – стерические препятствия это не следствие абстрактного “размера” молекулы, а следствие конкретной ситуации, в которой молекулы должны строго определенным образом подойти друг к другу, чтобы началось перераспределение электронной плотности, которое и приведет к разрыву старых и образованию новых связей. В согласованных реакциях с участием нейтральных молекул требования к стерике всегда больше, чем в стадийных с участием всяких ионных частиц типа карбокатионов и карбанионов. Это общее свойство согласованных реакций. Разберем, почему это так, где-нибудь отдельно, а пока поверим.
Вот и в гидроборировании – чтобы реакция осуществилась, боран и олефин должны очень близко подойти друг к другу строго определенным образом и почти без допусков (когда мы говорим “подойти определенным образом” то естественно не имеем в виду, что молекулы, управляемые опытными капитанами и штурманами, медленно и филигранно притираются друг к другу, как космический корабль к орбитальной станции – нет, они беспорядочно и с огромной скоростью сталкиваются во всех возможных направлениях, но только те столкновения, которые отвечают оптимальной геометрии сближения приводят, и то с некоторой вероятностью, к развитию реакции).
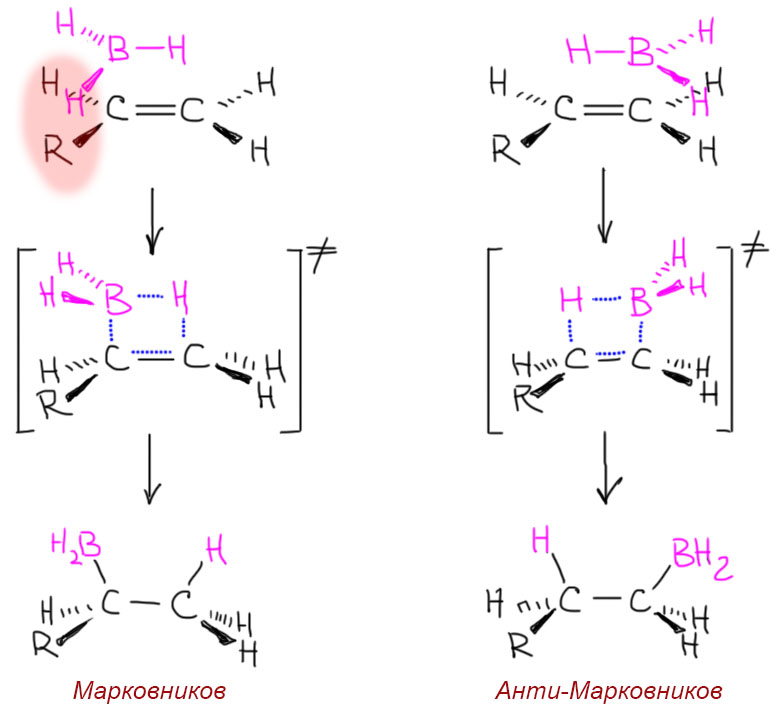
С самым маленьким несимметричным алкеном, пропеном, образуется смесь 90:10 (Singleton, J. Am. Chem. Soc.2009, 131, 3130-3131)
Боран присоединяет одну, две или три молекулы алкена
У борана три атома водорода и все одинаковые. Поэтому боран может присоединяться к двойной связи три раза, то есть одна молекула борана присоединяет до трех молекул алкена. Закономерности довольно простые и понятные. Смотрим на количество заместителей на двойной связи.
- если один или два (в последнюю категорию попадают и циклические олефины типа циклогексена) – то все три;
- если три, то присоединяются два алкена, а один атом водорода остается;
- если все четыре, то такие олефины обычно вообще не гидроборируются, если только заместители не маленькие, типа метилов – в этом случае гидроборирование идет, но только с одной молекулой алкена.
Причины такого поведения две. Одна вездесущая – стерика, типа, не лезет больше. Вторая похитрее. Мне так кажется, по крайней мере. Мы уже выяснили, что на боре есть пустая p-орбиталь, точно такая же как на углероде в карбокатионах. Карбокатионы стабилизированы гиперконъюгацией, и бораны тоже. Для боранов это, конечно, не так жизненно важно, как для карбокатионов, но роль свою это взаимодействие играет. Это очень хорошо видно в структурах алкилборанов. Атом водорода на соседнем с бором углероде старается расположиться перпендикулярно к плоскости борана (бор, как и карбокатионный углерод имеет sp2-гибридизацию). Так вот, если алкил разветвленный, это не получается. Поэтому такие бораны менее стабильны, что в частности, выражается в очень легких перегруппировках из-за обратимости гидроборирования (см. ниже и на вкладке про большие бораны про тексилборан).
А зачем это вообще нужно знать?
Гидроборирование обратимо: изомеризация продуктов гидроборирования
Гидроборирование очень сильно осложняется обратимостью этой реакции. Открытие Брауном сильного ускорения гидроборирования в эфирных растворителях было важно еще и тем, что в этом случае реакция проводится очень быстро и в мягких условиях, при комнатной температуре а часто даже и при охлаждении, и в этих условиях гидроборирование необратимо. И это сильно упрощает дело. И продукты гидроборирования в этих условиях – это продукты кинетического контроля, а соотношение продуктов – марковниковского и антимарковниковского – определяется разницей скоростей присоединения борана, а разница скоростей, в свою очередь, это следствие разницы в энергиях переходных состояний.
Но если реакцию проводить при нагревании, или если нагреть продукт реакции, например, попробовав его очистить перегонкой, то мы столкнемся с обратимостью. Если мы гидроборировали алкен с терминальной двойной связью, то мы почти ничего не увидим, потому что боран будет отщепляться и присоединяться обратно точно так же. Но если алкен был более сложный, то нас ждут сюрпризы, потому что обратная реакция далеко не обязательно пройдет по тому же месту, что прямая. Вот, например, что будет с гидроборированием 2-бутена, если проводить его при нагревании (схема упрощена, показан только продукт присоединения одного алкена к борану, не показаны диалкил и триалкилбораны, но это принципиально картину не меняет, хотя в реальной реакции будет много промежуточных форм с разными алкинами на боре). Отщепление борана из первого продукта гидроборирования может дать как исходный 2-бутен, так и 1-бутен, гидроборирование последнего даст в основном продукт с борным остатком на конце цепи. Именно последний будет накапливаться (в виде соответствующего три-н-бутилборана). Довольно любопытно задать вопрос почему идет такая перегруппировка. С одной стороны понятно, что если образуется концевой ален, то гидроборироваться он должен именно так. Но этот аргумент имеет кинетическую природу, а здесь именно равновесие – это совершенно непреложный факт, что нагревание боранов с бором внутри цепи приводит к выползанию бора на наименее замещенное место. Значит такой, наименее замещенный боран просто стабильнее более замещенного. Я думаю, что здесь дело в стабилизации гиперконъюгацией. Не забудем, что на боре есть пустая p-орбиталь, точно такая же как в карбокатионах. Поэтому те соображения, которые мы применяли к стабилизации карбокатионов, должны работать и здесь. Пустая орбиталь бора взаимодействует с гибридной орбиталью соседней C-H связи, стараясь встать коллинеарно, как показано на проекциях Ньюмена под боранами (передний атом в проекции – бор, я его обозначил, чтобы было понятнее, хотя обычно мы в ньюменах передний атом буквой не обозначаем). Видно, что в первом боране такой C-H один, а во втором – два (есть два равноценных ньюмена, а это всегда выгоднее чем один). В триалкилборанах, а именно они и будут конечным продуктом этой реакции у бора будет три одинаковых алкила, и у каждого по паре подходящих C-H связей, и там различие в пользу борана с менее замещенными алкилами возрастет еще сильнее.
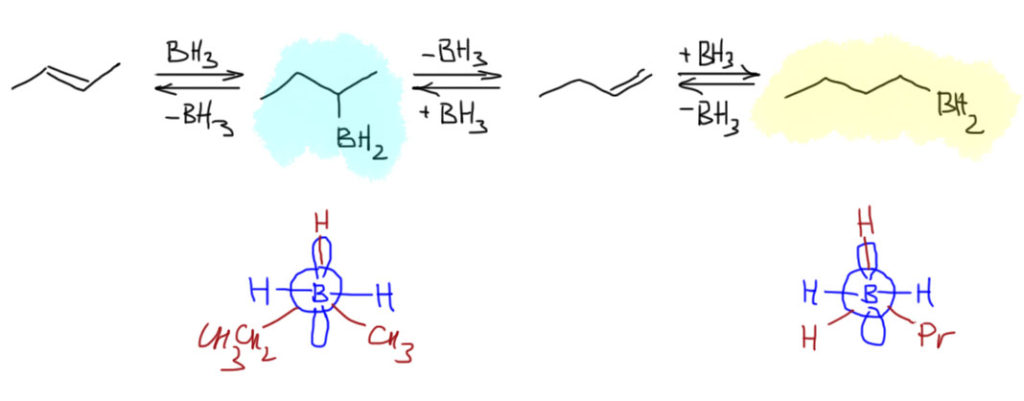
Зачем нужно знать о перегруппировке боранов? В практической жизни – чтобы не совершать ошибок. Чем более замещен боран, который вам нужно получить, тем с большей осторожностью с ним нужно обращаться. Гидроборируют ведь не только концевые алкены, но и замещенные, иногда даже довольно сильно. И тогда нужно очень точно соблюдать методику, не отпускать температуру, не оставлять, как у нас принято, неразделанную реакционную смесь валяться в углу тяги на неделю. Вообще, в химии гидроборирования принято продукт гидроборирования как можно быстрее превращать в конечный продукт реакции – углеводород, спирт, альдегид, галогенпроизводное и т.п. В этот момент все перегруппировки прекращаются.
Интересным следствием из этого свойства явлется малая устойчивость самых известных стерически затрудненных боранов – дисиамилборана и тексилборана. И тот, и другой нужно строго хранить в холодильнике и по возможности недолго, а еще лучше использовать сразу после получения. Очищать перегонкой их нельзя. Иначе они перегруппировываются и теряют значительную долю своей стерической затрудненности, а следовательно и селективности.
Кроме перегруппировки у обратимости гидроборирования есть и другое следствие – если нагреть более замещенный боран с менее замещенным олефином, то бор переедет на новый олефин. Это будет тем более хорошо, если образующийся олефин поменьше и более летуч, и его можно отогнать из реакционной смеси, а олефин-подсадка как раз побольше и менее летуч, так что ни он, ни его триалкилборан не улетят. Браун предложил нормальный 1-децен в этом качестве, но это может быть и что-то близкое – 1-нонен, 1-додецен и т.п. – эти олефины довольно легкодоступны. Это явление обнаружил сам Браун с сотрудниками (JACS, 1967, 89, 567). В таком простом примере, как изображен на схеме, это выглядит немного бессмысленно, – был циклопентен и получился циклопентен. Популярная в этой химии температура в 160º – это просто температура кипения растворителя, диглима (если будете сами что-то делать с диглимом, не забудьте проверить перед реакцией на содержание перекиси и хорошенько почистить от нее, этот растворитель образует перекись не хуже ТГФа, и если про перекись в диглиме забыть, жахнет так, что на этом ваша карьера органического химика оборвется, не начавшись). 
Но вся история становится очень привлекательной, если соединить одно и другое, перегруппировку и пересадку. Берем алкен с глубоко зарытой двойной связью, гидроборируем, греем и перегруппировываем, добавляем 1-децен и греем дальше, отгоняя новый алкен с двойной связью, вытащенной наружу. Исключительно интересно. Браун в целях привлечения внимания широких масс назвал это противотермодинамической перегруппировкой, имея в виду то, что из более замещенного, а следовательно, согласно нашей любимой мантре, и более стабильного олефина, получается менее замещенный и менее стабильный олефин. Но парадокса тут нет ни на грош – это просто равновесие, смещаемое, в строгом соответствии с бессмертным учением Ле Шателье, в сторону продукта, удаляемого из реакционной смеси отгонкой. Если бы этого (отгонки) не было бы, получилось бы обычное равновесие, то есть каша из олефинов и боранов. Именно это обстоятельство и не делает эту схему общеупотребительной, и если задумаете применить ее сами, не забудьте оценить относительную летучесть желаемого олефина, олефина-подсадки (или, как его назвал Браун, жертвенного олефина) и диглима, и если схема не сойдется, например, вместо желаемого олефина полетит диглим (температура кипения олефина окажется сильно выше 160º, а это как раз будет, если в желаемом олефине будет больше 10 атомов углерода). Не забывайте про такие детали, когда планируете применять реакции на практике: химия – наука практическая, а не абстрактная.
Откуда берут боран для гидроборирования
Есть довольно много реагентов, используемых для гидроборирования простым бораном. Самый плохой выбор – диборан, B2H6, хотя при большом желании в каталогах реактивов можно найти даже баллоны с этим газом. Но это страшновато и неудобно. Более просто генерировать боран прямо на месте. Есть довольно много предшественников борана. Наиболее часто используют борогидрид натрия вместе с кислотами Льюиса, как собственно и предложил основоположник. Обычно, к смеси алкена и борогидрида натрия в ТГФ или диглиме прикапывают эфират трехфтористого бора. Это самый распространенный прием. Если будете это делать, внимательно изучите методики, чтобы понять, в каком соотношении все это брать и на какое количество борана вы можете рассчитывать. Точно знать количество борана нужно в том случае, если мы хотим селективно гидроборировать одну связь в соединении, где их несколько, но разных по реакционной способности. Или если в соединении есть группы, которые взаимодействуют с бораном, но медленнее двойной или тройной связи, например сложноэфирная или нитрильная, или нитро. Если же ничего такого нет, то избыток борана не мешает и будет после реакции разложен при гидролизе реакционной смеси.
Еще более простая смесь, которую можно легко замутить даже в нашем практикуме – эквимольная смесь борогидрида натрия и элементарного иода в том же ТГФ. Эта смесь должна дать один эквивалент борана. Этот реагент легко применять для простых алкенов, но в более сложных случаях придется подумать о побочных реакциях с иодом.
Если есть немного денег и магазин химреактивов можно приобрести готовые комплексы борана. Достоинством этих реагентов являетс то, что вы точно будете знать, сколько там борана. Самый популярный реагент этого типа выглядит довольно странно – это комплекс борана с диметилсульфидом BH3·Me2S. Вонь страшная. После реакции диметилсульфид нужно аккуратно окислить, чтобы убрать вонь. Но этот реагент исключительно стабилен и очень хорошо хранится. И в литературе вы чаще других будете видеть именно этот реагент в реакциях гидроборирования. Конкурирующий и более простой реагент – комплекс борана с ТГФ в растворе ТГФ, BH3·THF. Не воняет, но хранится плохо, так как боран, как кислота Льюиса и одновременно гидридный восстановитель, довольно быстро ТГФ расщепляет, и концентрация раствора из-за этого постоянно уменьшается.
Гидроборирование: большие бораны
Гидроборирование простым бораном уже дает очень хорошую региоселективность в гидроборировании, образуя почти всегда в основном продукт присоединения против правила Марковникова (анти-марковниковский продукт) и причиной такого направления присоединения является стерика. Но боран все же действительно очень маленькая молекула, и ее стерического объема не всегда достаточно. Главные проблемы простого борана таковы:
- При гидроборировании терминальных монозамещенных олефинов, практически любых, кроме ожидаемого продукта гидроборирования, всегда получается от 5 до 20-25% изомера, продукта присоединения по правилу Марковникова, и ничего с этим сделать нельзя, ни с помощью растворителя, ни используя разные комплексы борана – такая примесь изомера терпима, особенно в простых случаях, и довольно легко устраняется очисткой продукта реакции. Это не очень большая проблема, и для таких олефинов простой боран используют очень часто.
- А вот при гидроборировании ди- и тризамещенных олефинов селективность резко падает – игра на разном размере заместителей (метил против изо-пропила, и т.п.) работает плохо, смеси получаются с содержанием до 30-40% нежелательного изомера. Такие реакции уже не считаются селективными, и такие смеси практически невозможно разделить перегонкой или перекристаллизацией продукта. Это все уже очень скверно. Иногда бывают исключения, особенно с циклическими олефинами, когда региоселективность приемлема, но рассчитывать на это трудно, нужно искать реальные методики в литературе.
- Как правило образуются продукты присоединения трех молекул олефина к одному борану – триалкилбораны. В последующих реакциях образования спиртов, галогенпроизводных, и т.п. участвуют не все три группы, а обычно не больше двух, а одна теряется. Если это ыл простой олефин, то и не жалко, а если сложный, если это какая-то двадцать пятая стадия длинного синтеза, или олефин какой-то драгоценный, то такие потери совершенно неприемлемы.
- С ацетиленами все совсем плохо – региоселективность плохая даже с терминальными ацетиленами, образуются ужасные по структуре аддукты (на странице про алкины подробнее).
Рецепт борьбы с этими недостатками вполне очевиден: если главный фактор в химии гидроборирвоания это стерика, а сам простой боран по размеру все же маловат, то нужно увеличить стерические препятствия – получить и использовать более громоздкие бораны. Возмодность такая вполне заложена в свойствах самого борана, которые мы уже разобрали – боран присоединяет от одной до трех молекул алкена в зависимости от стерических препятствий, которые связаны с количеством и размером заметителей на двойной связи, и старается взять максимально возможное количество алкенов. Это создает возможность сначала присоединить нечто более “рогатое”, и получить или моно- или диззамещенный боран, но он, в свою очередь, сможет присоединить еще один или два менее рогатых алкена, и это второе присоединение должно быть более селективным. Ровно так это и есть. Посмотрим на основные бораны такого типа.
Дисиамилборан
Получается гидроборированием 2-метилбутена-2. Такой олефин присоединяется дважды и остается один атом водорода. Странное название сиамил для заместителей – удобное обозначение для радикала состава C5H11, а такие группы традиционно называют не пентилами, а амилами (сиамил – это сокращенное название несистемно названного радикала втор-изоамила (по-английски – sec-isoamyl). Впрочем, больше это называние нигде, кажется, не употребляется.
Получают этот реагент прямо перед использованием. Хранится он плохо по причине изомеризации, которая идет уже при комнатной температуре. Это очень популярный гидроборирующий реагент, возможно, самый популярный, прежде всего потому что очень дешев, так как получается из очень простого олефина прямо перед использованием и используется без выделения.
Тексилборан
Получается из 2,3-диметилбутена-2 прямо перед использованием. Название тексил – это такая скороговорка из более полного обозначения этого радикала – трет-гексил (скорее даже это thexyl получается из английского tert-hexyl). В более старой литературе этот боран любили стильно рисовать в виде такой антеннки.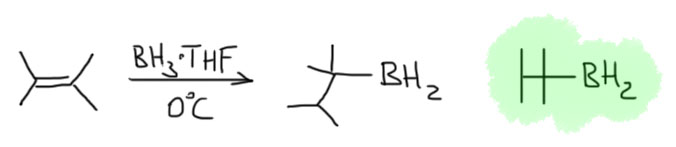
Этот боран еще более неустойчив к обратному процессу, и при работе с ним температура реакции не должна превышать 0º, а часто даже и отрицательных температур. Продукты гидроборирования очень легко теряют тетраметиэтилен, и дальше реакция пойдет так, как будто и не было никакого тексилборана, но при низкой температуре можно получит очень селективно желаемые продуеты гидроборирования.
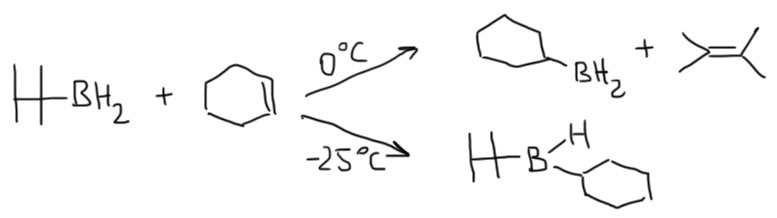
Вывод из этого простой: тексилборан это очень особенный гидроборирующий реагент с очень непростой химией. Не будем для наших несложных целей его использовать вместо Sia2BH. Ограничимся только знанием о существовании такого борана.
9-Борабициклононан (BBN)
Исключительно популярный стерически затрудненный боран. Почему он так странно называется? Это номенклатура ИЮПАК бициклических соединений. Названия строятся от соответствующих углеводородов. Заменяем бор на углерод. Это бицикл – два цикла, бицикло-. Почему не три? Три, но третий цикл получается из двух других – нет смысла его упоминать. Название строится так: в двух циклах всего 9 углеродов в скелете – итого нонан, бициклононан. Но бициклононанов может быть много, поэтому нужно уточнить. Делают это перечисляя количество углеродов в сторонах бицикла (три синих, три зеленых, один розовый), не считая атомов углерода (красных), общих для всех циклов. Все это записывают так: бицикло[3.3.1]нонан. После атомы нумеруют, начиная с одного из общих атомов, направляясь к другому общему атома сначала по самой длинной дороге, потом идут обратно по следующей по длине дороге (если дороги одинаковы, то разницы нет), и в самом конце идут по самой короткой дороге. В данном случае мостик с одним атомом получает последний номер 9. Так можно показать заметители, или замену углерода на другой атом. В данном случае бор. В случае замены атома после названия элемента используют соединительную букву а. Получаем окончательное название 9-борабицикло[3.3.1]нонан.
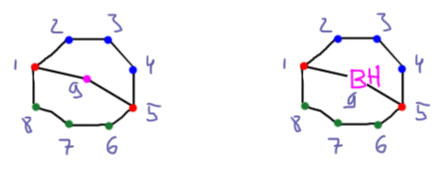
Получают этот боран из очень легкодутупного циклического диена – октадиена-1,5. Эта штука делается в промышленных масштабах каталитической циклодимеризацие 1,3-бутадиена. Гидроборирование идет в 2 стадии.
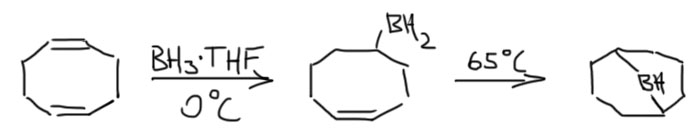
Достоинства BBN многочисленны и неоспоримы, особенно в сравнении с дисиамилбораном и тексилбораном. Это очень стабильное вещество, не имеющее никаких проблем с обратимостью гидроборирования, и перемещениями бора по скелету. Поэтому это вещество можно не получать, а просто купить (хотя и недешево) и спокойно хранить хоть годами. Если залежалось и малость заплесневело, можно очистить перегонкой. Чистый BBN представляет собой бесцветные кристаллы, и в этих кристаллах и неэфирных растворителях он сущесвует в виде димера, точно так же как простой боран, но димер этот существенно менее стабилен и существенно диссоциирован уже при комнатной температуре. Это свойство позволяет применять этот реагент не только в эфирных растворителях.
Особая стабильность бэбээна неразнывно связана с его структурой. Два цикла, из которых состоит эта молекула, шестичленные, соединенные через один атом очень аккуратно и точно – оба цикла в такой структуре имеют форму кресла, а это самая выгодная форма, какую только можно себе представить. Вот как это выглядит с нескольких сторон. Первый и второй виды особенно хорошо это показывают – более того, если вы когда-нибудь видели структуру алмаза, или углеводорода адамантана, представляющего собой структурный мотив решетки алмаза, то без труда опознаете это в структуре BBN (только не хватает еще одного мостика). Третий вид – сбоку со стороны одного из циклов, заслоняющего второй – довольно неуклюжий, но он объясняет, почему на схемах реакций BBN, чтобы не вырисовывать соединенные кресла, обозначают таким кокетливым парашютиком.
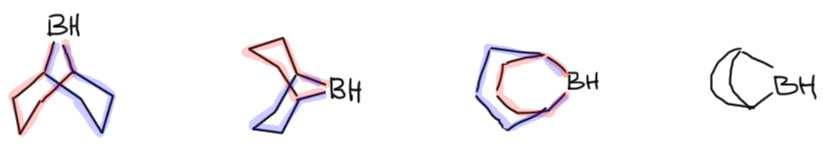
Пирокатехилборан
И еще один боран часто путается под ногами, хотя и без толку. Это очень простое вещество, получаемое без всякого гидроборирования из обычного борана и орто-дигидроксибензола (известного под тривиальным названием пирокатехин, но по-английски catechol без приставки пиро). В этом боране электрофильность бора очень сильно подавлена мезомерным донорным эффектом от неподеленных пар кислорода, и он имеет поэтому очень низкую реакционную способность. Гидроборировать им можно, но только при нагревании, и только самые реакционноспособные алкены, и большого смысла в этом нет. В современной химии кроме обычной реакции гидроборирования, которую мы изучаем, есть и гидроборирование, катализируемое комплексами переходных металлов типа родия. Вот там этот боран – едва ли не самый главный герой. Но это совсем другая реакция, и по механизму, и по особенностям, и мы ее использовать не будем, так как категорически нельзя использовать непонятные вещи, от этого и случаются чернобыли. Если заинтересуетесь, эта реакция обсуждается в курсе химии переходных металлов в органическом синтезе. 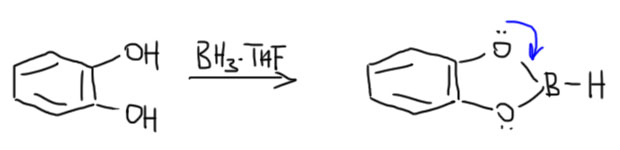
Зачем нужны большие бораны?
В первую очередь, для исправления недостатков обычного борана. Во-вторую, для каких-то специфических задач – об этом в самом конце.
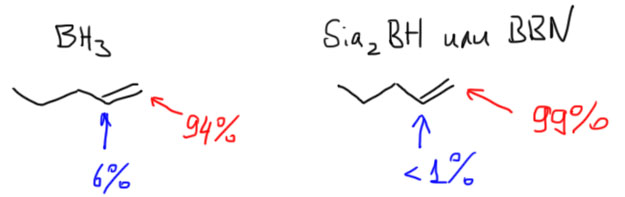
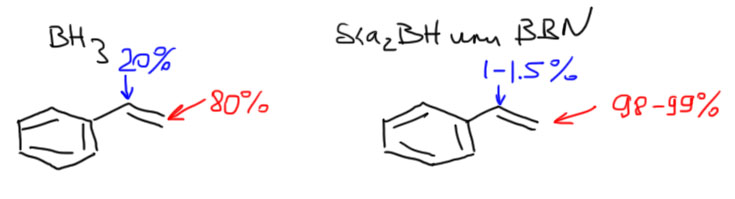
Второй темы мы касаться не будем, это явно за пределами нашего курса. Просто намекну, что это и новые реакции, для которых требуется особый контроль за селективностью. Вот пара характерных примеров. Тексилборан, например, позволяет присоединять два разных олефина с образованием смешанного борана. И такой смешанный боран можно использовать для синтеза несимметричных кетонов (эта реакция забавна тем, что ее сделал нобелевский лауреат 2010 года, начинавший тогда свою научную карьеру в лаборатории нобелевского лауреата 1979 года – Brown, Negishi, JACS, 1967, 89, 5285). Вот как это делается, на одном примере. Сначала собираем боран с тремя разными остаками из трех разных олефинов, первый из которых дает тот самый тексил. Затем этот тризамещенный боран реагирует с CO под давлением и в присутствии воды. И в конце делаем то же самое, как будто хотим превратить боран в спирт, но в этом случае получается несимметричный кетон с очень хорошим выходом. 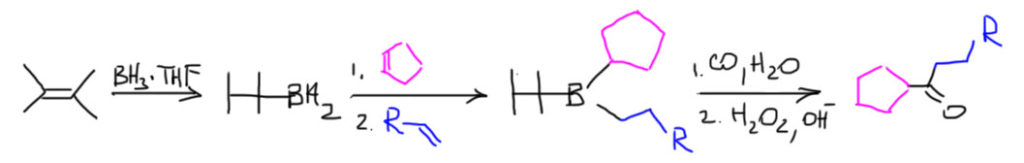
Еще более важным применением боранов с большим заместителем является возможность получения оптически активных продуктов реакции – асимметрический синтез. Для этого, конечно, не подоудут уже известные нам бораны, так как они все не хиральны. Но можно было бы взять оптически активный олефин и гидроборировать его, получив оптически активный боран. Оптически активный олефин? – это, наверное, какая-то чертова экзотика и невероятная ценность! Ничего подобного. Обычный скипидар, если в наше время кто-то еще помнит про существование такой приятно пахнущей жидкости, которую раньше продавали за копейки литрами как дешевый бытовой растворитель. Скипидар получается в больших количества при перегонке из сосновой смолы – это смесь природных углеводородов, терпенов. И главный компонент скипидара – оптически активный олефин α-пинен, очень симпатичная молекула, оптическая активность которой связана, конечно, не с двойной связью, а с обычными стереоцентрами. Оптически чистый пинен легко гидроборируется в полном соответствии с тем, чтобы боран приближался с наименее затрудненной стороны двойной связи. В этом случае это будет означать не только с менее замещенного конца двойной связи, но и с той стороны шестичленного кольца, где нет этой рогатой надстройки. Получается чистый диастереомер в виде чистого энантиомера. D дополнение в двум старым стереоцентрам (красные точки) получается два новых (зеленые), так как и метил тоже получает вполне определенное положение, так как с другой стороны прилепился водород из борана. Получается, что гидроборирование может быть не только региоселективно, но и стереоселективно – точнее, диастереоселективно (давать только один диастереомер из возможных), и энантиоселективно (давать один энантиомер, а не рацемат). Это волнительно и многообещающе само по себе. Получающийся стерически затрудненный и оптически активный боран и называется тоже непроизносимо и загадочно (это у терпенов такие названия, и никто с этим ничего не может поделать) – диизопинокамфеилборан, сокращается Ipc2BH. 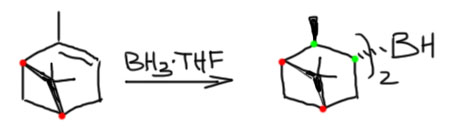
Если мы пустим этот боран в обычную реакцию получения спирта, то получим оптически активный спирт, потому что реакция замещения бора на гидроксил происходит с полным сохранением конфигурации. Итого – мы осуществили получение оптически активного спирта – асимметрический синтез. 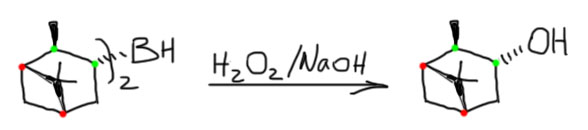
Но это – одна реакция, к тому же довольно очевидная. В исходной молекуле уже была оптическая активность, поэтому неудивительно, что мы получили оптически активный продукт. Но попробуем, вслед за Брауном, применить этот большой и оптически активный боран для гидроборирования нехирального олефина, но такого, в котором образуется стереоцентр, например, цис-2-бутен. Если бы мы взяли дисиамилборан или BBN то получили бы рацемат.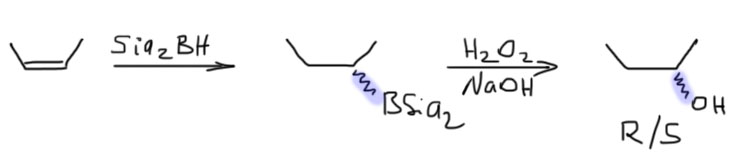
Ничего другого мы и не моли получить, потому что хиральность, оптическая активность не самозарождается – если все реагенты (а также катализаторы, растворители и другие вспомогательные вещества) нехиральные, то хиральности взяться неоткуда. А теперь возьмем вместо дисиамилборана оптически активный диизопинокамфеилборан. Как установил Браун, в этом случае гидроборирование происходит с образованием не рацемата, а оптически активного продукта гидроборирования, который првращается в оптически активный втор-бутанол. Из нехиральной молекулы (цис-бутена-2) получается оптически активный продукт, причем источником хиральности оказалась молекула, от которой в продукте реакции не остается ничего. Как выражаются в этой науке, произошел перенос хиральности с оптически активного борана на спирт.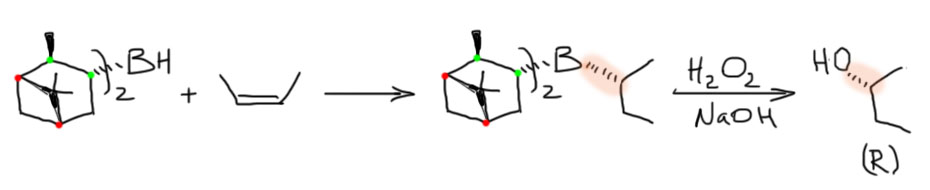 Может показаться, что ничего особенного не произошло, но это не так. Очень важный вопрос – гарантировано ли то, что произошло, обязательно ли при использовании хирального реагента происходит перенос хиральности. Ничего подобного, не только не обязательно, но даже наоборот – это происходит довольно редко и всегда требует очень серьезной работы. Фокус в том, что олефин плоский и нехиральный, верх и низ у него (если расположить его в плоскости) одинаковы. Но когда эта штука лежит в плоскости, при подхлде к этой молекуле со стороны двойной связи мы увидим, что слева и справа немного разный пейзаж – с одной стороны виднеются метилы, с другой – ничего. В этом и фокус, если у того, кто подходит, лево и право тоже отличаются. Именно так и устроены хиральные реагенты – это просто следует из определения хиральности: лево ≠ право. Возникают небольшие различия в способе подхода – подойти-то можно в двух сторон. И такие подходы перестанут быть одинаковыми. Другое дело, что разница в энергии между переходными состояниями, ведущими к продукту гидроборировани, гн очень велика. Будет ли эта разница серьезно влиять на результат реакции – вопрос более чем непростой, может будет, может нет, может будет, но не сильно. Это очень сложная наука, и мы не будем даже пробовать въезжать в нее серьезнее, просто отметим для себя, что такие реакции есть. В современной органической химии асимметрические реакции невероятно важны, и практически любая органическая реакция известна в асимметрическом варианте. Можно даже сказать категоричнее – если органическая реакция может дать оптически активный продукт, в современной химии уже стало неприличным делать эту реакцию по-старому, на образование рацемата. Извольте искать асимметрический подход и получать оптически активный продукт. Асимметрическое гидроборирование, описанное Брауном в начале 1960-х, было одной из первых примеров эффективного переноса хиральности с вспомогательного реагента на продукт.
Может показаться, что ничего особенного не произошло, но это не так. Очень важный вопрос – гарантировано ли то, что произошло, обязательно ли при использовании хирального реагента происходит перенос хиральности. Ничего подобного, не только не обязательно, но даже наоборот – это происходит довольно редко и всегда требует очень серьезной работы. Фокус в том, что олефин плоский и нехиральный, верх и низ у него (если расположить его в плоскости) одинаковы. Но когда эта штука лежит в плоскости, при подхлде к этой молекуле со стороны двойной связи мы увидим, что слева и справа немного разный пейзаж – с одной стороны виднеются метилы, с другой – ничего. В этом и фокус, если у того, кто подходит, лево и право тоже отличаются. Именно так и устроены хиральные реагенты – это просто следует из определения хиральности: лево ≠ право. Возникают небольшие различия в способе подхода – подойти-то можно в двух сторон. И такие подходы перестанут быть одинаковыми. Другое дело, что разница в энергии между переходными состояниями, ведущими к продукту гидроборировани, гн очень велика. Будет ли эта разница серьезно влиять на результат реакции – вопрос более чем непростой, может будет, может нет, может будет, но не сильно. Это очень сложная наука, и мы не будем даже пробовать въезжать в нее серьезнее, просто отметим для себя, что такие реакции есть. В современной органической химии асимметрические реакции невероятно важны, и практически любая органическая реакция известна в асимметрическом варианте. Можно даже сказать категоричнее – если органическая реакция может дать оптически активный продукт, в современной химии уже стало неприличным делать эту реакцию по-старому, на образование рацемата. Извольте искать асимметрический подход и получать оптически активный продукт. Асимметрическое гидроборирование, описанное Брауном в начале 1960-х, было одной из первых примеров эффективного переноса хиральности с вспомогательного реагента на продукт.
Гидратация алкенов
Гидратация алкенов – школьная реакция, которая выглядит совершенно тривиально и не сулит никаких проблем. Увы, это не так. В реальной жизни это весьма непростая и очень проблемная реакция. Я предпочитаю вообще никогда ее не использовать, потому что даже в учебных целях, когда все упрощается, лучше не переходить некоторых рамок и не делать вид, что проблем не существует там, где их выше крыши.
Чтобы разобраться в чем дело запишем вероятный механизм реакции в самом общем виде. Мы уже договорились, что эта реакция – частный случай электрофильного присоединения к двойной связи, и механизм должен соответствовать общей схеме, где сначала к двойной связи присоединяется электрофил, а затем к образующемуся карбокатиону (или мостиковому иону, но в случае протона это неактуально – атом водорода не может образовать двух связей, и мостикового иона в этом случае быть не может).
Записываем. Сразу напоминаю, что когда над стрелкой пишут плюс протон (+ H+), это не значит, что колбу поставили на пути протонного пучка в Большом адронном коллайдере. Это значит, что в реакционной смеси присутствует сильная кислота. Слово сильная здесь очень важно. Чем отличаются сильные и слабые кислоты (а это качественное, принципиальное отличие, а не просто разница в константах кислотности) можно еще раз вспомнить на страничке про кислоты. Когда над стрелкой пишут минус протон (- H+) или если это подразумевается на обратной стрелке, если над прямой написано плюс протон – это не значит, что частица (ион) плюется протонами и нужно соблюдать осторожность, приближаясь к колбе с такой диковиной, чтобы не получить протоном в глаз – это значит, что протон снимает какое-то основание, присутствующее в реакционной смеси, возможно даже очень слабое, но обязательно наличествующее; во многих случаях таким основанием является растворитель или анион той кислоты, которая протонирует в прямой реакции. Видим несколько важных вещей.
- все реакции обратимы, а следовательно и вся реакция обратима;
- здесь не одна, а две реакции – прямая называется кислотно-катализируемой гидратацией алкенов, обратная – кислотно-катализируемой дегидратацией спиртов по механизму E1;
- в общей схеме есть два кислотно-основных равновесия – протонирование двойной связи с образованием карбокатиона (оно же депротонирование карбокатиона с образованием двойной связи), и протонирование спирта с образованием оксониевого иона с хорошей уходящей группой, водой, вместо плохой уходящей группы, гидроксила.
- в середине присоединение нуклеофила к карбокатиону и обратное отщепление хорошей уходящей группы с образованием карбокатиона;
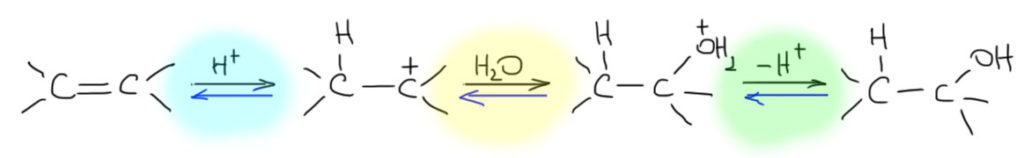
Механизм электрофильного присоединения этого типа – с медленной бимолекулярной стадией взаимодействия алкена и электрофила – называют, как мы знаем, AdE2. B мы, в принципе, знаем, что делать с обратимостью – позвать Ле Шателье. Если мы хотим гидратацию, то должны а) использовать кислоту посильнее – тогда первое равновесие сдвинется максимально в сторону карбокатиона, а карбокатион настолько реакционноспособен, что будет быстро превращаться в продукт присоединения нуклеофила; б) для самых простых газообразных алкенов – использовать давление, но это чисто промышленный путь, там ровно это и делают. В лаборатории все гораздо сложнее. В чем проблемы?
Где карбокатионы, там перегруппировки
Карбокатионы склонны к перегруппировкам. Подробнее мы это явление рассмотрим в другом месте, пока ограничимся простой констатацией этого факта – карбокатионы настолько склонны к перегруппировкам, что жить без них не могут, и даже в тех случаях, когда нам кажется, что перегруппировок нет, они все равно есть, просто нужно присмотреться получше. На практике это означает, что мы можем в результате гидратации не получить тот спирт, который хотели получить. И это еще полбеды. Настоящая беда в том, что перегруппировки редко проходят количественно, и даже вместо ожидаемого перегруппированного спирта мы получим смесь, даже если перегруппировывается менее стабильный карбокатион в более стабильный.
Пример перегруппировки, когда карбокатионы сравнимы по стабильности. Пробуем гидратировать гексен-1. Первоначально образуется вторичный катион, рядом другой вторичный катион, рядом с ним тоже вторичный катион. Перегруппировка пойдет по цепи, и каждый из катионов даст свой спирт. К счастью, второй и третий спирт – одно и тоже, если мы не используем затейливо меченый алкен. Получится смесь двух спиртов. В каком соотношении? А вот это непредсказуемо. Если бы равновесия все установились, предсказать можно было бы, но увы, карбокатионы настолько реакционноспособны и так быстро превращаются в продукты, что равновесие установится не успевает, и соотношение продуктов сильно зависит от реальных условий реакции. Органики очень не любят такие каши с переменным составом. Такую реакцию никто использовать не будет.
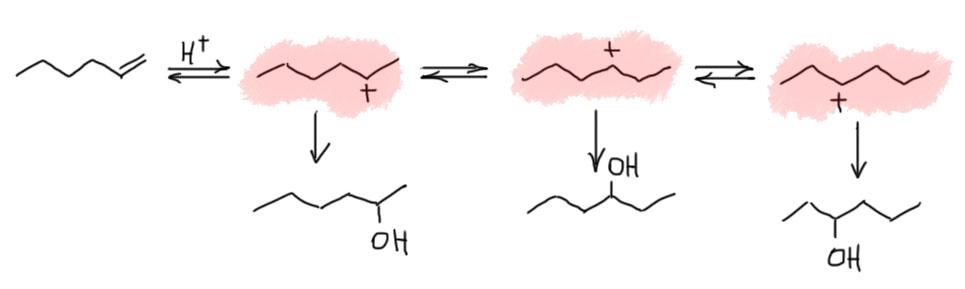
Пример перегруппировки в более устойчивый карбокатион. В этом случае сначала получается вторичный катион, который перегруппировывается в гораздо более устойчивый третичный (особо внимательные обнаружат еще перегруппировку в другой вторичный, но с той же структурой, если не метить – мы это поэтому опустили). И если бы равновесия установились, основным продуктом был бы третичный спирт. В реальности иногда будет и так, но чаще образуется смесь вторичного и третичного, потому что вторичный катион очень быстро превращается в спирт. Иными словами, у вторичного катиона перегруппировка и присоединение нуклеофила – конкурирующие реакции (по английски говорят точнее – competitive pathways – буквально, конкурирующие пути: слово “путь” в этом смысле в русском языке есть, но употребляется не очень часто, русский язык не очень любит слово “путь” во множественном числе). Это довольно разочаровывающий результат, потому что на перегруппировку в более устойчивый катион хотелось бы надеяться, как на главный результат, и так даже иногда и пишут, но это очень далеко от реальности. Эти вещи долго и усердно изучали в прошлом веке, чтобы понять, от чего это зависит, но увы, без толку, и проблему просто забросили. Может займетесь? Пока же практический результат такой – и эту реакцию использовать не будут.
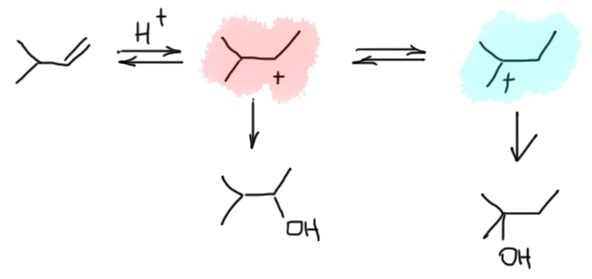
Карбокатионы склонны к побочным реакциям помимо перегруппировок
Карбокатион – очень сильный электрофил, поэтому взаимодействует со всеми нуклеофилами, до которых может дотянуться. Один из них – сам олефин, который подвергается гидратации. одефин – очень слабое основание, поэтому даже очень сильные кислоты протонируют олефины в очень малой степени, а основная часть олефина ждет своей очереди в реакционной смеси. Вместо протона олефин имеет шанс дождаться карбокатиона из уже запротонированной молекулы. И это не так уж маловероятно, особенно когда гидратацию делают неаккуратно, смешивая олефин с водным раствором кислоты – тогда из-за мелой растворимости углеводородов в водных растворах, олефин образует отдельную фазу (капельки такие масляные будут плавать в растворе), протонирование пойдет на грунице раздела фаз и у катиона будет практически равный шанс поймать воду или олефин). результат – так называемая олигомеризация. Посмотрим, что будет, например, при гидратации чего-нибудь простого типа пропилена: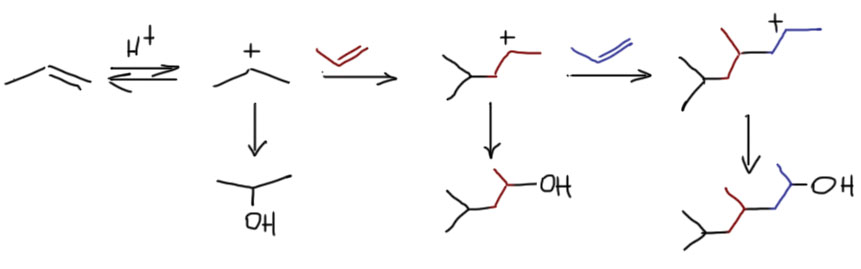
Олигомеризация почти всегда сопровождает реакции с участием карбокатионов, не только гидратацию. К счастью, продукты такой побочной реакции очень сильно отличаются от ожидаемых, потому что в них намного больше атомов углерода, а значит и намного выше температура кипения, и при очистке продукта реакции перегонкой даже в вакууме, они остаются в перегонной колбе (это называется кубовым остатком). Но выход целевого продукта это понижает и довольно сильно. Когда делаете что-то с ожидаемым участием карбокатионов (SN1-замещение, алкилирование по Фриделю-Крафтсу и т.п.), всегда учитывайте такие реакции, как побочные, и не удивляйтесь, что при перегонке продукта все, что нужно, уже перегналось, а в перегонной колбе еще полно чего-то жидкого, вязкого, коричневого.
Промышденность, кстати, совсем не имеет ничего против этой реакции и активно использует ее для получения углеводородных хвостов небольшой длины. Если в чем-то промышленном, например, есть слово нонил, то очень часто в структуре вместо элегантной веревочки нормального нонила можно увидеть такой кусок колючей проволоки как на последней схеме, или даже нечто совсем запутанное, что неудивительно, так как на олигомеризацию накладываются перегруппировки.
Реальные реакции гидратации олефинов – это не гидратация
Одна из главных проблем гидратации через образование карбокатиона и его взаимодействие с водой – необходимость высокой кислотности среды, которая вызывает обратную реакцию и все прочие радости плохо контролируемой реакции. Как этого избежать хотя бы частично понятно – нужно избавиться от воды в качестве нуклеофила. Тогда, конечно, образуется какой-то другой продукт, не спирт, но, возможно, его можно будет гидролизовать до спирта. В органике реакции судят не по промежуточным, а по конечным результатам.
Ровно так и поступают. В качестве растворителя используют не воду, а, например, карбоновые кислоты, трифторуксусную или муравьиную. Эти кислоты очень хорошо известны в химии карбокатионов. Считается, что эти кислоты благоприятны для таких реакций. Так как собственной кислотности для протонирования олефина им не хватает, добавляют более сильную кислоту, хлорную или серную к муравьиной, толуолсульфоновую к трифторуксусной. Карбокатион в таких растворителях, как и положено хватает тот нуклеофил, которого больше всего, даже если этот нуклеофил слаб, а такой нуклеофил это просто кислота-растворитель. Получаются сложные эфиры, которые очень легко гидролизуются в спирты, когда после реакции реакционную смесь обрабатывают водной щелочью. В результате получается спирт. а значит вся реакция с точки зрения конечного результата – гидратация, хотя к олефину электрофильно присоединяется не вода, а муравьиная или трифторуксусная кислота.
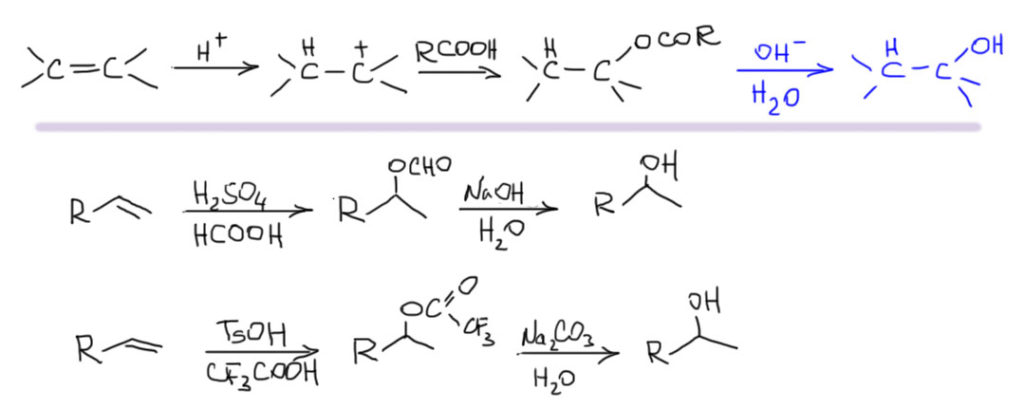
Эта методика позволяет получать спирты из олефинов, но не избавляет от перегруппировок, а вот олигомеризация в таких условиях почти не мешает – все же карбокатиону проще схватить растворитель, которого завеломо больше, чем всего остального. Поэтому это решение хотя и частично реабилитирует этот метод получения спиртов из алкенов, но не спасает его от перегруппировок.
Интересно, что простейшие олефины, этилен и пропилен, в лаборатории не додумается гидратировать вообще никто, но в промышленности эти реакции имеют огромное значение. Об этом подробнее ниже, но пока заметим, что в этом случае тоже происходит несто подобное. Эти олефины можно заставить реагировать, только растворив под давлением в концентрированной серной кислоте. Карбокатионы в этом случае вынуждены искать нуклеофил совсем в странном месте – ведь в концентрированной серной кислоте вообще практически нет воды. Кто-то наверняка скажет, что ее там 4 массовых процента (концентрированная серная кислота имеет концентрацию 96%), а это соответствует концентрации 4 моль в литре (4 М) – по всем меркам нехило! Это количество точно больше того количества олефина, которое вы можете туда вогнать – значит, вода всегда будет в избытке. И хорошо известно, что эта вода очень сильно влияет на свойства серной кислоты – кислотность 100%-ной серной кислоты существенно выше кислотности 96%-ной и это очень хорошо видно в самых разных реакциях, зависящих от кислотности. И точно так же, как вода влияет на серную кислоту, серная кислота влияет на воду. Когда будете изучать химическую кинетику, обратите внимание на то, что в уравнение скорости химической реакции на самом деле входят не концентрации, а термодинамические активности. В большинстве реальных реационных смесей разница между концентрациями и активностями совршенно несущественна, поэтому без проблем используют концентрации, и полностью забывают о том, что это не совсем корректно. Но не в такой экстремальной среде, как концентрирванная серная кислота! Активность воды в такой среде практически равна нулю. Это не значит, что вода количественно протонирована, но значит, что та часть, которая не запротонирована все равно очень сильно взаимодействует с молекулами серной кислоты. И что в такой ситуации остается делать карбокатиону? Основное правило жизни карбокатиона мы знаем – встретить первый попавшийся нуклеофил и соединиться с ним, невзирая на то, слаб он или силен. В концентрированной серной кислоте точно есть бисульфат-ион (не может не быть, и потому что протонирование воды неизбежно дает этот противоион, и потому что есть равновесие автопротолиза самой серной кислоты. Значит, в этих условиях образуется не спирт, а сложный эфир с серной кислотой (сульфат). 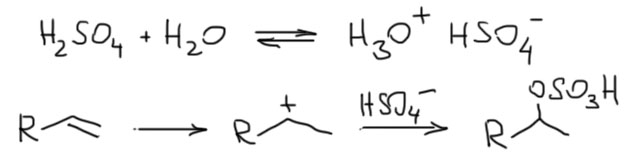 В промышленной системе, где олефин растворяют под давлением и помногу, реакция пойдет даже дальше, катион будет реагировать уже с первоначально образовавшимся сульфатом, и образуется двойной эфир с серной кислотой. Как это выглядит, посмотрим ниже, где про этилен.
В промышленной системе, где олефин растворяют под давлением и помногу, реакция пойдет даже дальше, катион будет реагировать уже с первоначально образовавшимся сульфатом, и образуется двойной эфир с серной кислотой. Как это выглядит, посмотрим ниже, где про этилен.
Этанол из этилена
Гидратация этилена – основной источник синтетического этанола в промышленности. Синтетический этанол – это растворитель и реагент для производства других органических продуктов, весьма важный, и мировое производство поэтому огромно и составляет несколько миллионов тонн в год. Надо сказать, что производство синтетического этанола ни в какое сравнение не идет с производством этанола в виде всевозможного бухла и для косметических и медицинских целей – такого этанода производится минимум на порядок больше – многие десятки миллионов тонн в год – и обязательно процессом брожения из самого разного сырья, содержащего углеводы, от зерна и картошки до продуктов химического гидролиза древесины (в просторечьи такой спирт назывался гидрашкой или табуретовкой, и сильно отдавал запахом хвои, напоминая по вкусу дешевый джин), но синтетический этанол для всего, что связано с внутренним или наружным применением, не используется.
Производство синтетического этанола налажено с начала 20 века. Основных процессов два. В более старом этанол растворяют под давлением в крепкой серной кислоте с естественным разогреванием до 60-80º, причем получается в растворе смесь этил и диэтилсульфатов. Эту смесь затем гидролизуют, разбавляя водой и отгоняя этанол, а разбавленную кислоту просто концентрируют упариванием (добавляют немного азотной кислоты, чтобы окислить накапливающиеся побочные продукты олигомеризации и осмоления), и возвращают в процесс. Для современной промышленности этот метод очень грязен и неэкономичен, и поэтому используется уже редко, хотя у него есть одно достоинство – высокая конверсия этилена, следовательно и высокая производительность. 
Большинство этанола в мире получают другим способом – газофазной гидратацией этилена с использованием твердого катализатора. Процесс был впервые запущен компанией Shell в 1947 и с тех пор стал основным способом производства синтетического этанола везде и всюду, тем более что катализатор достаточно прост – обычно это фосфорная кислота, нанесенная на силикагель, весьма немудреная вещь, которую невозможно скрыть патентами. Сухой силикагель просто пропитывают раствором фосфорной кислоты и все это высушивают и аккуратно прокаливают. В результате молекулы фосфорной кислоты связываются с поверхностными гидроксильными группами силикагеля. Откуда на поверхности силикагеля (диоксида кремния по составу)? Поверхность активного силикагеля всегда гидратирована, атомы кремния несут множество гидроксильных (их называют силанольными) групп. Вот с ними и связывается фосфорная кислота, вполне химически. Зачем? Такая поверхносно связанная фосфорная кислота существенно сильнее как кислота, чем фосфорная кислота в водном растворе. Водная фосфорная кислота, даже концентрированная (85%), довольно сильна, но существенно слабее серной, и скорость гидратации этилена с обычной фосфорной кислотой в растворе невелика. Но на поверхности – другое дело. Реакцию ведут при высокой температуре и давлении, очень быстро, при этом в спирт превращается только небольшая часть этилена, но для промышленности это не проблема, непрореагировавший этилен отделяют и возвращают на вход реактора. 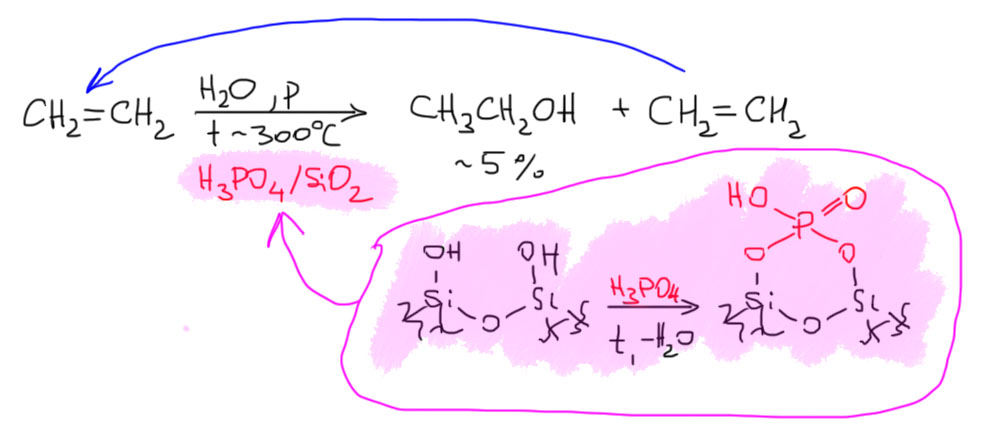
В очень походих процессах получают изопропанол из пропилена, втор-бутанол из смеси бутена-1 и бутена-2, и трет-бутанол из изобутилена. Эти три спирта делают в огромных количествах вполне сравнимых с производством этанола – все это очень важные промышленные растворители и реагенты.
Механизм гидратации без участия карбокатиона (строго факультативно и только для наиболее любопытных).
Гидратация этилена идет в основных чертах точно так же, как и других олефинов, хотя и медленнее и в более жестких условиях. И естественно вызывает сомнения. Реакция по общему механизму AdE2 должна идти через карбокатион. Но здесь карбокатион первичный и почти совсем нестабилизированный. Можно ли вообще предполагать образование такого плохого карбокатиона? Нет ли в этом состава преступления – сознательного обмана и даже мошенничества?
Вопрос этот не так прост, как может показаться. Проблемы устойчивости карбокатионов мы разберем в другом месте, но здесь заметим, что нет никаких данных, которые прямо или косвенно свидетельствовали бы в пользу образования первичных алкильных карбокатионов в какой-либо реакции в растворах (в газовой фазе – пожалуйста, но это не имеет никакого отношения к реакциям в растворах, а мы изучаем органическую химию именно в растворах, и то, что происходит в газовой фазе нам до лампочки). Несколько менее однозначна ситуация с вторичными карбокатионами, но и там корректных данных в пользу их образования маловато. Но в таких случаях почти всегда выкатывают простой аргумент – неустойчивая частица все же образуется, но время ее жизни столь мало, что ее не удается никак “поймать”. ОК, но это уже не наука, а религиозное верование. В науке нужны аргументы более конкретные, и обязательно экспериментально проверяемые. Не можете поймать карбокатион – приведите экспериментальные данные, которые хотя бы косвенно свидетельствуют в пользу. Если нет таких данных, то обязательно нужно рассмотреть альтернативный механизм, и искать доводы в его пользу.
Альтернативны механизм найти довольно просто. Каков бы ни был механизм реакции кислотно-катализируемой гидратации, бесспорно то, что есть обратная реакция – отщепление. Если есть обратимая реакция, то законы химии требуют простой вещи – механизмы прямой и обратной реакции одинаковы, а точнее, есть общий механизм обратимой реакции. Это представление иногда называют принципом микроскопической обратимости, чем сильно пугают ни в чем не повинных людей. Не будем использовать этот чрезвычайно сложный физический принцип во вполне очевидной ситуации, состоящий в том, что если вы предложили и обосновали механизм для какой-то реакции, то стоит вам на каждой стадии вместо прямой стрелочки поставить стрелочку обратимости, то вы автоматически получите уже обоснованный механизм обратной реакции.
Дальше все просто, хотя нам придется забежать вперед. Обратной реакцией к присоединению является элиминирование. Механизмом реакции элиминирования в общем случае является согласованный механизм E2. В этом случае это будет выглядеть так: Элиминирование идет из протонированного этанола, уходящая группа – вода, с другой стороны согласованно отщепляется протон основанием, основанием может являться та же вода. Вода?? Основание??? Блохе??? Кафтан???? Да, безусловно, и одной блохе бархатный кафтан однажды сшили, и вода в подходящих условиях может быть основанием. В жизни много странностей, которые, если рассмотреть поближе, не такие уж странные. Нет ничего странного в том, что даже слабое основание Бренстеда (а никто не сомневаеся в том, что вода это основание Бренстеда, сомневаются только в том, хватит ли у нее основности, чтобы оторвать протон) может оторвать протон, если частица, от которой она собирается оторвать протон – достаточно сильная кислота. У серной кислоты вода отлично отнимает протон (или наоборот, серная кислота отлично протонирует воду, что одно и то же). У этильного карбокатиона, если бы такой существовал, вода может оторвать протон? Скорее всего да – просто подумаем, насколько та же серная кислота может протонировать этилен. Может, но только в небольшое степени. Это значит, что этилен – очень слабое основание, а протонированный этилен – очень сильная кислота, сравнимая с серной. Серная кислота протонирует воду, значит и этильный катион тоже. Но ведь у нас нет этильного катиона! Катиона нет, но есть движение в его сторону – посмотрите на схему – там от протонированного этанола начинает уходить вода. Это движение привело бы нас как раз к этильному карбокатиону, а это движение приводит, как мы убедились, к драматическому увеличению кислотности протонов на втором углероде. Отлично, вот вода их и подхватит немного раньше, чем образовался бы страшный этильный катион, которого мы как раз и не хотим. Механизм вполне обоснован. В литературе можно найти теоретические модели этого механизма, построенные современными расчетными методами (E.J.Meijer, Angew.Chem.Int.Ed., 2004, 43, 1660), где показано, что это действительно предпочтительный путь реакции, избегающий карбокатион. 
Тот же самый механизм должен работать и для гидратации. Напишем все то же самое в обратном порядке. Ион гидроксония поляризует двойную связь, которая становится доступной для присоединения нуклеофила. Все это происходит согласованно с одним переходным состоянием, и это то же переходное состояние, что в реакции E2. Такой механизм присоединения называют AdE3 потому что в реакции должны встретиться три молекулы – олефин, протонная кислота, нуклеофил.
Вот такая картина. Кроме двухстадийного механизма c карбокатионом (AdE2) есть и согласованный одностадийный механизм, общий для элиминирования и присоединения – AdE3/E2.
Бромирование: разберемся с мостиковыми ионами
Считается, что бромирование алкенов идет через так называемые мостиковые ионы, и что именно этим объясняется стереохимия присоединения – анти-присоединение. Это очень красивая теория, но у нее есть один недостаток – в своем обычном виде она работает только до того момента, как вам придет в голову спросить пару вопросов.
Мостиковый ион придумали очень рано. Стоило появиться самому механизму электрофильного бромирования в работе Бартлета и Тарбелла 1936 года, как Робертс и Кимболл обратили внимание на то, что карбокатион у которого рядом атом брома не должен иметь такую структуру просто из общих соображений. Бартлет и Тарбелл (JACS, 1936, 58, 466) присоединяли бром к стильбену в растворе метанола, и предположили, что реакция идёт через карбокатион в полном соответствии с простым механизмом электрофильного присоединения, как мы его и рисуем (стереохимией пока пренебрегаем):
Робертс и Кимболл (JACS, 1937, 59, 947) сказали: Стоп! Так не может быть! У катиона свободная орбиталь, а у брома неподеленные пары! Не будут они рядом друг с другом сидеть просто так. Должна возникнуть донорно-акцепторная связь и одно из двух – либо это несимметричная структура: карбокатион, стабилизированный донорно-акцепторной связью с бромом, либо симметричный бромониевый ион, изоэлектронный оксирану. Хорошо бы оценить мощь и оперативность мысли: вся эта система понятий про орбитали и всё остальное только-только возникла, но немедленно была использована для оценки вариантов взаимодействия олефина и электрофила, к которой и сейчас мы мало что можем добавить. 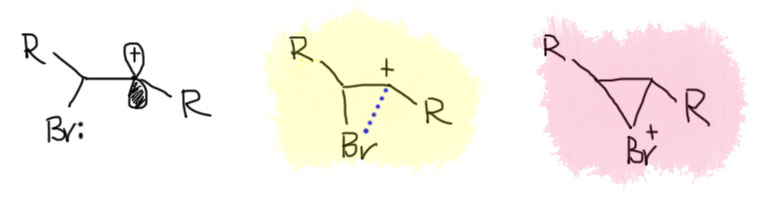
Эти структуры различаются довольно сильно. В несимметричном ионе почти всё остаётся на своих местах – это не очень сильная связь, положительный заряд в большей части продолжает сидеть на углероде. В этом случае мы имеем дело с внутримолекулярной стабилизацией карбокатиона. В симметричном ионе плюс в основном переселяется на атом брома, это бромониевый ион, или как это часто называют в наши дни, бромираниевый ион (от бромиран – трёхчленный гетероцикл с одним бромом в цикле, по аналогии с оксираном). Безусловно, на углеродах в этой структуре тоже есть положительный заряд, но это заряд, обусловленный индективным эффектом очень сильного акцептора – положительно заряженного галогена.
Зачем нужен мостиковый ион? Во-первых, как справедливо указали основоположники, невозможно пренебречь тем, что должно случиться просто потому, что должно. Мостиковый ион той или другой структуры должен образоваться. Значит, нужно не доказывать, что он образуется, а скорее, пришлось бы доказывать, что он не образуется, если бы были получены недвусмысленные экспериментальные данные, намекающие на такую возможность. То есть, нужен он нам, или нет, ему, мостиковому иону, должно быть до лампочки, он должен существовать, а что мы думаем ро этому поводу, это не его, а наши проблемы. Тогда и нам стыдно должно быть переть против Природы. Смиримся. Мостиковые ионы существуют.
Во-вторых, мостиковый ион нужен для того, чтобы объяснять, почему при бромировании практически всегда получается продукт анти-присоединения: нуклеофил почти всегда садится с другой стороны от электрофила. Это работает очень хорошо, почти всегда, и с большим количество вариантов бромирующего агента – просто брома, брома и другого нуклеофила типа воды или метанола или еще чего-нибудь посложнее, и множества других бромирующих реагентов типа NBS (внизу есть вкладка про электрофильное бромирование с помощью NBS) и т.п. А также хлорирующих и иодирующих реагентов, которые должны работать через аналогичные мостиковые ионы. Относительный выход анти-присоединения обычно не меньше 95-97%, а син-аддукт часто даже не определяется. Реакцию присоединения можно считать не просто стереоселективной (диастереоселективной, если точнее), а стереоспецифической (диастереоспецифической), этот термин употребляют, когда преимущество одного из продуктов является подавляющим, количественным. В реальной химии слово “количественный” не обязательно соответствует 100%, как можно подумать. 95% вполне достаточно. Такая стереохимия присоединения соответствует образованию эритро-диастереомера из транс-олефина, и трео-диастереомера из цис-олефина.
Еще одна характерная особенность присоединения брома к алкенам выяснилась из кинетики – скорость реакции зависела от концентрации брома во второй степени. К таким фокусам мы уже привыкли в присоединении HCl и HBr, и знаем, что там это вывело на согласованный механизм присоединения – из алкена сразу в продукт присоединения. Но здесь это точно не так, ведь как минимум про мостиковый ион мы уже знаем, следовательно реакция не может иметь согласованный механизм, раз у неё есть хотя бы один конкретный интермедиат – мостиковый ион. Он образуется из алкена и брома, как, нам надо еще понять, но дальше он превращается в продукт присоединения при реакции с нуклеофилом.
Голландские исследователи Вюнберг и сотрудники сделали простую, но удивительную работу длиной в полстранички(Chem.Comm., 1969, 907), про которую писали даже в научно-популярных журналах того времени, настолько она оказалась сенсационна. В химии очень важно для доказательства какой-нибудь замысловатой гипотезы подобрать правильную модель, уменьшающую число вариантов до минимума. Вот и здесь взяв очень громоздкий олефин, полученный сдваиванием адамантана, например, по методу МакМурри, они просто попробовали присоединить к нему бром в обычных условиях, и получили нечто странное: по элементному анализу это был аддукт этого олефина с двумя молекулами брома. Но это не был обычный продукт присоединения, потому что он оказался очень неустойчив – принагревании эта штука количественно распадалась на исходный олефин и бром. Исследователи сделали очень смелый вывод о том, что это и есть вожделенный мостиковый бромониевый ион, хотя никак доказать эту гипотезу не смогли: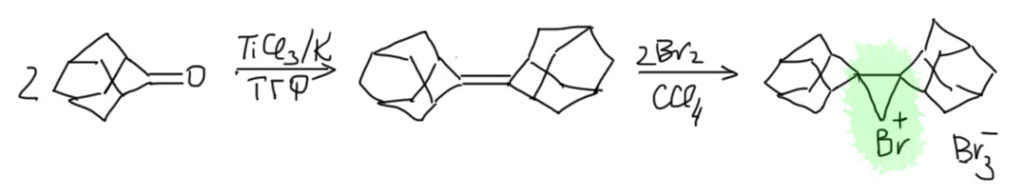
Структура иона была доказана через целых 15 лет рентгеноструктурным анализом очень активной в исследованиях электрофильного присоединения канадской группой Стэна Брауна (J.Am.Chem.Soc. 1985, 107, 4504), и оказалась точно такой, как и ожидалось. Обратите заодно внимание, как выглядит молекула адамантана – клетка такая аккуратненькая. 
Такой симметричный равнобедреный треугольник, хотя и с очень острым углом при бромной вершине, но это не удивительно, просто связи C-Br по своей природе намного длинней связей C-C, так что по-другому это быть и не могло. В этом смысле этот трёхчленный цикл немного не похож на почти равносторонний треугольник оксиран, с которым мы его хотим сравнить, и который формально этому циклу изоэлектронен. Не будем на этом зацикливаться, хотя здесь есть повод для раздумий. Просто примем, что бромониевый ион очень похож на оксиран. И зачем нам это?
Для того, чтобы объяснить небольшую загадку – почему этот бромониевый ион так легко получается и ни за какие деньги не хочет превращаться в обычный продукт присоединения брома. Почему реакция останавливается на этой стадии? К сожалению, мы пока еще не знаем ни химии оксиранов, ни еще некоторых важных вещей, поэтому придётся поверить на слово, а через некоторое время вернуться к этой теме. Дело в том, что оксираны очень легко реагируют с нуклеофилами, и эта реакция строго подчиняется механизму согласованного нуклеофильного замещения SN2. В механизме SN2 есть совершенно непреложный закон – нуклеофил подходит к атому углерода строго с тыла, с обратной стороны от уходящей группы, и если у него такой возможности нет, то реакция не происходит. Совсем. Никаких возможностей обойти эту засаду у обычных нуклеофилов нет (есть у необычных, но мы такие ни разу в жизни не видели, и видимо, не увидим, да и чёрт с ними). У нас все нуклеофилы обычные, типа бромида, или воды, или метанола, и они никак не могут нарушить этот страшный запрет. Теперь смотрим на бромониевый ион, и понимаем, что если мы его сравниваем с оксираном, то и реагировать он должен точно так же, по механизму SN2, с тыла. Но тыл у этой молекулы находится внутри адамантанового каркаса, а там нет места не то, что для каких-то нуклеофилов, а даже и для мельчайших частиц типа атома водорода. На структуре с реальными размерами атомов это видно просто превосходно (кстати, на той же картинке видна и ещё одна интересная вещь – размер атома брома вполне сравним со всем адамантильным куском – на обычных структурных формулах и проекциях это не видно, и кажется как можно сравнивать один атом и такую солидную конструкцию). Оцените, какая задача стоит перед несчастным бромидом: Никаких шансов!
Никаких шансов!
Из этого просто нагляднейшим образом видно, что механизм с мостиковым бромониевым ионом действительно работает, и что такой ион действительно раскрывается точно так же, как оксиран – с атакой с тыла, и понятно теперь почему у олефинов, разрешающих такое раскрытие, при присоединении образуется транс-аддукт – дело даже не просто в стерическом факторе, а в более фундаментальной вещи – раскрытие происходит как SN2 реакция с тыла, с другой стороны от первого атома брома.
Какое красивое исследование! – воскликнет экзальтированный читатель, и будет прав. Но у этого исследовования есть и обратная сторона, оно незаметно подготовило нам знатную ловушку. А что если взять не симметричный олефин, такой как эта адамантановая мышеловка (в смысле, бромоловка), или другой попроще, а что-нибудь несимметричное. Ну, стирол, например, что может быть проще. Или 1-бутен. Вот у нас мостиковый ион, вот он раскрывается по механизму SN2… Так, у механизма SN2 есть ещё одно писаное правило: нуклеофил атакует всегда менее замещённый атом. Это правило соблюдается не менее строго, чем обращение. Ну и пусть себе атакует, какие проблемы, мы все равно не поймём, какой бром первый, какой второй. А что если нуклеофил не бромид, а вода или метанол, или ещё что-нибудь. Вот и попались – в реальности получается ровно наоборот, и почти без вариантов. то означает ужасную вещь, и ликование сменяется печалью – что-то всё аерестало работать всего-навсего оттого, что чуть-чуть поменяли структуру олефина – не может же быть, что мостиковый ион образуется только для симметричных олефинов. Что за механизм такой, что работает только в частных случаях! Возмущению нашему нет предела.
Но нестыдный выход из этой ужасной ситуации есть. Нужно было и внимательнее читать основоположников, Робертса и Кимболла, и аккуратнее подходить к аналогиям. Основоположники ведь предполагали, что мостиковый ион может быть и симметричным, как оксиран, и несимметричным, как стабилизированный карбокатион.
Гидрогалогенирование
Сразу ограничим себя HCl, HBr и HI. Гидрофторирование невозможно сделать обычным образом, хотя сама эта реакция известна, и, возможно, где-нибудь отдельно мы ее обсудим, так как это довольно поучительно.
Сначала краткое резюме.
- Присоединение галогеноводородов к алкенам идет без участия мостиковых ионов
- Скорость реакции очень сильно зависит от количества донорных заместителей у двойной связи – требуется минимум две штуки, чтобы реакции протекали легко и с значительной скоростью; менее донорные олефины реагируют очень медленно или вовсе не реагируют.
- Реакции в органических растворителях протекают таким образом, что электрофилом является не протон, а молекула HX, причем реакция облегчается образованием водородных связей между атакующей молекулой HX и одной или несколькими содействующими молекулами HX, которые являются одновременно и источниками галогенида.
- Участие в реакции минимум двух, а иногда и большего количества молекул HX выражается в том, что скорость реакции зависит от концентрации HX в квадрате, а иногда и в более высоких степенях – по-другому это описывают, как второй или более высокий кинетический порядок по HX, а с точки зрения механизма говорят о тримолекулярном согласованном механизме присоединения, сокращенно AdE3.
- Согласованный характер реакции с участием двух или большего числа молекул HX, причем в продукте присоединения H и X оказываются из разных молекул HX, выражается в том, что стереохимией присоединения часто является анти-присоединение, но очень редко этот стереохимический результат проявляется полностью – почти всегда побочно образуется не менее 10-20% син-аддукта. Тем не менее гидрогалогенирование вполне можно считать стереоселективным анти-присоединением.
- Присоединение HBr к малореакционноспособным олефинам с концевой двойной связью очень часто осложняется конкуренцией свободнорадикального пути присоединения (присоединение по Харашу), причем инициаторами могут служить следовые примеси кислорода, перекисей и тому подобных соединений, полностью избавиться от которых невероятно трудно – поэтому реакция с 1-алкенами очень часто неожиданно дает продукт присоединения против правила Марковникова. Присоединение HCl и HI с этим никогда не сталкивается.
- Присоединение всех трех галогеноводородов очень сильно ускоряется в присутствии катализаторов, кислот Льюиса и некоторых сильных кислот Бренстеда, в том числе твердых типа силикагеля. В этих условиях присоединение всегда идет строго по правилу Марковникова. Именно этот метод используют в современной химии для получения продуктов гидрогалогенирования олефинов.
Детальное обсуждение с нудными подробностями
Начнем с одной важной общей проблемы. Есть ли мостиковый ион в гидрогалогенировании, или даже шире – в любых реакциях, где электрофилом является протон. Забежим сразу вперед и заметим, что в реакциях гидрогалогенирования электрофилом не является протон. Но пока мы этого не знаем, и нам кажется, что является. Может ли быть мостиковый ион при взаимодействии протона с двойной связью. На первый взгляд – какие проблемы? Когда мостиковые ионы стали популярны в органике в работах основоположников механизмов реакций, мостиковый ион с протоном рисовали часто. А потом перестали. Причина этого проста: нельзя просто так рисовать структуры, если мы не понимаем, как они устроены, какова природа связей, причины стабильности и т.п. Проще всего нарисовать как на первой структуре – просто протон на пунктирчике из середины двойной связи. Так вообще обычно рисуют так называемые π-комплексы с алкенами, когда кислота Льюиса взаимодействует с двойной связью. Если орбитальки нарисовать, как на второй структуре, тоже вроде все нормально, мы берем связывающую π-орбиталь двойной связи, потому что у протона нет своих электронов, а нам нужны электроны для связывания, и взять их можно только с заполненной орбитали. Мы видим, что орбитальные доли одного цвета (одного знака) отлично перекрываются с сферической s-орбиталью протона. Ай, у протона же нет электронов! Электронов нет, а пустая орбиталь есть. Отлично, из этой картинки мы видим, что взаимодействие – химическая связь – действительно может образоваться, только вот что это за связь такая – между тремя атомами и с двумя электронами? Как ее нарисовать? Так, как на третьей картинке, нельзя, потому что на ней изображены две связи от атома водорода, а водород не может образовать две связи. Так как на четвертой картинке можно, но не нужно – картинки такого рода вообще ничего никому не говорят, так как совершенно не ясно, что там за связи, между какими они атомами, где там электроны и заряд – картинки такого типа констатируют, что все взаимодействует со всем, а как и зачем, и что с этим делать, неизвестно.
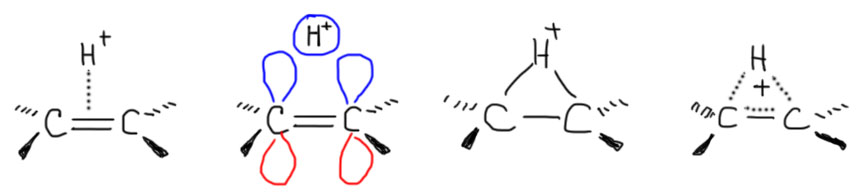
Пока мы не очень продвинулись, но одну вещь установили – в этой системе взаимодействующих атомов три атома и два электрона. Поскольку мы только что обсуждали электрофильные реакции алканов, в памяти еще свежи трехцентровые связи. А это – не то же самое? Очень похоже, что так, и это хороший след. Правда нужно его немного развить, потому что там у нас такая связь получалась при атаке сильной кислоты, того же протона, на σ-связь C-H. Но никто нам не запрещает распротранить этот подход и на атаку протона на π-связь, поскольку мы видим, что взаимодействующие орбитали не против этого. Нарисуем такую трехцентровую связь так, как мы договорились там – пунктирной звездочкой, соединяющей три взаимодействующих атома – напоминаю, что это не три связи, а одна связь, и обслуживается она парой электронов. И вспомним, что к трухцентровой связи всегда ведут три пути, более или менее равноценных. Поэтому ту же точно связь мы можем получить не только из протона и двойной связи, но и из карбокатиона и соседней C-H связи, и таких пути два: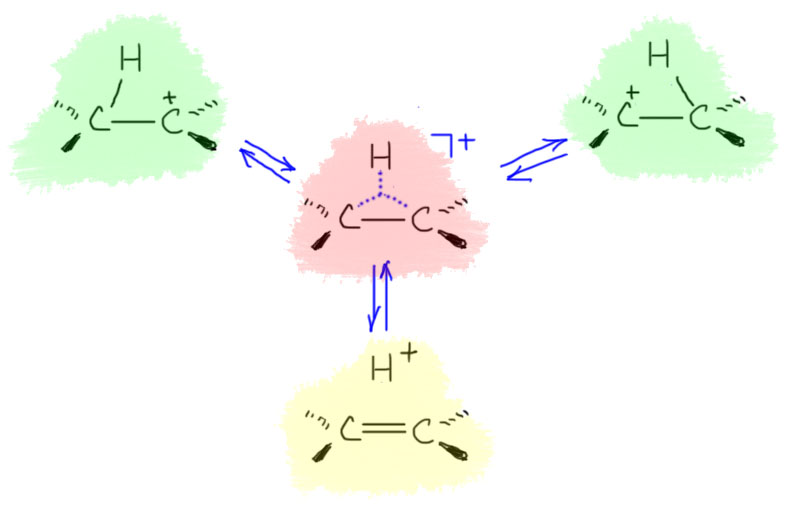
И это очередная демонстрация того, что в химии все взаимосвязано – лезем в одну проблему (механизм, реакцию, процесс) и попадаем в другую, не менее важную, и либо уже рассмотренную где-нибудь в другом месте, либо стоящую на очереди. В данном случае мы смторели на взаимодействие протона с двойной связью, и нечаянно попали… в перегруппировку карбокатионов с перемещением водорода со своими электронами – так называемые гидридный сдвиг. Мало того, что протон вдруг превратился в гидрид, но и карбокатионы всплыли, хотя наша задача состояла как раз в том, чтобы определить, не может ли мостиковый ион занять их место. Так вот этот пока только воображаемый мостиковый ион оказался одновременно и промежуточной частицей по пути перегруппировки карбокатионов. Еще раз – нарисованная схема образования мостикового иона при атаке протона на двойную связь одновременно утверждает, что тот же мостиковый ион должен образоваться и на пути перегруппировки. И если его нет в одном месте, значит нет и в другом – так устроена химия: если у нас есть сложный процесс с участием нескольких частиц, мы не можем произвольно выломать кусок этого процесса, не затронув все участвующие в процессе реакции. Так вот, если мы хотим узнать, может ли быть мостиковый ион в ротонировании двойной связи, спрсим, есть ли он в перегруппировке карбокатионов. К счастью, перегруппировки карбокатионов изучены вдоль и поперек – в исследованиях и дискуссиях по этой проблеме участвовали, кажется, вообще все крупнейшие теоретики органической химии второй половины 20 века – Шлейер, Ола, Уинстейн, Дженкс, и прочие не менее великие, применяя к решению возникающих проблемы все доступные методы эксперимента и теоретических расчетов. И да – нет посредине между двумя перегруппировывающимися карбокатионами мостикового иона как промежуточной частицы. Строго говоря, этот воображаемый ион есть не что иное как переходное состояние между карбокатионами. А раз это переходное состояние между катионами, значит это и переходное состояние при атаке протона на двойную связь – так протон приближается к двойной связи сверху, со стороны максимальной электронной плотности на π-орбитали двойной связи, и непосредственно превражается в один из двух карбокатионов, связанных перегруппировкой. И это наблюдение мы распрстраним и на протонирование тройной связи, хотя в реальности как раз там некоторые вопросы могут оставаться.
Вывод – в протонировании двойной и тройной связи мостиковые ионы никак не проявляются – протонирование непосредственно дает взаимно перегруппировывающиеся карбокатионы.
Вопрос 1. Что лучше (быстрее, проще, селективнее) реагирует с алкенами из этих трех галогеноводородов? Ответ может показаться удивительным – HI. Именно гидроиодирование – присоединение HI к простым алкенам – привело В.В.Марковникова к формулировке знаменитого правила, оставшегося в истории и учебниках. Эту реакцию изучали уже в середине 19 века, и уже тогда сумели доказать, какой продукт при этом образуется. Ни с HBr, ни с HCl получить ничего определенного тогда не удалось, и, как ни удивительно, не получалось еще очень долго, аж до 1930-х годов, когда за дело взялся знаменитый Моррис Хараш, который смог наладить экспериментальное изучение этих реакций и разобраться в том, как они идут. Это оказалось очень непросто и потребовало разработки очень сложных экспериментальных методов на пределе возможностей технологии того времени. А в чем проблема? Реакции-то с виду выеденного яйца не стоят. Проблема в том, что алкены не так просто заставить реагировать с галогеноводородами так, чтобы при этом получались заслуживающие доверия воспроизводимые результаты.
Вопрос 2. А что же сложного в реакции галогеноводородов с алкенами? Сложность в том, что это органическая химия. Что такое HCl, HBr и HI для обычного, нормального химика? Это галогеноводородные кислоты, одни из самых тривиальных. Про соляную кислоту знают вообще все. Остальные похожи. Это сильные кислоты, и мы даже знаем, что в группе сверху вниз сила немного увеличивается, хотя все три кислоты относятся к числу сильных, а сильные кислоты не так просто сравнивать по силе – константы диссоциации (кислотности) для них не работают (посмотрите еще раз про сильные кислоты и про то, как их сравнивают). Это верно, но – только в воде, в водном растворе. Увы, реакции органических соединений редко идут в воде, потому что органические соединения в воде почти не растворимы. Есть некоторые, которые хорошо растворимы, но мы сейчас хотим обсуждать углеводороды, алкены. Углеводороды в воде практически нерастворимы.
Поэтому реакции ведут в органических растворителях. Увы, галогеноводороды – весьма агрессивные реагенты и многие хорошие, более полярные растворители (спирты, кетоны, нитрилы, ДМСО и т.п.) с ними реагируют и поэтому для этих конкретных реакций бесполезны. Поэтому приходится использовать более простые, неполярные и малополярные растворители: углеводороды (гексан, гептан и т.п.), хлорпроизводные (хлороформ, дихлорметан и т.п.), эфиры (диэтиловый эфир, диоксан). Еще годится уксусная кислота, но с ней есть другие проблемы, поэтому пока оставим её в сторонке.
Так вот, в малополярных органических растворителях галогеноводороды не такие уж сильные кислоты. И вообще, если вы прочитали страничку про кислоты, то наверняка прониклись мыслью о том, что в таких растворах даже не имеет значения, сильна кислота или нет, если в растворе нет подходящего основания, то протон передать некому и приходится носить его с собой. Если растворить галогеноводороды в малополярных растворителях, они существуют с них в виде молекул и ждут основания. А его нет. А они ждут.
И вот, добавили олефин. Предположим на секунду, что олефин является достаточно сильным основанием для галогеноводорода. Что это значит? Совершенно очевидно, что в этом случае HX передаст протон олефину, а протонированная форма олефина (в терминах теории Бренстеда-Лоури, сопряженная кислота: олефин и соответствующий карбокатион относятся друг к другу, как сопряженные кислота и основание) это и есть карбокатион (возможность мостикового иона мы уже отмели). После передачи протона от HX останется галогенид-анион. Поскольку среда малополярная, далеко он не уйдет, да карбокатион его моментально и съест – получится продукт реакции. Да, это же и есть простой механизм электрофильного присоединения, как мы его уже знаем. Он бимолекулярный – в медленной стадии встречаются две молекулы, олефин и HX. Назовем его поэтому Присоединение (Addition) Электрофильное (Electrophilic) Бимолекулярное, сокращенно AdE2.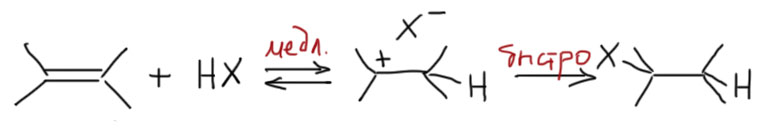
Поскольку кабокатион очень быстро реагирует с нуклеофилом – это даже называется коллапсом ионной пары, чтобы подчеркнуть чрезвычайную легкость этого процесса – равновесие протонирования смещается в сторону продукта реакции, поэтому степень протонирование может быть невелика, никто не просит, чтобы олефин протонировался на значительную глубину. И еще это значит, что время жизни карбокатиона настолько мало, что он может не успевать проявить себя, как положено карбокатиону, и, например, перегруппироваться. Может перегруппируется, а может и нет – перегруппировка ведь тоже реакция, и как у любой реакции у нее есть скорость, и это очень большая скорость, но скорость коллапса ионной пары может быть еще больше или сравнимой. Положим здесь закладку, мы еще вернемся к этому. А пока зададим вопрос, если такой механизм работает, для какого из галогеноводородов мы скорее можем это ожидать. Ответ очевиден – для HI, заведомо самой сильной кислоты не только в водном растворе, но и в органическом растворителе. Сила кислоты, особенно в среде, которая сама не помогает растаскивать кислоту на ионы, зависит от легкости отрыва протона от аниона, а это тем легче, чем анион больше по размеру. Ионы в малополярных апротонных органических средах, в которых неоткуда ждать поддержки, всегда чувствуют себя не в своей тарелке, и чем ион меньше и чем более локализован заряд, тем хуже. И наоборот. Большой иодид-ион (ионный радиус 2.06 Å) относительно неплохо чувствует себя в малополярных органических растворителях, причем одличие даже от ближайшего родственника бромида (ионный радиус 1.82 Å) очень велико, а уж от хлорида (ионный радиус 1.67 Å) – просто разительно. И действительно, иодистоводородная кислота – самая реакционноспособная из галогеноводородов, реакции идут быстро и без осложнений, и всегда получается продукт, соответствующий правилу Марковникова. Что неудивительно – мы уже выяснили, что правило установлено на основе обобщения реакций олефинов с HI. Впрочем, как ни странно, эта реакция довольно малопопулярна, и, насколько мне известно, никогда детально не изучалась.
Присоединение HCl. Поведение хлористого водорода HCl в присоединении к олефинам исследовалось гораздо тщательнее и загадки этой реакции много раз вызывали ожесточенные споры. С этой реакцией в некотором смысле произошла неприятная история. Когда в органической химии в 30-х годах прошлого века началось создание теории и изучение механизмов, вначале показалось, что будет все просто и всё быстро упорядочится в очень стройную систему, не хуже чем какая-нибудь теоретическая механика. Ну, может быть какие-то очень сложные реакции потребуют тяжких размышлений и каких-то нетривиальных решений, и это вполне ожидаемо, ведь и механика не очень шустро дает решение задач взаимодействия множества тел, но уж такие простые и основоподагающие реакции как присоединение галогеноводородов должны были стать просто триумфом теории. Но с присоединением и HCl и HBr все оказалось очень непросто, причем по-разному, и полной ясности нет до сих пор, хотя в современной органической химии на детали механизмов перестали обращать большое внимание – главное, чтобы мы понимали, как поставить конкретную реакцию и получить желаемый продукт.
Начнем с HCl. Этот галогеноводород наименее активен в реакции присоединения к алкенам. Скорость реакции очень сильно зависит от структуры алкена, точнее от того, сколько донорных заместителей висит на двойной связи, причем с увеличением числа заместителей скорость очень сильно учеличивается – есть огромная разница между реакцией этилена, 1-алкенов, и алкенов с внутренней двойной связью, причем каждый переход в этом ряду (от этилена к 1-алкенам, от 1-алкенов к внутренним алкенам) скорость возрастает дале не в разы, а на порядки. Для многих, возможно, будет сюрпризом, но этилен фактически вообще не реагирует с HCl, точнее реагирует чрезвычайно медленно, потребовались бы месяцы для достижения приемлемых выходов, я даже не уверен, что кто-либо когда-либо смог измерить эту скорость хотя бы минимально правдоподобно. Но ведь даже младенцы знают, что реакция этилена с HCl – промышленная реакция для получения хлористого этила! Да, знать-то знают, но все известные процессы синтеза хлористого этила из этилена и хлороводорода используют катализаторы, а про то, что для присоединения галогеноводородов к олефинам нужны еще и какие-то катализаторы, нам пока что никто никогда ничего не говорил. Что за катализаторы? Кислоты Льюиса, самые разные, а зачем их используют и какую роль они играют мы обсудим ниже. Сейчас же мы обсуждает сосбтвенно реакцию олефинов с хлористым водородом без катализаторов. Не с соляной кислотой, заметьте. С соляной кислотой не реагируют почти никакие олефины, так как просто не растворимы и не смешиваются с ней. Реакции олефинов с хлористым водородом без катализаторов делают или вообще без растворителя – при охлаждении насыщают жидкий олефин сухим HCl и в закрытом сосуде оставляют стоять при охлаждении или при комнатной температуре. Или в растворах неполярных или малополярных растворителей типа гептана или дихлорметана, которые тоже насыщают сухим HCl. Попытка провести эту реакцию в чем-нибудь чуть более полярном, например в эфире или диоксане приводит к практически полной остановке реакции присоединения, вероятно, потому что такие растворители являются основаниями Бренстеда-Лоури и HCl образует с ними комплексы, растрачивая на это всю свою кислотность. Получается такая конкуренция – кислота выбирает более сильное основание, и выбор у неё небогат – олефин или растворитель. Выбирает растворитель, основность атома кислорода эфирного типа точно намного выше, чем основность большинства двойных связей. А с еще более полярными растворителями начинаются проблемы уже другого типа. Не так-то просто подобрать
Монозамещенные алкены с концевой двойной связью с хлористым водородом реагируют быстрее этилена, но тоже очень медленно – для достижения высоких выходов требуются недели и даже месяцы. Реакции всегда дают продукт, соответствующий правилу Марковникова, и в случаях, когда можно предполагать легкую перегруппировку карбокатиона, такие продукты действительно получаются, но не на 100%. Самый популярный алкен для теста на перегруппировку – изопропилэтилен. Получаются оба продукта почти 1:1 в условиях, когда олефин реагирует с сухим HCl без растворителя, и это очень медленная реакция (JACS, 1933, 55, 5020). В более современных работах этот результат воспроизводили у же в растворителях тира дихлорметана с почти такими же результатами. 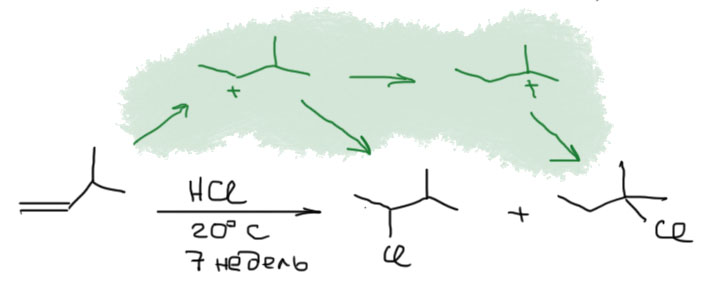
Это очень важный результат, потому что он показывает, что карбокатион в этой реакции образуется всё же вряд ли. Как не образуется – разве перегруппировка не является однозначным признаком карбокатиона? Вон же и на схеме зеленым выделено! На схеме выделен предполагаемый механизм присоединения через карбокатион, как мы его назвали AdE2. Но в анализе реакций всегда нужно анализировать все доступные данные. Фокус в том, что когда такой карбокатион действительно образуется, например, при действии кислот Льюиса на 2-галоген-3-метилбутаны, перегруппировка происходит практически нацело. Это совершенно типичный случай – перегруппировка этого вторичного катиона (его иногда называют втор-изоамильным или, скороговоркой, сиамильным – узнаете этот радикал из дисиамилборана?) в третичный (а этот называют трет-амильным) настолько выгодно, что должно происходить количественно с огромной скоростью. Если не происходит количественно и с огромной скоростью (сама реакция присоединения идет больше месяца!) значит там что-то сильно не так – нет там карбокатиона. А, чёрт, но перегруппировка-то идет, пусть и неколичествнно?! Идёт, но перегруппировка не обязательно предполагает образование карбокатиона, она может осуществиться, если реакция идёт по согласованному механизму и только двигается в сторону нестабильного карбокатиона, завершаясь перегруппировкой в более стабильный карбокатион еще до образования нестабильного. Обсудим это подробнее в другом месте.
Еще более странные вещи оказались, когда ученик Хараша Фрэнк Майо взялся изучать кинетику реакции олефина с HCl сразу после Второй Мировой войны. Это было невероятно сложной задачей, особенно если учесть, что оборудование в те времена было еще очень примитивным, и никаких методов быстрого набюдения (мониторинга) концентраций типа всяких спектроскопий или инструментальных хроматографий еще не было. Как точно дозировать газообразный HCl, измерять концентрации, учитывать влияние случайных примесей – всё это было решено. Результат оказался обескураживающим. Из принятого механизма электрофильного присоединения можно было ожидать кинетики второго порядка, первого по каждому из реагентов, потому что в таком механизме встречаются два реагента и реагируют в медленной стадии образования карбокатиона: 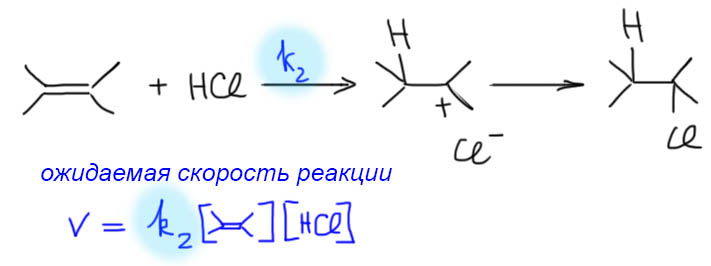
Но в реальности получилась совсем другая кинетика – четвертого порядка, первого по олефину, но третьего по HCl. Это был страшный удар! Только что построили теорию, разрисовали механизмы для основополагающих реакций, и казалось, что органическая химия уже превратилась в строгую науку, и тут такой конфуз! Вообще, четвертый порядок казался вздором – как могут в скоростьопределяющей стадии встретиться аж 4 молекулы – это же практически невероятно. Автора исследования могли объявить неумёхой и неучем, заклевать, вышвырнуть с волчьим билетом до конца жизни из химии. Не на того напали – недаром Майо был не просто учеником великого Хараша, а даже в некотором смысле его правой рукой. Эксперимент был сделан, как полагалось у Хараша – комар носа не подточит, безупречно. Более того, Майо заметил, что любые примеси – следы воды в HCl, ионы металлов со стенок прибора, ртуть из вакуумного насоса – очень сильно влияли на кинетику, снижая порядок до второго по HCl. 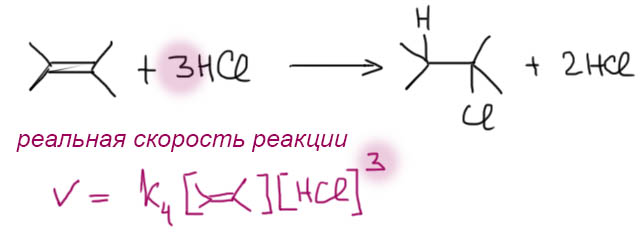
После этой работы кинетику взаимодействия HCl с разными олефинами изучали много раз, и все время получали нечто похожее – порядок по HCl от двух до четырех, не обязательно целый. Что это может значить, и какой механизм соответствует такой странной кинетике. Во-первых, поймем, что каков бы ни был кинетический порядок по любому из реагентов, сама реакция остается той же – одна молекула олефина реагирует с одной молекулой HCl с образованием одной молекулы продукта реакции.
Присоединение HBr.
Присоединение HBr – более быстрая реакция, чем присоединение HCl в сопоставимых условиях, но тоже не такая быстрая, как, например, бромирование. И закономерности те же – чем больше донорных заместителей, тем быстрее. И этилен точно так же не реагирует с HBr с заметной скоростью без катализатора, что установили еще сто лет назад Маас и Райт (JACS 1924, 46, 2664), и с тех пор никто не опровергал. Но пропилен уже реагирует довольно быстро даже при 0ºС.
Гидробромирование
Присоединение HBr – более быстрая реакция, чем присоединение HCl в сопоставимых условиях, но тоже не такая быстрая, как, например, бромирование. HBr – более сильная кислота, чем HCl, в том числе в малополярных средах, и это сказывается на скоростях реакций с олефинами. И закономерности те же – чем больше донорных заместителей, тем быстрее. И этилен точно так же не реагирует с HBr с заметной скоростью без катализатора, что установили еще сто лет назад Маас и Райт (JACS 1924, 46, 2664), и с тех пор никто не опровергал. Но пропилен уже реагирует довольно быстро даже при 0ºС.
Что касается механизма реакции HBr с олефинами, то здесь в целом закономерности такие же, как в случае присоединения HCl – это также согласованная несинхронная реакция, и в переходном состоянии точно также участвует более одной молекулы HBr. Большого смысла повторять то, что было подробно рассмотрено для HCl нет. Но в реакции с HBr есть другая интересная особенность, проявляющаяся, впрочем, не для всех олефинов, а только для алкенов с концевой монозамещенной двойной связью, наименее реакционноспособных в этой реакции, типа пентена-1, гексена-1, гептена-1. Но это и есть самые распространенные олефины, которые использовали для изучения реакции гидробромирования олефинов, особенно в давние времена.
И с этими олефинами случилась немного комическая и почти детективная история, отголоски которой можно встретить и в самых недавних книжках и статьях.
Реакция присоединения HBr и других галогеноводородов к олефинам известна очень давно, почти с самого начала органической химии как науки, с середины 19 века. И часто можно прочитать, что именно её Владимир Марковников использовал для установления своего знаменитого правила. К счастью, это не так. Марковников использовал данные по присоединению HI, а не HBr. Неужели это так важно? Да, потому что HBr к простым олефинам присоединяется очень странно. Если олефин ди или тризамещенный, то получается вполне ожидаемые по правилу Марковникова и представлениям об электрофильном присоединении продукт. Но если это простой олефин, то просто беда: у одних получается ожидаемый продукт, у других – против правила Марковникова.
В проблеме в начале 1930-х взялся разобраться Моррис Хараш, один из самых крупных химиков середины прошлого века, и один из фактических создателей теории органической химии, которой мы с тех пор и пользуемся. И, кстати, как и Браун, тоже выходец из Российской империи приблизительно из тех же мест и тех же времён, немного только постарше. По тщательности и дотошности Харашу не было равных: статьи по исследованию реакции олефинов с HBr на десятках страниц описывают многочисленные эксперименты по влиянию всего на свете на результаты этой реакции. И он установил, что антимарковниковский продукт образуется всегда в присутствии свободнорадикальных инициаторов, которые можно или специально добавить, или даже этого не делать, но использовать олефин, который имел контакт с воздухом, например, просто долго стоял в неполностью заполненной банке. Свободнорадикальная реакция с кислородом, подробно разобранная на страничке про Алканы, даёт гидроперекиси, которые понемногу накапливаются в олефине.
Эти гидроперекиси являются инициаторами свободнорадикального замещения, так как содержат слабую связь кислород-кислород. Инициирование осуществляется за счёт самопроизвольного распада этой связи. Естественный вопрос – а как же перекись тогда накапливается, если она такая неустойчивая. Ответ простой – накапливается быстрее, чем распадается. Для инициирования цепной реакции достаточно очень маленького количества радикалов. Дальше всё просто.
Хараш установил, что если олефин тщательно очистить от перекиси, или проводить реакцию в присутствии ингибиторов – веществ, которые очень легко реагируют с любыми радикалами, выводя их из реакции, то присоединение HBr даёт исключительно
Меньше чем через год вышла статья Мэри Шеррил и двух соавторок, в которой все достижения Хараша были беспардонно поставлены под сомнение. Я акцентирую внимание на то, что статья эта была написана тремя женщинами просто как на забавный курьёз – в те времена в химии и одну женщину найти было непросто. Но это была замечательная статья, очень аккуратно сделанная, и ставящая очень острые вопросы. В наше время это уже почти не принято – пытаться опровергнуть результаты и выводы других исследователей, а тогда научная жизнб была поживее, и сами учёные не чурались открытых споров.
была описано, что присоединение HBr к 1-алкенам происходит с образованием практически исключительно 1-алкилбромидов. Были предприняты экстраординарные меры, чтобы получить особо чистые 1-алкены: их синтезировали прямо перед исследованием и дополнительно несколько раз перегоняли над металлическим натрием, в отсутствии перекисей удостоверялись тестами. И такие олефины присоединяли HBr в органических растворителях (гептане, уксусной кислоте). Продуктами этих реакций были 1-алкилбромиды, по уверению авторок, чистейшие. В реальности, в этом трудно было удостовериться так надёжно, потому что в 1934 всё устанавливали только с помощью выделения продуктов и установления их физико-химических параметров (температуры кипения, показателя преломления, прямо как мы в пратикуме, только рефрактометр у них был работающий и тщательно настроенный). Даже если принять, что небольшую примесь 2-бромалканов они упустили, всё равно результат был вполне однозначный – продукты присоединения против правила Марковникова вроде бы не нуждаются в свободнорадикальных инициаторах типа перекисей. Скандал! Неужели Хараш ошибся? Хараш страшно обиделся и написал ответ, ещё раз перепроверив все свои результаты – типа, работать не умеете, перекись упустили, и что он там про себя ещё добавил, история умалчивает. Он был несправедлив – работать Шеррил с соавторками умели отлично, может быть только самому Харашу немного уступали. Их работа, хотя и невольно показала одну очень важную вещь – для того, чтобы присоединение пошло по Харашу, нужны настолько незначительные примеси перекисей, что обычные методы очистки и определения примеси перекисей просто не работают. Если олефин контактировал с воздухом хотя бы полчаса, скорее всего этого будет достаточно. К тому же Шеррил допустила очень распространенную ошибку – для очистки от перекисей они перегоняли олефин над металлическим натрием, даже несколько раз. Проблема в том, что натрий в олефине не растворяется, и реакция с примесями идёт на его поверхности, а поверхность невелика, и у молекул перекиси в таких условиях есть немаленькая вероятность с этой поверхностью прост о ни разу не встретится. То же самое, кстати, происходит, когда натрий используют для сушки растворителей – просто добавить в растворитель натрий и тут же перегнать совершенно неэффективно, большая часть воды уйдёт в перегнанный растворитель. Для повышения эффективности натрий нужно либо как-то обработать для увеличения его поверхности (его давят в такие листочки, и в проволоку, или разбивают в мелкий песок), и дать растворителю постоять над таким натрием подольше (осторожно: выделяется водород и банку или колбу с такой смесью нельзя герметично закрывать!). То есть получается, что Шеррил с сотрудницами всё-таки допустили некоторые ошибки, но то же самое сделали бы большинство других химиков, вне зависимости от гендерной и национальной принадлежности.
Почему присоединение по Харашу стоит избегать при решении задач
Присоединение по Харашу, как мы успели убедиться, не просто работает, а часто и перехватывает инициативу у обычного электрофильного присоединения. Вроде бы мощная вещь. И простая. И есть в ней что-то такое, что не можно глаз отвесть, днём свет божий затмевает, и т.п. Я не знаю почему, но есть в этой реакции какая-то магия. Единожды её увидев, студент не может её забыть и применяет везде, где можно и нельзя. Жаль, что пресловутые британские учёные еще не раскрыли природу этого социологического или психологического явления, а у меня нет объяснения, есть только многолетние наблюдения.
Но использовать его для решения задач я не рекомендую, и вот почему. Это далеко не универсальный метод. Фактически он работает только для монозамещенных алкенов, и только в том случае, когда этот единственный заместитель – углеводородный остаток (возможно, замещенный, но не на первом же атоме углерода). Для ди-, три- и тетразамещенных алкенов метод Хараша совсем не работает. Для всяких хитрых монозамещенных алкенов тоже. Даже для банального стирола (фенилэтилена) он работает плохо – в самых оптимальных условиях образуется до 20% марковниковского продукта. В принципе, понятно почему – свободнорадикальное присоединение выигрывает конкуренцию у электрофильного только если последнее идёт медленно. И мы должны в каждом случае попытки применения метода Хараша это анализировать, и думать так это, или не так. Не много ли чести? Хараш, безусловно, великий учёный, к тому же, как и Браун, наш почти соотечественник, но всё хорошо в меру.
Вместо метода Хараша используем гидроборирование с последуюшим замещением бора на бром, то есть как раз метод Брауна. Браун, кстати, еще и в каком-то смысле ученик Хараша, и в этом смысле и во многих других превзошёл учителя.
После всех этих рассуждений о сограсованных механизмах присоединения к двойной связи не может не возникнуть ощущение неудовлетворённости. Классический механизм очень понятен и удобен: найдите электрофил, присоедините к двойной связи двумя способами, получите два карбокатиона, проанализируйте их относительную устойчивость, из этого анализа выберите один более стабильный и следовательно тот углерод двойной связи, к которому и присоединится электрофил, а карбокатион заткните нуклеофилом – продукт готов. И заодно становится понятно, какой олефин более реакционноспособен, а какой менее. И многие другие вещи. Много раз уже сказано, что химии проще судить о заряженных частицах, катонах и анионах.
Но получается так, что в реальности всё происходит не так, и нет никаких карбокатионов, и всё присоединяется в одной стадии А как же тогда судить о том, как идёт реакция.
Эта малоприятная проблема очень часто возникает в органической химии. Как судить о согласованных механизмах? На самом деле всё очень просто, хотя и немного смахивает на мошенничество. К этому приходится прибегать. Современная органическая химия вообще предпочитает согласованные механизмы многостадийным с участием неустойчивых частиц типа карбокатионов. Активным исследованиям механизмов скоро исполнится сто лет, и за это время накопилось множество данных, заставляющих со всё большим сомнением смотреть на возможность образования малоустойчивых и высокореакционноспособных интермедиатов в реакциях. Лет 50 назад рисовать, скажем, этильный катион было вполне нормально, естественно, со всеми оговорками, что это очень активная частица и т.п. Но как иначе присоединить воду к этилену? Сейчас на такую интерпретацию механизма решатся немногие, потому что никаких доказательств возможности даже чрезвычайно кратковременного образования такой частицы получено никем не было. В очередной раз оговорюсь – речь идёт только про реакции в растворах, о газовой фазе мы не говорим, там всё возможно, и метильный катион там не проблема.
Подход к согласованным механизмам может быть таким. В согласованном механизме ключевую роль играеют не интермедиаты, а структура и энергия переходного состояния. В любой согласованной реакции переходное состояние одно и только одно. В переходном состоянии всегда задействованы связи, затрагиваемые реакцией. В присоединении к двойной связи это разрываемая π-связь, образующиеся связи углерода с электрофилом и нуклеофилом, и, возможно, какие-то связи внутри молекул, поставляющих электрофил нуклеофил. Фокусв том, что нигде не написано, что все эти связи образуются и рвутся совершенно синхронно. Если бы это было так, нигде не образовывались бы заметные заряды, ничто не напоминало бы катионы и анионы, а вся реакция развивалась бы с идеальной слаженностью молекулярной машины.
Так бывает? Бывает, но очень редко, в основном во всяких модельных и бесполезных процессах, в которых шило меняется… на шило же. А мыло на мыло. Такие процессы называются вырожденными, их часто используют для большой науки, исследуя или теоретически, или экспериментально, напрмер, с помощью изотопного маркирования, не изменяющего химической природы частиц, но позволяющего их различить. Шило меням на изотопно меченое шило.
В реальных процессах, типа замены шила на мыло, трудно представить себе идеальную синхронность. Тогда мы можем иметь дело с почти синхронностью: связи образуются и рвутся не строго одновременно, а с небольшими опережениями и отставаниями, но так, что в переходном состоянии всё равно нет заметных зарядов на атомах. На энергию таких переходных состояний (напомню, что с энергией переходного состояния связана энергия активации, а следовательно и скорость реакции – чем ниже энергия, тем меньше энергия активации и больше скорость) слабо влияют все факторы, которые мы использовали бы для объяснения стабилизации катионов и анионов – электронные эффекты заместителей, влифние растворителя или среды. А больше всего влияет стерика – удобство подхода реагентов друг к другу, возможность того, чтобы они расположились друг относительно друга максимально близко и в той ориентации, которая отвечает целям реакции – образованию и разрыву именно тех связей, которые нужны. Как мы уже знаем, именно так устроено, например, гидроборирование.
Аллильное бромирование (бромирование по Волю-Циглеру)
Аллильное бромирование олефинов, имеющих так называемые аллильные атомы водорода – чрезвычайно полезная и важная реакция. Она позволяет нам в олефинах добраться до еще одного места в молекуле. Почти все реакции олефинов – это реакции по двойной связи, реакции присоединения, этих реакций много, очень много, а в совсем современной химии их просто ошеломляющее количество. Двойная связь является главным и основным реакционным центром в олефинах. Но, к счастью, не единственным. Еще в олефинах можно добраться до так называемого аллильного положения, то есть до атома углерода рядом с двойной связью, но только в том случае, если на нём есть атомы водорода. Реакций по таким атомам немного, но и не одна единственная, и главной реакцией является аллильное бромирование по Волю-Циглеру, происходящее при действии одного единственного реагента, N-бромсукцинимида (NBS или по-русски можно NБС, а вот НБС нельзя, и нигде вы этого не увидите) и в очень определенных условиях. Эта реакция очень интересна не только своей полезностью в синтезе, но и тем, что она практически никак не изменилась с времен ее создания. Это исключительно удивительно: исторических и именных реакций в органической химии полно, по практически все они в современной химии выглядят совсем не так, как были придуманы – для каждой предложены десятки и сотни вариантов, новые реагенты, целые книги описывают их современные варианты и расширения. И только реакция Воля-Циглера и сегодня выглядит точно так же, как в оригинальной статье Карла Циглера 1942 года – тот же и реагент, и растворитель, и условия реакции за единственным исключением инициатора. И за 70 с лишним лет ничего лучшего придумано не было, хотя, видит бог, пытались и неоднократно, хотя бы потому что растворитель в этой реакции, четыреххлористый углерод, считается в современном мире неприемлемым из-за высокой токсичности. Увы, все варианты, которые за это время предложили на замену в аллильном бромировании не работают (у реакции Воля-Циглера есть и второе применение – бензильное бромирование, и в этой области вариантов гораздо больше и CCl4 вовсе не обязателен).
Разберемся в этой реакции поподробнее, чтобы понять, отчего она такая уникальная, и какие у нее проблемы, но сначала, как обычно краткое резюме, а потом для желающих подробный разбор. На страничке про методы есть краткое изложение практического применения этой реакции.
- Реакцию проводят действием N-бромсукцинимида в кипящем четыреххлористом углероде с добавлением небольшого количества свободнорадикальных инициаторов, перекиси бензоила или бис-азоизобутиронитрила (АИБН). Инициирование светом (хорошей мощной лампой накаливания или современными светодиодами, лучше синими) возможно, но применяется относительно редко.
- Реакцию можно делать и без инициаторов, но время реакции (а его определяют очень точно – в этот момент уходит желтоватый цвет брома, а осадок тяжелого бромсукцинимида всплывает, превращаясь в легкий сукцинимид) при этом непредсказуемо, выходы меньше, а количество побочных продуктов, в первую очередь, просто продукта присоединения брома к двойной связи – больше.
- Реакция имеет свободнорадикальный механизм, и реальным реагентов в ней является молекулярный бром, образующийся сначала при медленном разложении NBS, а в ходе реакции при взаимодействии NBS и выделяющемся в реакции HBr.
- Реакция протекает через образование мезомерно-делокализованного аллильного радикала, который забирает атом брома у молекулы брома, второй атом брома дальше ведет цепной радикальный процесс.
- Реакция может быть неселективной и давать смеси продуктов по двум причинам – и из-за делокализации неспаренного электрона по двум атомам углерода, которые могут оказаться структурно различными, и в тех случаях, когда исходный олефин имеет несколько разных аллильных положений. В первом приближении эта проблема непреодолима, и таких ситуаций следует избегать, но в реальной жизни аллильное бромирование довольно часто бывает вполне селективно, и есть несложные правила, которые позволяют достаточно точно предсказывать основной продукт реакции.
Реакция Воля-Циглера с нудными подробностями
Аллильное бромирование называется реакцией Воля-Циглера, и в 2019 году, когда пишется этот текст, ей испольнилось сто лет, всего сто лет или целых сто лет. Это интересный пример того, как в химии появляются именные реакции, и какие имена остаются в истории. Работа Альфреда Воля 1919 года, весьма известного немецкого химика, с которым мы еще встретимся в углеводах, описывает реакцию N-бромацетамида с одним олефином с образованием бромпроизводного аллильного типа. 
В те времена результаты описывали очень приблизительно, и непонятно, единственный ли это продукт, и даже насколько точно определена его структура. Но это не важно, потому что описанная реакция вообще не имеет никакого отношения к аллильному бромированию – это просто единичный пример электрофильного бромирования с E1-элиминированием и, возможно, аллильной перегруппировкой. Совсем недавно очень похожую реакцию стали использовать для аллильного хлорирования, но об этом где-нибудь в другом месте. И все же – прецедент был создан, показано, что бромирование непредельного соединения может идти не только как присоединение, но и как замещение. И ещё – было привлечено внимание к новому, для того времени, типу реагентов – галогенпроизводным с галогеном на атоме азота, N-галогенамидам. Это очень принципиальное открытие, у которого будет очень плодотворное продолжение не только в виде аллильного бромирования, но и в виде химии так называемых производных “положительного галогена”, переживающей сейчас бурный расцвет. Поэтому работа Воля – характерный пример внешне скромной работы на перспективу. Важно то, что сам исследователь, работающий в свое время и со своими возможностями, редко может догадаться, что его конкретная работа “заиграет” много позже, возможно, когда его самого уже не будет на свете (Воль умер в 1939 сразу после начала Второй мировой войны, а работа Циглера появилась через три года в год двух ключевых сражений Второй мировой войны – Сталинграда и Эль-Аламейна).
На работу Воля действительно никто внимания не обратил. Единичная реакция это еще не метод, которым можно пользоваться для того чтобы решать свои задачи. Но цель – найти метод введения галогена в аллильное положение алкенов – была очень заманчива, тем более что важность и интерес к очень реакционноспособным аллильным галогенпроизводным была вполне осознана. Циглер решил попробовать разобраться, что нужно сделать для того, чтобы аллильное галогенирование стало настоящим методом, и подошел к делу весьма основательно, получив с десяток разных N-галогенамидов, и всех их испробовав в разных условиях с одним типичным алкеном, циклогексеном. Выяснилось, что ни N-бромацетамид, который был у Воля, ни почти все остальные не дают ничего хорошего, только смеси продуктов в основном присоединения. Только один реагент, полученный впервые Циглером N-бромсукцинимид, и только в одном случае – при кипячении с использованием четыреххлористого углерода в качестве растворителя (температура кипения 77ºС), приводил к образованию аллильного бромпроизводного. Даже очень близкий аналог, N-бромфталимид, работал плохо и неселективно. 
Работа Циглера не может не восхищать. В те времена методов исследования органических соединений было еще очень мало, и в основном все делалось по-старому: реакция ставилась с серьезных количествах, и продуукты выделялись перегонкой или перекристаллизацией и идентифицировались, сравнением с уже известными веществами, или дополнительными реакциями, превращавшими новые продукты с известные вещества. На каждую реакцию уходила пропасть времени. И как в таких условиях (а уже и бомбы начали падать, а студентов и аспирантов пачками отправляли на Восточный фронт в один конец) можно было найти единственный(!) работающий реагент и единственные(!!) условия работы этого реагента?? Невероятно и потрясающе, следствие колоссального опыта и интуиции.
Работа Циглера немедленно привлекла внимание – методом стали пользоваться для решения задач синтеза, попытались разобраться в том, как он работает и нельзя ли его расширить. Уже в 1948 Джерасси опубликовал весьма подробный обзор по применению метода, им же и названного именами Воля и Циглера, на 125 цитированных работ, но понимания того, как работает метод и почему так важно “условие Циглера” – использование одного единственного растворителя.
Механизм реакции. Реакция аллильного бромирования появилась как раз тогда, когда создавалась теория механизмов органических реакций, и за нее тут же взялись, как за хороший пример цепной свободнорадикальной реакции. На первый взгляд, здесь все настолько просто, что может служить просто тренировочной задачей на усвоение учебного материала. Реакция свободнорадикальная? Да, значит ищем первичный источник радикалов – способ инициирования. Ищем самую слабую связь, как мы это делали в Алканах. Очевидно, что связь N-Br просто сама просится на эту роль. Отлично, рвём, получаем радикалы брома и сукцинимидоила с точкой на азоте. Думаем, кто из них поведет цепь – кому выгоднее оторвать атом водорода. Тоже очевидно – связь NH гораздо прочнее связи BrH, и ее образование даст гораздо больший энергетический эффект (все эти нехитрые закономерности мы уже рассматривали). Ну а как дальше развивается цепь настолько очевидно, что можно сразу писать. Так и было сделано. Этот очевидный механизм часто называют по имени первого исследователя, который не поленился это записать – механизм Блумфилда (C. F Bloomfield, J. Chem. Soс., 1944, 14) – и опять трудно удержаться от комментария, что в это же самое время соотечественники англичанина Блумфилда усердно ровняли с землей тысячами тонн авиабомб важный промышленный центр Рурской области Мюльхайм, в котором Циглер только что возглавил научный институт – институт, кстати, чудом не пострадал. Война войной, но научные статьи выходили не менее регулярно чем в наши дни. В общем – вот основные стадии механизма Блумфильда (неправильного!). Для краткости остов сукцинимида обозначим как Z. 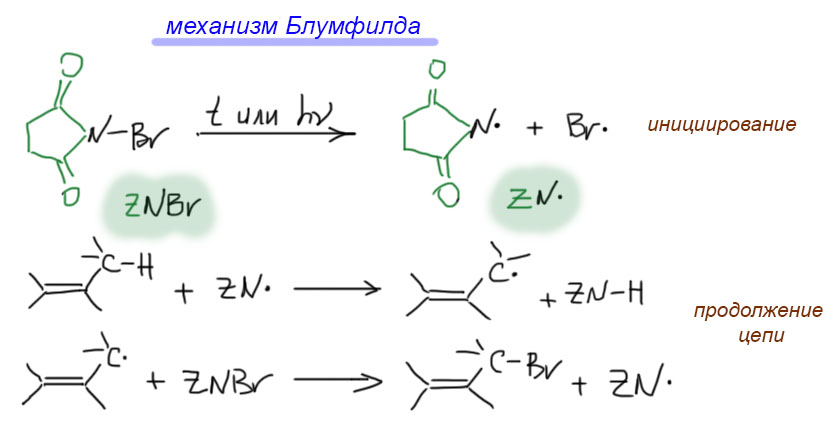
Поскольку механизм вполне очевидный, то с ним естественно согласились, и он стал жить своей жизнью, попав в учебники. Но некоторых проницательных исследователей он не удовлетворил. И мы с нимы бы согласились. Мы же настаиваем на одной важной вещи – механизмы пишутся не просто так, чтобы место в учебнике заполнить, а для того чтобы объяснять особенности реакции. И вот с этим сразу стало нехорошо. Воот например, как этот механизм объясняет “условие Циглера”? Да никак не объясняет. А как этот механизм объясняет, почему из дюжины испробованных N-галогенамидов работает только NBS? Любой N-галогенамид имеет слабую связь N-галоген и тоже должен инициироваться теплом или светом. И цепь так же будет выглядеть. Но нет, не работает. Далее, посмотрим на основной радикал, который начинает цепь. Это радикал с точкой на азоте, и такой радикал должен быть очень активен (опять рекомендую посмотреть в теме Алканы обсуждение реакционной способности радикалов в отщеплении атома водорода), а значит не очень селективен. Но реакция Воля-Циглера просто удивительно селективна, об этом отдельно. Это очень непохоже на картину, которая получилась бы при действии радикала на азоте, и много позже это было выяснено экспериментально, – действительно, всё было бы не так, никакой селективности не было бы.
Первую гипотезу о том, как на самом деле идёт бромирование по Волю-Циглеру высказал опять британский кинетик Голдфингер (не имеет никакого отношения к третьему фильму про Джеймса Бонда) в удивительно мутной статье, просто на основании общих соображений о кинетике процесса. Поскольку в дальнейших, уже экспериментальных исследованиях гипотеза была подтверждена сразу несколькими независимыми группами, механизм стал общепринятым, и его так и называют – механизм Голдфингера. Механизм прост как табуретка. Это просто свободнорадикальное бромирование молекулярным бромом при двух важных условиях:
- концентрация брома очень мала, в самом начале реакции это просто примесь брома в исходном N-бромсукцинимиде, она всегда в нем есть даже если он очищен перекристаллизацией прямо перед использованием
- бром в малой концентрации снова появляется из-за очень легкой реакции HBr, выделяющегося при бромировании, с N-бромсукцинимидом
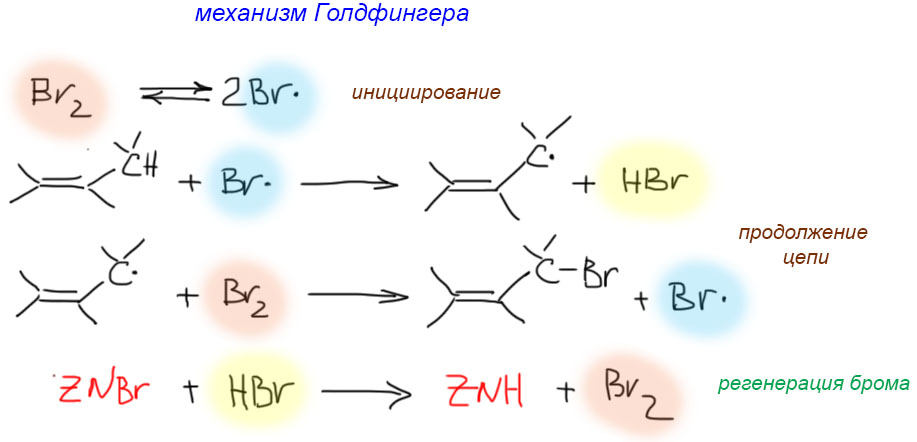
Инициаторы реакции. В принципе, реакцию можно вести только с термическим инициированием – при кипячении, но это долго и увеличивает долю побочных реакций. Именно так делал сам Циглер в основополагающей работе, и нашел, что скорость реакции очень сильно зависит от олефина – некоторые реагировали у него за 5 минут, а некоторые за 15 часов, причем было совершенно не понятно, от чего это зависело. Это неудобно. Но Даубен и Мак Кой однажды совершенно недвусмысленно показали (Dauben, MсCoy, J. Org. Chem. 1959, 24, 1577), что эта реакция совершенно обязательно нуждается в инициаторах, и если их не положить специально, то в этом качестве просто выступают обычные примеси перекисей в исходных олефинах, и естественно содержание таких примесей совершенно случайно, отчего и непонятные времена реакции. Это ровно та же история, что и в присоединении HBr против правила Марковникова – примеси перекисей в непредельных углеводородах очень сложно вычистить полностью и небольшое количество почти всегда присутствует, если не применять совсем уж драконовские процедуры очистки и после этого не допускать даже минутного контакта с воздухом. И этого количества может быть достаточно и для присоединения HBr против Марковникова, и для аллильного бромирования. А может и не быть достаточно. Поэтому результаты такого случайного инициирования предсказать очень трудно, и рассчитвать на них не рекомендуется. В реакции Воля-Циглера всегда советуют использовать добавленный инициатор, а что советуют п присоединении против Марковникова, мы рассмотрим в своем месте.
Поэтому принято добавлять стандартные инициаторы (на страничке про Алканы можно вспомнить что это) – перекись бензоила или АИБН. Также возможно инициирование светом, обычной лампой видимого света, желательно помощнее, причем это еще одно доказательство того, что настоящий реагент в этой реакции – молекулярный бром, а не сам NBS, так как последний сам по себе бесцветен и видимый свет практически не поглощает. Если быть совсем точным, то небольшой хвостик от ультрафиолетовой полосы поглощения в видимой области у NBS все же есть (ChemPhotoChem 2018, 2, 938), и этим объяснятся то, что на свету этот реагент медленно разлагается и окращивается в оранжевый цвет молекулярного брома, но для инициирования этого было бы недостаточно. Если посмотреть реальные методики, то становится ясно, что чаще всего используют один из двух классических инициаторов, по принципу “что под рукой”.
А можно сделать аллильное хлорирование или иодирование? В условиях реакции аллильного бромирования нет, нельзя. Есть полные аналоги NBS – N-хлорсукцинимид и N-иодсукцинимид, а также множество аналогов. Но реализовать что-то похожее на аллильное бромирование несмотря на длительные усилия не получилось. С иодированием все ясно сразу, и отсылаю вас к свободнорадикальному галогенированию алканов – энергетика стадий реакции не велит. Как ни инициируй реакцию, атомы иода всегда действуют как ингибиторы радикальной цепи. Разговаривать не о чем.
Другое дело хлорирование. Но и тут все плохо. Дело, скорее всего, в чрезвычайной легкости реакции свободнорадикального присоединения хлора к двойной связи. Поэтому если у нас есть атомы хлора, они предпочтут присоединение, а не отрыв атома водорода, и реакция пойдет по другому пути с образованием продуктов присоединения. В то же время, аллильное хлорирование очень простых алкенов типа пропилена осуществляют в промышленных условиях при высокой температуре.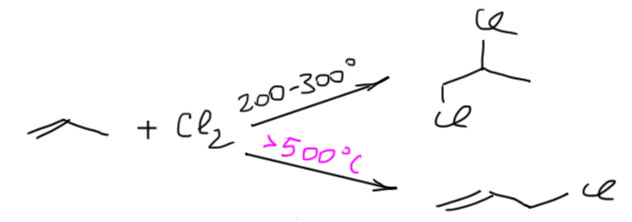
Реакция эта – отличный пример прямого аллильного галогенирования и конкуренции двух путей реакции атома галогена с алкеном – присоединения к двойной связи и отщепления атома водорода. При более низких температурах преобладает присоединение, при более высоких – отщепление. Дальше все идет просто как обычная цепь свободнорадикального хлорирования, ничем не отличающаяся от хлорирования алканов. 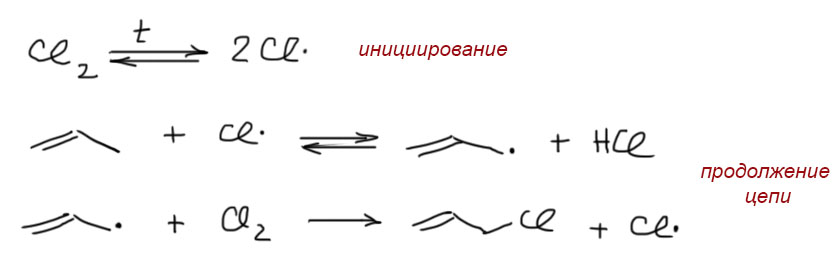
Естественно можно задать вопрос, отчего атом хлора при меньших температурах предпочитает присоединяться, а при высоких – отдирать атом водорода. Ответом на этом вопрос должно быть детальное исследование кинетики и термодинамики обоих процессов, а это очень редко реально делают, так как это чрезвычайно трудоемкая (и немножко бессмысленная) работа. Чисто на словах картина должна быть, скорее всего, такой: у каждой из стадий обоих процессов есть константы скорости, и они зависят от температуры. Температурные зависимости констант скоростей различны – одна может расти быстрее другой, у каждой есть своё уравнение Аррениуса со своими параметрами. Пока оставим это в стороне. Важно то, что если при одной температуре одна реакция быстрее второй, но скорость второй реакции сильнее зависит от температуры, то при повышении температуры вторая реакция рано или поздно обгонит первую. Это обычная история, но в обычной работе мы редко имеем возможность изменять температуру больше чем на 100-150 градусов. А в газофазной реакции в промышленных реакторах температура ограничена только началом термического разложения реагентов. Органика плохо выдерживает температуры выше 250-300º за исключением или очень простых соединений на 3-4-5 атомов углерода, или всякой ароматики, поэтому в этом смысле разгуляться некуда. Так и это высокотемпературное хлорирование максимум, куда можно сунуться с температурой за 500º, это 4-5 атомов углерода. Поэтому нам очень важно понять, что эта реакция совершенно не годится для лабораторного синтеза и никак не обобщается на другие алкены.
В учебниках иногда пишут, что высокотемпературное аллильное хлорирование идет через образование продукта присоединения и термическое элиминирование HCl. Это не так, и это было давно установлено теми же английскими исследователями, которые и обнаружили саму реакцию аллильного хлорирования (G.W.Hearn et al., Industrial Engeneering Chemistry, 1939, 31, 1530). Дело в том, что такое элиминирование HCl из 1,2-дихлорпропана действительно идёт, но не дает хороший выход аллилхлорида из-за образования второго продукта (1-хлорпропена), поэтому в промышленности реакцию специально ведут так, чтобы присоединение не происходило – перед смешиванием нагревают оба газа до 300º и только после впрыскивают их в камеру с 500º – тогда образуется чистейший аллилхлорид почти без побочных продуктов.
Очень хорошее подтверждение того, что аллильное хлорирование при высокой температуре идет как цепная свободнорадикальная реакция получили (G.W.Hearn et al., J. Am. Chem. Soc., 1953, 75, 1392), когда в реакцию ввели вместо пропена, 2-бутен. Получилась весьма типичная смесь аллильных хлоридов, объясняемая мезомерной делокализацией радикала. 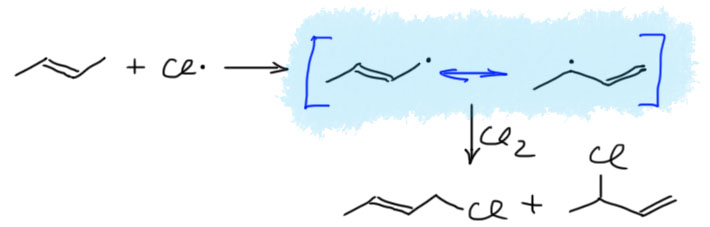
И даже еще лучше, когда попробовали хлорировать изомерные аллиллорид и 1-хлорпропен – они дали одинаковую смесь двух продуктов, что ясно говорит о том, что радикал по дороге из обоих исходных алкенов получается одинаковый, мезомерно стабилизированный. 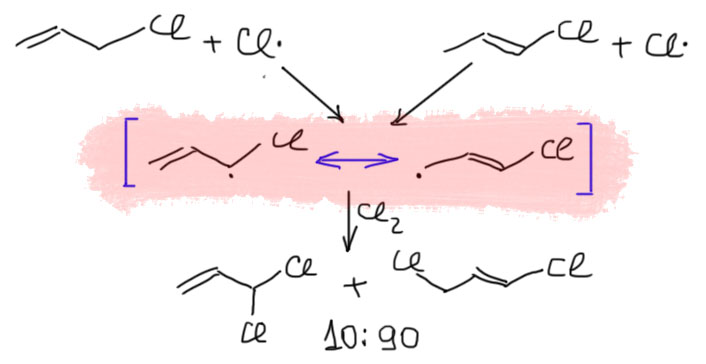
Что получается в реакции Воля-Циглера
Реакция аллильного бромирования очень часто используется в синтезе, но парадоксальным образом до сих пор никто толком не не понимает, что от нее можно ожидать. Эта важная и популярная реакция парадоксально недоисследована. Споры о механизме, увенчавшиеся принятием механизма Голдфингера в начале 1960х, практически заглохли, хотя до сих пор время от времени находятся желающие отстаивать другие механизмы, но внимания никакого никто на них не обращает. Большая часть примеров применения этой реакции описана в довольно старой литературе 50-60х годов прошлого века, и там не всё хорошо сделано, часто просто выделялся основной продукт, составляющий во многих случаях не более 40-50%, а всем остальным просто пренебрегали. Некритическое отношение к таким данным приводит к тому, что в и в более свежей литературе много откровенно ошибочных представлений о том, как эта реакция идёт, и что даёт. Если в вашей будующей карьере исследователя когда-нибудь найдётся немного времени и возможностей, займитесь этой реакцией с использованием современных методов, и наконец разберитесь с тем, как она идёт и что даёт. Потомки вас не забудут. Пока же мы вынуждены просто пытаться обобщить примеры применения этой реакции в литературе, и поискать закономерности.
Прежде чем углубиться в такой кустарный анализ, повторю простой и практичный совет. На странице про Методы написано, что не рекомендуется применять ее к несимметрично-замещенным олефинам, потому что мезомерно делокализованные аллильный радикалы, а в несиметричном случае их может получится несколько, теоретически должны давать смесь большого количества продуктов бромирования. И я очень советую прислушаться к этому совету, и не искать приключений. На этом месте можно было бы поставить точку, более не злоупотреблять вашим вниманием здесь, а перенести это занятие в другой раздел органической химии.
Но если бы это действительно было так, реакция аллильного бромирования имела бы очень узкое применение, потому что симметричных олефинов не так много. Дело даже не в симметричных олефинах, а в делокализации аллильного радикала. Даже такие простые олефины, как 1- или 2-бутен дали бы по два продукта каждый, например: 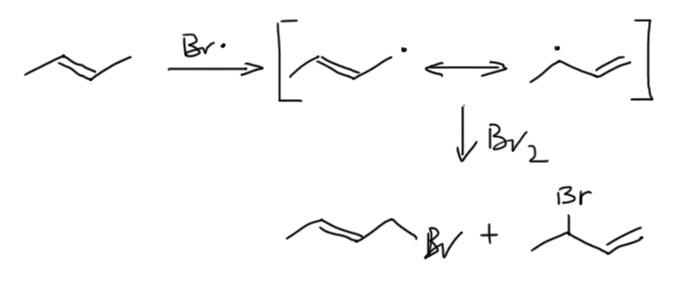
Так это или не так, трудно сказать, потому что этого кажется, никто не делал, скорее всего, потому что кипятить с обратным холодильником раствор бутена довольно трудно – он просто улетит, а под давлением реакцию Воля-Циглера не делают.
Понятно, что если олефин хоть немного сложнее, нас ждут проблемы – много проблем. Попробуем, из общих соображений взять что-нибудь не очень мудрёное, и подумаем, что должно получиться. Попробуем, например, 1-метилциклогексен. В этом улкене три разных аллильных положения, и каждый аллильный радикал мезомерно делокализован. Выпишем все возможные продукты. Атом водорода можно оторвать или от вторичного положения, и таких варианта два, или от первичного. Каждый из этих радикалов делокализован, и у одного вторичного радикала две граничные структуры одинаковы, у второго – разные. И две граничные структуры есть у радикала, полученного отрывом водорода от первичного положения. И при взаимодействии этих радикалов с молекулой брома должны были бы получиться пять разных продуктов – и это было бы совершенно бессмысленно. Смеси 5 продуктов никто никогда не разделяет – это себе дороже. Смертный приговор? 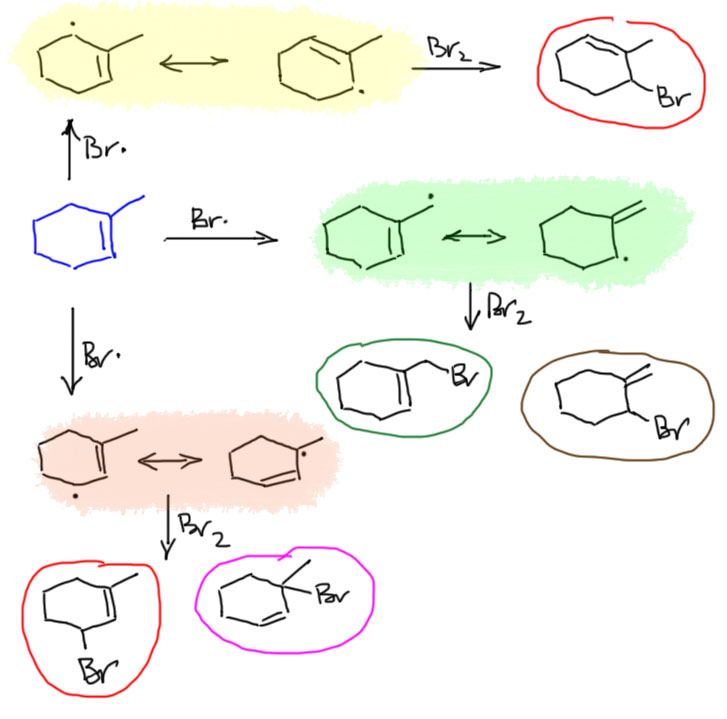
Но получается в реальности только два продукта – тех, что обведены красным. Лучше бы один, конечно, но и два тоже неплохо. Смеси двух продуктов уже можно разделять, это непросто, и нам не по силам, поэтому я везде и всегда в нашем курсе настойчиво призываю такие реакции не использовать. Но в практике синтеза на это часто идут, если во всех остальных отношениях реакция привлекательна – дает большой суммарный выход, легко выполняется, недорога, и т.п.
Попробуем разобраться, почему наши ожидания и предсказания так разошлись с действительностью. Дело, видимо, в двух основных факторах:
- довольно высокой селективности реакции отщепления атома водорода атомом брома. Мы разбирали это в химии свободнорадикального галогенирования алканов, просто напомню, что у этой реакции очень небольшой энергетический эффект – прочности связей C-H и Br-H довольно близки, а так как прочность связей C-H довольно сильно зависит от того, первичный, вторичный или третичный радикал при этом образуется. Метафорически выражаясь, атом брома хорошо различает между сортами C-H связей, предпочитая третичные вторичным, а вторичные первичным. Третичных у нас в этом примере нет, но из этого понятно, почему не образуется первиный радикал и два продукта из него. Пять минус два равно трём. Уже неплохо. И в качестве бонуса, замечу, что это еще и дополнительный довод в пользу механизма Голдфингера, потому что если бы цепь вел не радикал брома, а радикал из сукцинимида, он не разбирал бы между первичным и вторичным положениями, потому что энергия связи N-H намного больше энергии связи Br-H. И еще понятно, что если бы существовал аналогичный процесс аллильного хлорирования, его селективность была бы намного ниже, и первичное положение тоже играло бы.
- стерическим фактором на стадии реакции аллильного радикала с молекулярным бромом: молекула брома весьма тяжелая, неуклюжая и пузатая, а реакция радикала с молекулой брома тоже имеет очень слабую энергетику, и это особенно будет заметно для мезомерно делокализованных радикалов, у которых плотность неспаренного электрона на атомах углерода понижена – он же делокализован, поделен в каких-то долях между двумя углеродами (еще раз напомню, что это не значит, что на атоме углерода сидит какой-то огрызок электрона, это нужно понимать, как вероятность найти неспаренный электрон на каждом атоме). Бром поэтому тоже очень селективен в реакции с аллильным радикалом, и просто не может подобраться к радикальному центру на третичном атоме углерода. Вот мы и убили продукт, обведенный цветом Барби. Всё, пять минус три равно двум. Эти два продукта проходят по всем параметрам, вот они и получаются.
Итак, в аллильном бромировании более сложных олефинов скорее всего получатся те продукты, которые соответствуют отщеплению водорода от вторичных положений, а продукты, соответствующие или отщеплению от третичных, или делокализации на третичные не образуются по стерическим причинам. Учтите только, что если в молекуле нет вторичных углеродов, но только первичные и третичные, то они будут реагировать, если в делокализованных аллильных радикалах в этих случаях есть стерически доступные не-третичные радикальные центры. Так можно упростить многие реакции аллильного бромирования. Попробуйте, например, найти единственный продукт аллильного бромирования а) 2-метилпент-2-ена, б) 1,2-диметилциклогексена; в) 2,3-диметилбут-2-ена.
Есть и еще одно соображение, которое стоит принимать во внимание – стабильность двойной связи в продукте. Если есть выбор, то в продукте получится более стабильная двойная связь – в делокализованном радикале будет преобладать граничная структура с более стабильной двойной связью:
- цис-двойная связь превращается в транс;
- если есть дополнительное сопряжение, то двойная связь будет стремиться к этому сопряжению;
- двойная связь, торчащая из циклов наружу (экзоциклическая двойная связь) будет стремиться заползти внутрь цикла.
Вот примеры таких реакций. Второй пример показывает, как два изомерных олефина дают один и тот же продукт, потому что двойной связи приятнее быть в сопряжении к ароматическому кольцу.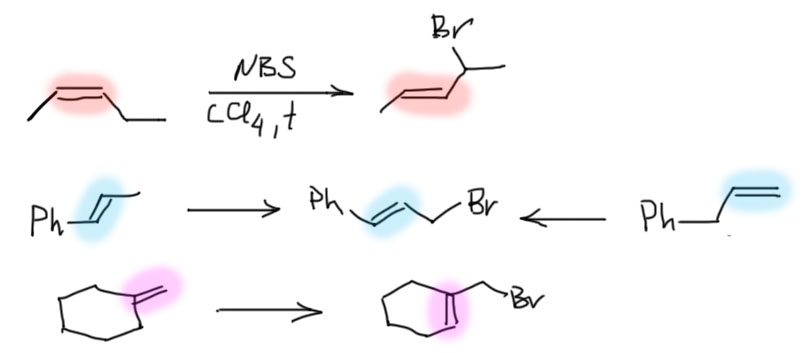
В конце упомяну еще одну засаду, которая подстерегает желающих разобраться в продуктах этой реакции. Эти продукты – бромпроизводные аллильного типа, и мы скоро с ними встретимся еще раз, в разделе про диены. И там выясним, что у них есть неприятная привычка перегруппировываться просто так, при хранении, и особенно при повышенной температуре. В диенах это приведёт нас к анализу кинетического и термодинамического контроля при присоединении галогенов и галогеноводородов к диенам, и там при хранении и при повышенной температуре образуются более термодинамически стабильные продукты того же самого типа – аллильные галогенпроизводные. Почему здесь должно быть иначе? В принципе, именно это и может быть причиной вот этих смещений двойной связи в продуктах, которые приведены на последней схеме. Это стоило бы проверить экспериментально, но, кажется, никто никогда этого еще не делал.
Присоединение HF к алкенам
Бывает ли гидрофторирование по аналогии с присоединением других галогеноводородов? Если бывает, то почему про это почти ничего не слышно?
Фтористый водород драматически отличается от всех остальных галогеноводородов. У него, в каком-то смысле, все наоборот. В водных растворах это относительно слабая кислота, но это-то нам как раз до лампочки – мы не делаем органических реакций в воде. В вот жидкий безводный фотористый водород – кислота очень сильная, близкая к 100%-ной серной (о том, что такое кислотность сильных кислот и что такое суперкислоты, можно почитать на страничке про кислотность), гораздо более сильная, чем остальные галогеноводороды. Если кому-нибудь придет в голову возражать, говоря, что HF получают действием обычной концентрированной серной кислоты на фториды, призываю не забывать про законы равновесий и про то, что HF – очень летучее вещество. Очень чистый фтористый водород, тщательно очищенный даже от следов воды и других примесей, как показал Джиллеспи, даже еще более кисёл – он вполне котируется как суперкислота, такая же как фторсульфоновая кислота, которая считается по кислотности начальной точкой множества суперкислот – все, что сильнее фторсульфоновой кислоты, называется суперкислотой (R.J.Gillespie et al, JACS, 1988, 110, 6053). Впрочем, и это тоже не очень важно, так как если его реально использовать, в нем придется что-нибудь растворить, и рекордная кислотность все равно просядет от суперкислоты до просто очень сильной кислоты.
Так что, если есть желание и возможность работать в жидком фтористом водороде – а это по-настоящему страшно, и требует специального оборудования и недюжинного экспериментального мастерства, – то в протонировании проблем не будет, олефины это точно запротонирует. Но дальше нам понадобится нуклеофил, а вот с этим в среде жидкого фтористого водорода все очень скверно. Фторид-иона там нет совсем, вместо него там водородно связанные полифториды типа иона HF2–, а это очень слабые нуклеофилы. К тому же, даже таких ионов там очень мало – равновесие автопротолиза имеет очень маленькую константу равновесия. Если мы к этому месту уже неплохо разобрались с поведением карбокатионов, должен раздаться возмущенный возглас – ну и что?! – карбокатион ест любые и не разбирается, съест, наверное и этот. Совершенно верно, съест, но все же нуклеофильность плотно прикрытых водородными связями ионов настолько мала, что конкуренцию им окажет сам олефин, и конкурентно пойдет полимеризация. Это очень похоже на проблемы в гидратации алкенов, которые мы уже разобрали. 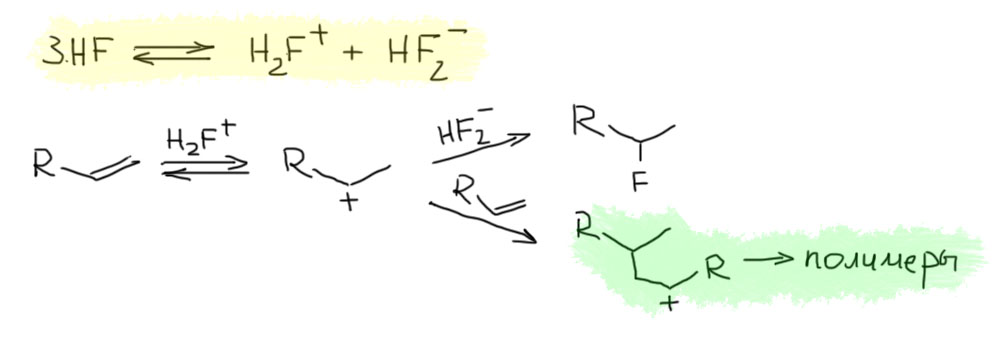
Эту реакцию попробовали сделать еще в 1938 году в США в лаборатории В.Н.Ипатьева, одного из крупнейших русских химиков, основоположника промышленной нефтехимии и катализа, успевшего ускользнуть в 1930 от почти гарантированной страшной гибели в годы террора – он прожил очень долгую жизнь и до 1917 года был не только крупным ученым, но и целым генералом – и эмигрировать в США, основав там одну из первых R&D-лабораторий исследования промышленных каталитических процессов. Простые олефины (этилен, пропилен, циклогексен и др.) реагировали с жидким фторстым водородом под давлением в специально изготовленных автоклавах, образуя с небольшим выходом ожидаемые продукты гидрофторирования наряду с полимерами (J.Org.Chem., 1938, 3, 26). С этиленом, кстати, и HF реагирует медленно, и для достижение приемлемых выходов приходилось или греть до 90ºС (представьте себе смертельный эксперимент – смесь этилена и HF нагревают под давлением много часов!). И точно так же, как для других галогеноводородов, реакция ускоряется кислотами Льюиса, но это приводит только к увеличению доли полимеризации. Немного позднее так же превратили ацетилены с продукты присоединения двух молей HF. Понятно, что повторять такую химию в обычной органической лаборатории никто бы не решился, и так это и оставалось в забвении на десятилетия, а органики оставались в убеждении, что HF присоединять к кратным связям невозможно, не нужно и пробовать, если жизнь дорога.
Блестящая идея, как изменить условия и добиться хороших выходов пришла к главному знатоку кислот и электрофилов Дж. Ола (кстати, тоже беженцу от советского тоталитаризма, только венгерской его разновидности). Главную проблему HF мы видим – у нее отличная кислотность, но в ней мало нуклеофила. Как повысить количество нуклеофила, не сильно провалив кислотность? Ответ прост и парадоксален, – нужно добавить основание, достаточно слабое (HF настолько сильная кислота, что все равно запротонирует) и в количестве недостаточном, чтобы депротонировать всю кислоту. Оставшаяся кислота обеспечит кислотность, а количество нуклеофила очевидно возрастет за счет депротонированной части кислоты. Так как HF – штука особенная, то депротонирование не дает фторид-ион, а дает вот те самые полифторид-ионы с фторами, взаимно связанными очень прочными водородными связями. При этом, заметьте, и кислотность все же уменьшается, остается высокой, но уменьшается. Это хорошо, потому что уменьшается скорость образования протонированного олефина, то есть карбокатиона. В чистой HF эта скорость была велика, а нуклеофила было мало, и карбокатиону ничего не оставалось, как реагировать с непрореагировавшим олефином и давать полимеры. В этой систем скорость будет меньше, а нуклеофила больше, и это благоприятно скажется на конкуренции с полимеризацией.
 Ола с сотрудниками перебрали несколько оснований и остановились на смеси пиридина и HF (30:70% по молям). Схема слева дает приблизительное представление о составе этой смеси, хотя в реальности вместо иона HF2–, в нем более сложные полимерные гидрофторид-анионы. Для этого тоже нужен чистый жидкий фотристый водород и оборудование для работы с этим ужасающим веществом, но после того как эта смесь сделана, она представляет собой вполне стабильную жидкость, с которой можно работать с разумными предосторожностями в очень простой и дешевой полиэтиленовой посуде. Более того, эту смесь можно просто купить готовую, что, во-первых, означает, что она спокойно хранится в течение длительного времени в самых непритязательных условиях (иначе никто не стал бы рисковать, предлагая его покупателям), а во-вторых, что им могут пользоваться без проблем в любой обычной лаборатории – это самый обычный реактив, и любой вменяемый химик с ним справится. И этот реактив под названиями пиридиния полигидрофторид или фтористый водород/пиридин, или реагент Олы (Olah’s reagent) стал очень популярен как такой заменитель HF, делающий для этого галоидного водорода рельными многие реакции по аналогии реакциями других галогеноводородов. Смысл этой загадочной фразы в том, что если вам известна какая-то реакция с бромистым или хлористым водородом, и вы ищете, как бы ее сделать в химии фтора, то брать нужно не сам фтористый водород, а именно реагент Олы, или возможно какие-то его более современные аналоги.
Ола с сотрудниками перебрали несколько оснований и остановились на смеси пиридина и HF (30:70% по молям). Схема слева дает приблизительное представление о составе этой смеси, хотя в реальности вместо иона HF2–, в нем более сложные полимерные гидрофторид-анионы. Для этого тоже нужен чистый жидкий фотристый водород и оборудование для работы с этим ужасающим веществом, но после того как эта смесь сделана, она представляет собой вполне стабильную жидкость, с которой можно работать с разумными предосторожностями в очень простой и дешевой полиэтиленовой посуде. Более того, эту смесь можно просто купить готовую, что, во-первых, означает, что она спокойно хранится в течение длительного времени в самых непритязательных условиях (иначе никто не стал бы рисковать, предлагая его покупателям), а во-вторых, что им могут пользоваться без проблем в любой обычной лаборатории – это самый обычный реактив, и любой вменяемый химик с ним справится. И этот реактив под названиями пиридиния полигидрофторид или фтористый водород/пиридин, или реагент Олы (Olah’s reagent) стал очень популярен как такой заменитель HF, делающий для этого галоидного водорода рельными многие реакции по аналогии реакциями других галогеноводородов. Смысл этой загадочной фразы в том, что если вам известна какая-то реакция с бромистым или хлористым водородом, и вы ищете, как бы ее сделать в химии фтора, то брать нужно не сам фтористый водород, а именно реагент Олы, или возможно какие-то его более современные аналоги.
Вернемся к олефинам. Реагент Олы присоединяет к двойной связи HF строго по правилу Марковникова, причем реакции идут в удобных условиях в разных растворителях (ТГФ, дихлорметан, пентан и т.п.) просто при перемешивании (Synthesis, 1973, 779). Вот несколько примеров. Выходы обычно хорошие, хотя и далекие от высоких, что говорит, что полностью устранить проблему конкурентной полимеризации не получилось, все же нуклеофильность гидрофторидных анионов с фтором, закрытым водородными связями со всех сторон, слишком мала. И это такой принципиальный момент, с которым совсем полностью справиться невозможно – протонирование-то нам все равно нужно. 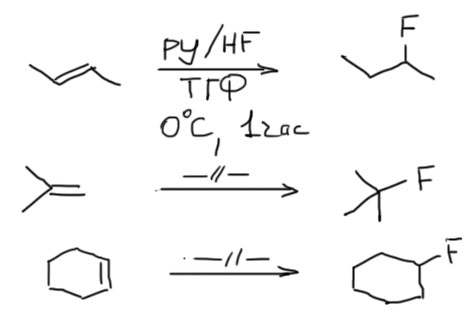
Хотя реагент Олы остается самым популярным, со времени его изобретения было предложено много аналогов, построенных на том же принципе – добавьте к HF немного основания Бренстеда-Лоури, и получите реагент, работающий как сильная кислота и одновременно источник более-менее нуклеофильного фтора. Самый последний писк этого направления можно увидеть в недавней работе шанхайского профессора Бо Сю, весьма плодовитого исследователя в этой области (B. Xu et al., J. Am. Chem. Soc. 2017, 139, 18202). Сю предлагает с одной стороны решение той же природы – замесите HF с каким-нибудь слабым основанием, но с другой стороны весьма неожиданное, потому что он в результате исследования широкого множества кандидатов в основание остановился на довольно парадоксальной вещи – кислом сульфате калия, KHSO4. Основность бисульфат иона это то же самое, что кислотность серной кислоты, и мы вроде бы уже выяснили, что HF серной кислоте по кислотности почти точная ровня, и тогда как же HF сможет протонировать бисульфат-ион? Да, вопрос есть, но Сю и его соратники уверяют, что бисульфат-ион все равно работает как акцептор водородной связи, так что в этой смеси тоже возникают те самые полимерные гидрофторидные анионы H(n-1)Fn–, и дает самый лучший реагент для присоединения HF к двойной связи, приводя огромное количество примеров, в том числе потрясающей селективности, например, не затрагивает тройную связь. 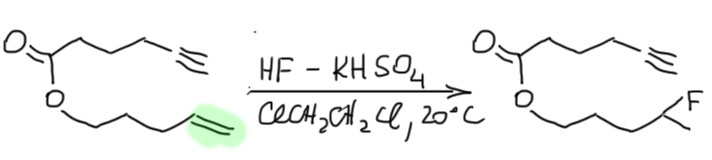
Так что возможно это гениальный реагент, новое слово в химии гидрофторирования. Одна проблема, и это типичная проблема для химии 21 века – новые реагенты испытывают и описывают для реакций на несколько миллиграмм, а реакции делают в малюсеньких пузырьках, определяя результат по спектрам, часто или прямо с реакционной смеси, или по данным автоматизированного анализа. Это позволяет делать огромные массивы испытаний реагентов, условий и субстратов, но не дает никакой гарантии, что когда эту реакцию потребуется реально использовать для какого-то ощутимого количества вещества и с выделением продукта реакции, вообще что-нибудь получится. Поэтому пока держимся классики, которой в этом деле является реагент Олы, но желающие могут пробовать современные идеи.
NBS - это свободнорадикальный или электрофильный реагент?
Правильный ответ – и то, и другое, причем когда мы говорим, что это свободнорадикальный агент, мы не имеем в виду самую знаменитую реакцию – аллильное бромирование по Волю-Циглеру, потому то, как мы уже убедидись, в этой реакции NBS вообще не является реагентом в полном смысле этого слова – алкен с ним вообще никак не соприкасается. Но свободнорадикальные реакции с NBS, как и другими N-бромамидами сделать вполне можно, потому что в этих реагентах есть слабая связь N-Br и ее можно инициировать. При этом мы получим страшно реакционноспособный и поэтому неселективный радикал с точкой на азоте. Такая химия известна, но применения почти не находит. Забудем.
Другое дело электрофильность. NBS и другие N-бромамиды, а также N-хлорамиды и в существенной степени N-иодамиды – вполне типичные электрофильные агенты в условиях отсутствия явного свободнорадикального инициирования – яркого света, излишнего нагревания, и инициаторов. С другой стороны, очень желательно что-нибудь, способное отдавать протоны хотя бы в виде водородных связей – протонные растворители типа спиртов, или даже просто немного воды. Это часто кокетливо называют сырыми (wet) растворителями, имея в виду, что примесь воды может быть небольшой и в некотором смысле даже случайной – в плохой лаборатории все растворители такие, как я люблю это называть “из помойного ведра”. Зачем нужны доноры протонов? Очень понятно. Это типичная история, с которой мы еще столкнемся сто раз – в помощь плохой уходящей группе. Возьмем любой такой агент, хоть NBS, хоть любой другой N-бромамид и обозначим его Z-N-Br. Вспомним, что электрофилы бывают сразу катионами, и это явно не тот случай, и нейтральными молекулами с ковалентной связью, имеющей способность разрываться не гомолитическим способом – по одному электрону на рыло с образованием свободных радикалов, а гетеролитическим с парой электронов, целиком уходящей к одному из атомов, и тогда группа, включающая этот атом, будет называться уходящей группой (подробнее мы это быдем рассматривать скоро в теме про нуклеофильное замещение). Это дико интересный кейс – пара уходит не обязательно к более электроотрицательному атому, даже скажем еще определеннее – способ разрыва связи и то, какой атом окажется электрофильным центром, не зависит от поляризации связи в исходной молекуле. Связи азот-галоген, например, в таких реакциях рвутся так, что пара уходит к атому азота, а не галогена, даже если галоген это хлор (и даже фтор!). Попробуем разобраться, как это работает.
Начнем с самой простой гипотезы. Если просто связь разрывать, то получился бы анион с минусом на азоте, а это очень плохие уходящие группы, даже при том, что мы здесь имеет дело с галогенпроизводными не аминов, а амидов, и минус на азоте стабилизирован делокализацией мезомерными акцепторами. И должен получиться при этом положительно заряженный галоген – катион Br+. Посмотрим на NBS с этой стороны:
Здесь всё очень плохо. Во-первых, уходящая группа плоха. Во-вторых, катион галогена, любого, хоть Br+ и даже I+– очень плохая штука, хотя это не так просто понять, почему – ведь дело не только в том, что отнять еще один электрон от сильно электроотрицательного атома должно быть непросто. Но есть и чисто квантовая проблема, состоящая в том, что у таких катионов 6 валентных электронов, секстет. Попробуйте разместить 6 электронов на одной s и трех p-орбиталях. С s-орбиталью все понятно, она заберет пару. А теперь размещаем оставшиеся 4 на трёх одинаковыхпо энергии орбиталях – они одинаковы, потому что у нас просто единичный атом, шарик, сферически симметричная частица, в системе координат которой все три измерения – x, y, z – одинаковы и неразличимы. Следовательно и три p-орбитали одинаковы и неразличимы. В общем об этом можно даже и не думать, а просто применить правило Гунда, одно из немногих положений квантовой науки строения атома, которое знают все. Оно говорит нам, что мы не имеем права положить две пары электронов на две p-орбитали и оставить одну свободной; вернее, имеем, но это будет вышележащее состояние. А основное состояние выглядит просто – размещаем сначала три электрона на трёх разных p-орбиталях, затем пристраиваем оставшийся на одной из них. Получаем частицу с двумя неспаренными электронами – триплет (мы скоро столкнемся с очень похожей историей, когда будем думать, как устроен карбен – частица с 6 электронами на атоме углерода, и разберемся, почему правило Гунда хорошо работает только для одноатомных частиц). Фокус в том, что при разрыве связи, как, например, на вышепоказанной схеме с NBS, слева ковалентная связь, электроны все спарены. А справа катион Br+, у которого, как оказалось, два электрона неспарены. Почему мы так решили? Потому что, когда мы просто пишем какую-нибудь реакцию, и над или под стрелкой написаны просто другие реагенты, растворители, нагревание или охлаждение, то такие реакции принято называть термическими (это означает, что реагенты берут энергию или отдают энергию, необходимую для того чтобы двигаться в сторону продуктов реакции, только из теплового равновесия с другими молекулами системы и больше ниоткуда – и таковы почти все известные нам реакции), и в таких реакциях не может происходить изменения спина электронов, в частности, спаренные электроны не могут вдруг не только распариться, но и получить два неспаренных электрона с одинаковым спином. По-другому это читается так: в термической реакции из синглета не может получиться триплет, и наоборот. Такие суровые высказывания принято и называть сурово – правилами запрета. В принципе, это почти законы Природы. Слово почти здесь означает, что нарушения запретов все же иногда случаются, но у этого всякий раз должна быть очень веская причина, и она должна быть найдена и разоблачена. В данной реакции ничего подобного не наблюдается, и запрет должен соблюдаться. Итак, мы решили, что просто развалиться на катион галогена и уходящую группу ни один ковалентный реагент не может (кстати, это касается и молекулы брома, и то, что в некоторых учебниках иногда можно увидеть дисоциацию брома на катион и анион, стоит понимать как неполное соотвествие конкрентного учебника функции надежного источника знаний).
Прежде чем пойти дальше, остановлюсь на висящем в воздухе вопросе – а как же гомолитический распад ковалентной связи на два радикала? Никаких проблем – кто сказал, что у образовавшихся радикалов одинаковые спины? Сразу после распада термическим способом (при инициировании нагреванием) два образовавшихся радикала имеют противоположные спины, и в сумме спин равен нулю. Но это никого не волнует, так как дальше каждый радикал имеет свою судьбу, ведет свою реакцию. В сумме по все молекулам системы – мы же никогда не забываем, что, когда мы говорим про реакции, мы никогда не имеем в виду одну молекулу, а только очень много молекул, вещество – спин тоже будет равен нулю. Если бы это было не так, то произошло бы чрезвычайное событие – в реакции возникал бы из ничего магнитный момент, а это совершенно невозможно, так как хорошо известно, что все моменты сохраняются: раз был ноль, значит и будет ноль.
Так, ладно, а какие еще бывают реакции кроме термических? Бывают еще фотохимические, в которых энергия берется из взаимодействия реагентов с электромагнитным излучением, с фотонами. Правила запрета действуют и для них, но поскольку там в дело замешаны возбужденные состояния молекул, то всяких фокусов там гораздо больше. Слава богам, мы не изучаем фотохимии на 3 курсе, а то пришлось бы нам совсем туго, ведь лезть в фотохимию без квантовой науки – курам насмех. Побережёмся.
Боже мой, это ж надо было так далеко уйти от самой обычной реакции! Ну да, паршиво получилось, извиняюсь, но где-то надо было это обсудить.
Итак, возвращаемся к NBS – у нас не одна проблема, а две. Нужно как-то улучшить уходящую группу, и одновременно уйти от необходимости образования Br+. Первое достигается водородной связью от донора протона – воды, спирта, карбоновой кислоты, что есть. Это позволяет уходящей группе смягчить горечь расставания, сделать вид, что она уходит не анионом, а сопряженной кислотой. Образующийся из донора протона анион, скорее всего, тут же пригодится как нуклеофил. От образования катиона уйти еще проще – представим себе, что разрыв ковалентной связи происходит не до взаимодействия с двойной связью, а одновременно, как мы уже научились говорить, согласованно. Получаем очередную разновидность того, что мы уже и так видели, когда обсуждали просто бромирование бромом и тоже обнаружили согласованные механизмы. (На схеме для простоты нарисован карбокатион, но в реальности это такой же мостиковый ион, симметричный или несимметричный, как в обычном бромировании).
Зачем всё это? NBS оказался электрофильным бромирующим агентом. А чем он отличается от просто брома? О, это очень важно. Второго атома брома у него нет, вот чем. Мы уже видели, что двойная связь реагирует с бромом в присутствии воды, образуя продукт сопряженного присоединения, бромгидрин. Но это только на бумаге так красиво. На практике это не так просто сделать, ведь обычная рекомендация взять бромную воду сильно попахивает допотопной химией эдак середины 19 века. Проблема в том, что бром очень плохо растворим в воде. И тем более плохо в ней растворимы олефины. Поэтому если вы смешаете бромную воду и олефин, в гораздо большей степени пойдет другая реакция: нерастворимый в воде олефин образует отдельный слой или капельки, если сильно перемешивать; в этот слой или капельки будет экстрагирован бром из бромной воды, потому что галогены неполярные вещества, лучше растворимые в неполярных жидкостях; ну и в этом слое или капельках пройдет обычная реакция присоединения брома с образованием дибромпроизводного. И даже если немного изменить условия реакции, подобрать растворитель, растворяющий и олефин, и бром, и воду, чтобы реакция стала гомогенной, все равно получим конкуренцию между обычным бромированием и сопряженным.
И вот здесь NBS – просто находка. Сам остаток сукцинимида, в принципе, тоже нуклеофил, но настолько слабый, что почти не конкурирует с другими нукоеофилами. Поэтому, NBS – чистый источник электрофильного брома для образования мостикового иона, а нуклеофил можно добавить другой, по вкусу. NBS – почти идеальный реагент для сопряженного присоединения брома и других нуклеофилов – воды, спиртов, карбоновых кислот – к двойной связи. Этот метод пользуется совершенно ошеломляющей популярностью – можно без труда найти многие сотни а скорее даже и тысячи примеров применения в реальных синтезах.
Когда хотят присоединить бром и воду, используют самые различные растворители, в которых растворима вода – ацетон, диоксан, ТГФ, ацетонитрил, диметилформамид, ДМСО и т.п., иногда в присутствии пары капель серной кислоты, чтобы NBS пошустрее шевелился: любой источник протона в этой реакции работает как кислотный катализатор, но понятно, что сильная кислота гораздо сильнее ускоряет реакцию, чем вода, спирты или карбоновая кислота. Иногда это нужно, но чаще нет. Реакции всегда стереоселективны (это анти-присоединение), а с двойными связями с разными заместителями реакция всегда идет так, как и должна идти в предположении, что бром – электрофил, а вода,
спирт или карбоновая кислота – нуклеофил, как, например, в этих примерах (разберитесь сами, почему получаются именно эти продукты): 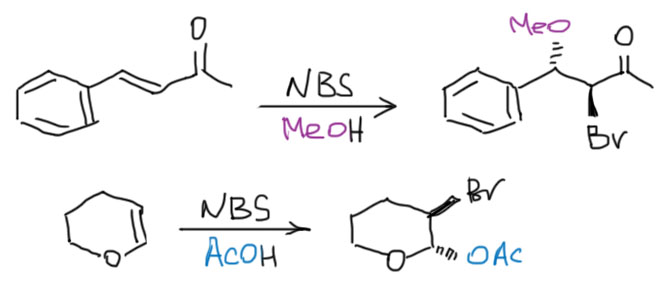
Эта реакция настолько гибка, что может использоваться даже в тех случаях, когда нуклеофил, спирт или карбоновая кислота не так просты. Например, учитывая меньшую реакционную способность тройной связи по сравнению с двойной, можно взять ацетиленовый спирт. 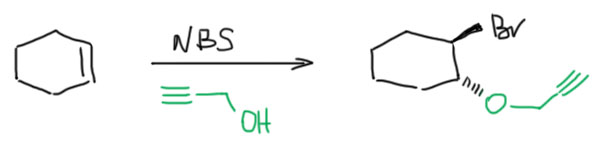
Реакцию можно провести настолько аккуратно, что она затронет только самую донорную, а значит самую реакционноспособную в эдектрофильной реакции связь, как, например, в таком удивительно селективном превращении природного триена мирцена (Zeitschrift fur Chemie, 1980, 20, 293). Кроме просто донорности может быть и другое объяснение, почему не затронуты другие двойные связи – они здесь образуют сопряженную систему диена, а это приводит к стабилизации, а стабилизация часто является причиной пониженной реакционной способности, типа, если и так всё хорошо, зачем суетиться, реагировать с каким-то NBSом. Выберите себе объяснение по душе – в органике часто так бывает, что явление можно вполне разумно и адекватно объяснить несколькими способами, и понять, какое из них верно, очень непросто, а часто и невозможно.
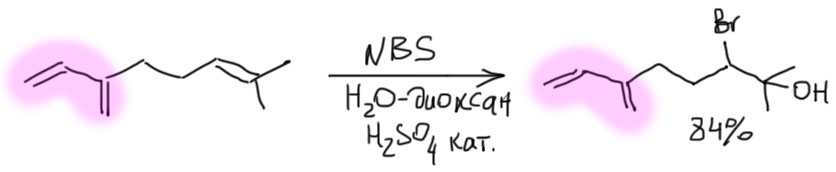
Реакция отлично идёт внутримолекулярно, когда нуклеофил находится в молекуле – получатся циклические простые или сложные эфиры. Циклические сложные эфиры кратко называются лактонами. При этом обычно получаются пяти или шестичленные циклы, так же как и в других внутримолекулярных реакциях. 
Второй пример может вызвать вопрос – откуда бром знает, что ему нужно садиться именно на этот атом углерода. В этом случае двойная связь практически симметричная и вопрос о стабильности карбокатиона не имеет однозначного решения. В первом примере всё ясно – карбокатион предпочтет сидеть под фенилом, а во втором примере такого эффекта нет вообще. Понятно, что второй возможный карбокатион не дал бы замыкания в цикл, но бром-то на двойную связь садится сначала, а нуклеофил атакует то, что при этом получается на второй стадии. Получается, что что-то (или кто-то) направляет реакцию… Мистика, однако. Никакой мистики, если мы все же не будем забывать, что карбокатион образуется в электрофильном бромировании только, если он очень хорошо стабилизирован, а если нет, то образуется мостиковый ион, а если двойная связь еще и симметрична по заместителям (не в геометрическом смысле, а в том смысле, что с двух сторон одинаковые или почти одинаковые по эццектам заместители) – то этот мостиковый ион это симметричный циклический ион бромония. Дальше нуклеофил просто раскрывает ион бромония (по механизму SN2 – скоро дойдем до этой фундаментальной вещи, а пока просто поверим), в данном случае внутримолекулярно, и это можно сделать только одним способом с образованием именно такого продукта. Не забываем про водородные связи, которые используются для активации NBS и вообще все это держат вместе. В этом смысле образование этого продукта можно рассматривать, как еще одно доказательство того, что электрофильное бромирование идёт через мостиковый ион. 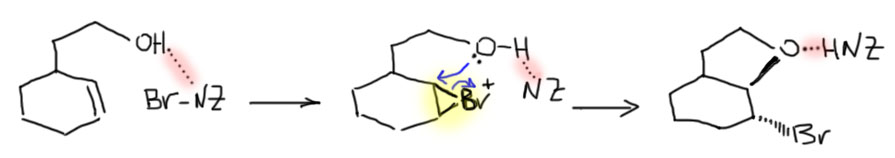
И в современной химии дело доходит до очень дерзких вещей. Нуклеофилом может быть и что-нибудь лихое, как например, в бромфторировании, или азидобромировании. Для бромфторирования нам понадобится фторид как нуклеофил плюс что-то протонное. Мы уже обсуждали тут рядом, как можно совместить эти две плохо совместимые вещи, и знаем, что решение предложил Ола, предлжив смесь безводного HF и пиридина. И если в эту смесь добавить NBS, то получим ровно то, что нужно – электрофильную активацию связи N-Br и источник нуклеофильного фторида. Собственно и это тоже предложил Ола, как впрочем и то же самое с иод- и хлор-аналоганми NBS (J. Org. Chem.1979, 44, 3872). Работает отлично, чистая стереохимия – только анти, и места присоединения фтора и брома полностью соответствуют нашим предсказаниям, например: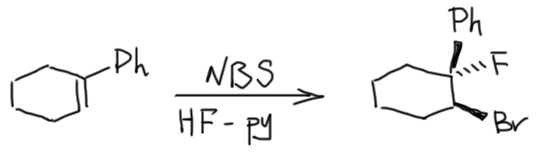
C азидом это работает еще проще, что совсем не удивительно, так как азид-ион – великолепный нуклеофил, не требующий никаких ухищрений. Могла бы быть проблема – нам ведь еще нужен протон, а в солях с азид-ионом протона нет. Но оказалось достаточно плеснуть немного воды. При этом проблем с конкуренцией с водой азид не испытывает – по нуклеофильности дистанция между водой и азид-ионом совершенно астрономическая – азид просто не замечает такого жалкого конкурента. Метод очень популярен и применялся и применяется очень часто, приведем самый простой пример: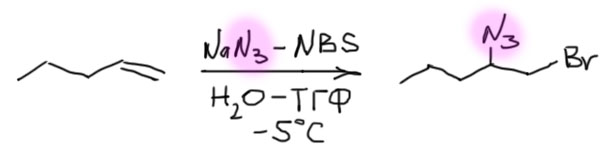
Как видим, NBS – очень полезный электрофильный реагент, гораздо более удобный и разносторонний чем сам бром, потому что позволяет использовать очень много разных нуклеофилов в электрофильном присоединении. Всё это очень чисто, аккуратно, селективно – региоселективно (чётко выполняется основная схема – сначала присоединяется электрофил с образованием более устойчивого карбокатиона, затем к положительному углероду присоединяется нуклеофил); стереоселективно (получается только продукт анти-присоединения).
