Механизм Е2
Механизм Е2
Механизм E2, как и SN2, относится к согласованным механизмам. Напомню, что это означает, что исходные молекулы превращаются в продукты реакции напрямую, в 1 стадию, без участия каких-либо промежуточных частиц (интермедиатов). Суть механизма в том, что одни связи рвутся, другие одновременно образуются. Чтобы это произошло, все хозяйство должно перейти из одной ямы (минимума энергии соответствующего исходным) в другую (минимума, соотвесттвующего продуктам) через перевал, соотвествующий так называемому переходному состоянию. Энергия переходного состояния, всегда положительная, определяет энергию активации (если хорошо знаете хим кинетику, то не придирайтесь к терминам, здесь есть некоторые несущественные упрощения), а следовательно и скорость реакции. Чем ниже перевал, тем больше скорость, и наоборот. Изобразим все это:
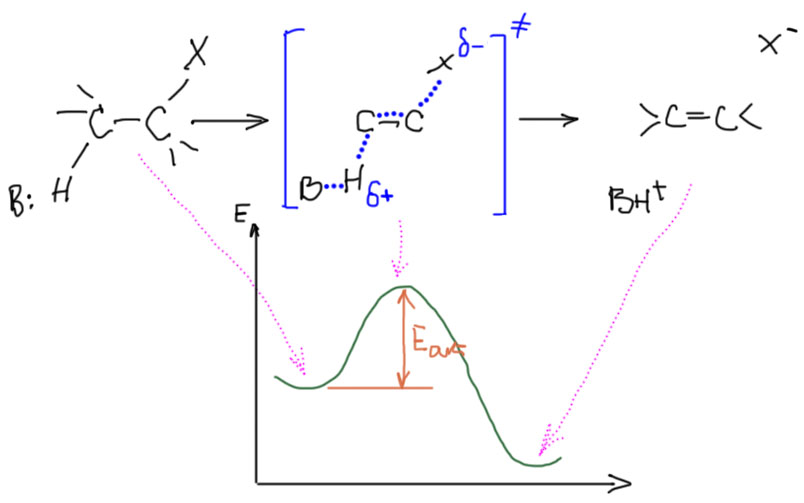
Хорошо, механизм мы нарисовали, и что из этого следует? Так как механизм согласованный, то в самом важной стадии (а она тут одна) участвуют и субстрат, и основание. Поэтому здесь все важно: а) основность и размер основания; б) структура субстрата; в) качество уходящей группы. Самые важные следствия разобраны ниже (жмем на плюсики).
Конкуренция отщепления и замещения: основность
Извините, раздел в работе
Конкуренция замещения и отщепления: структура субстрата
Извините, раздел в работе
Как влияет растворитель
Мы это уже разобрали в Нуклеофильности и основности. Коротко напомню, что факторы, увеличивающие основность те же, что увеличивают нуклеофильность. Но по мере увеличения основности E2-отщепление выигрывает конкуренцию у замещения. Поэтому применение спецрастворителей типа ДМСО или межфазного переноса к анионам, которые уже в воде имеют основность, сравнимую с основностью гидроксид-иона, дает почти стопроцентное элиминирование.
На это можно возразить – а как это в воде основность выше основности гидрокcид-иода? Разве такое основание неизбежно не оторвет протон от воды – и вообще мы все когда-то изучали, что собственная кислотность/основность растворителя задает потолок основности в данном растворителе. Поэтому мы начинаем страшно нервничать, когда видим в условиях какой-нибудь реакции метилат или этилат в воде.
Все это верно и пересмотру не подлежит. Будем нервничать дальше и не позволим! Тем не менее, в таблицах основности можно отлично увидеть pK оснований, явно более сильных чем гидроксид. Это не экспериментальные величины, а просто оценки. Есть много всяких полуколичественных закономерностей, которые позволяют делать такие оценки из косвенных данных. А уж качественную оценку мы можем сделать сами, обычным образом обсудив влияние заместителей на основность, то есть, например, представив метилат как метил-замещенный гидроксид – индуктивный донор увеличивает основность, и т.п. Основность в каком растворителе? На самом деле, в любом – речь идет о том, что основность метилата в некотором растворителе выше основности гидроксида в том же растворителе. Но не в разных. В каждом растворителе мы имеем некоторый ряд основности, порядок в котором основность увеличивается или уменьшается.
Поэтому мы имеем право говорить, что метилат в воде более сильное основание чем гидроксид-ион. А значит, если мы знаем, что гидроксид в ДМСО или в условиях межфазного переноса только элиминирует, значит и от алкоксидов в ДМСО (межфазный перенос к алкоксидам применить труднее, так как там часто присутствует водная фаза, но при желании замесить твердый алкоксид калия с краун-эфиром в бензоле можно) трудно ожидать что-то иное.
Во всем остальном влияние растворителя на элиминирование не настолько велико, чтобы это нужно было обсуждать. Безусловно, когда мы обсуждаем элиминирование по Гофману с образованием наименее замещенного олефина из всех возможных, основной тезис в том, что сильные пространственно затрудненные основания предпочитают отрывать протон из наименее замещенного положения и таким образом способствуют именно этому направлению. Растворитель не изменяет пространственных препятствий, но основность может увеличивать. Можем сделать вывод, что если трет-бутилат в трет-бутаноле отщепляет в основном по Гофману, то трет-бутилат в ДМСО даст еще более высокую пропорцию Гофман/Зайцев (100 к нулю не бывает никогда, и мы реально будем сравнивать что-то типа 80 к 20 и 90 к 10). Но это не так важно. Цифры нас запоминать никто не просит, а в решении задач мы предполагаем, что выбор направления практически полный.
Стереохимия в элиминировании E2: анти- и син-элиминирование
Механизм E2 требует совершенно конкретной стереохимии. Это легко понять, если еще раз посмотреть на механизм. В отличие от двух стадийных механизмов в механизме E2 все происходит между исходными и конечными веществами практически одновременно, и все вовлеченные в процесс атомы должны выстроиться в наиболее благоприятную конфигурацию.
Нарисуем переходное состояние, снабдив атомы орбитальками, вовлеченными в процесс. Видим, что π-орбитали двойной связи образуются из бывших гибридных орбиталей, обслуживавших связи C-H и C-X. Наилучшим образом все это действие будет развиваться тогда, когда эти связи в исходной молекуле находятся в одной плоскости – тогда по мере разрыва этих связей орбитали плавненько переходят в орбитали π-связи. А это в свою очередь возможно в двух случаях (очевидна аналогия с присоединением, чтоочень удобно, так как присоединение и отщепление можно рассматривать как одну и ту же реакцию в прямом и обратном направлении):
- син – это когда H и X находятся с одной стороны
- анти – когда с разных сторон;
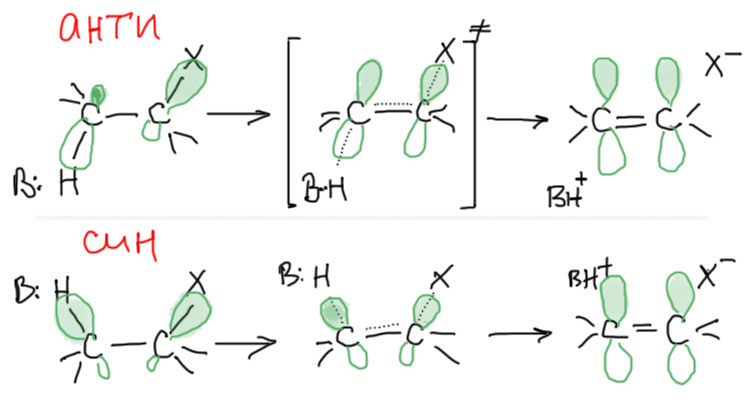
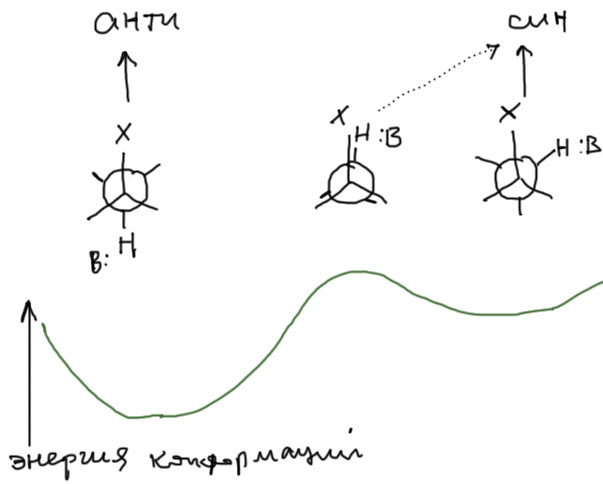
Из этой картинки не ясно, какой из этих путей лучше. На самом деле оба одинаково хороши, но есть одно дополнительное обстоятельство у нециклических соединений, которыми мы сейчас преимущественно и занимаемся. Если мы посмотрим конформации по C-C связи, то поймем, что анти-элиминирование соответствует правильной заторможенной конформации, то есть реально существующему конформеру, хотя и не обязательно самому устойчивому. Здесь проблем нет.
А вот син-элиминирование требует фиксации в заслоненной конформации, что, для подавляющего большинства нециклических соединений практически невозможно, такой конформации не соотвествует ни один конформер, потому что такому расположению атомов соотвествует максимум энергии. Молекула в такой конформации не бывает никогда. Поэтому, син-элиминирование для нециклических соединений строго говоря вообще не может происходить. В реальности все не так строго – син-элиминирование все же происходит, но выходы соотвествующих продуктов почти всегда существенно меньше, чем выходы продуктов анти-элиминирования, настолько, что в планировании реакций син-элиминированием можно пренебречь. Этот парадокс – син-элиминирование все же происходит, хотя соотвестующая заслоненная конформация невозможна и никак не представлена среди реальных конформеров молекулы (посмотрите на страничке про конформации, что означает этот загадочный пассаж), – как обычно и бывает в химии, объясняется просто: параллельность связей максимально благоприятна для реакции элиминирования, но не абсолютно необходима. В химии редко бывает так, что требования к какому-то геометрическому параметру настолько строги, что их можно выразить математически строгим равнством, типа двугранный угол равен 0 градусов, и точка. Все такие требования определяются необходимостью для вовлеченных в процес орбиталей эффективно перекрываться. Но при отклонении угла на разумные величины перекрывание не исчезает, – да, ослабляется, но нет, не настолько, чтобы взаимодействие стало невозможным. И во второй заторможенной конформации, когда уходящая группа и протон находятся в гош-конфигурации, а это реальный конформер, и даже, возможно, более устойчивый, чем тот, из которого идёт анти-элиминирование, возможно то самое син-элиминирование. В этом случае “выправление” орбиталей происходит по мере разрыва связей и изменения гибридизации с sp3 в sp2. Реакция идёт. Обратите внимание на довольно скользкий момент – конформер для син-элиминирования действительно может оказаться более устойчив, чем конформер для анти-элиминирования. Но син-элиминирование даже в этом случае не станет преобладающим, именно потому что идёт из не совсем правильной конфигурации, в которой связи с протоном и уходящей группой не лежат в одной плосткости, а следовательно взаимодействие орбиталей довольно сильно ослаблено (угол-то не пустяшный – 60 градусов!). Мы еще встретимся с этой проблемой в химии алициклических соединений, и тогда, надеюсь, разберёмся в проблеме еще лучше. Пока же просто пренебрегаем син-элиминированием, и во всех задачах обходимся только анти-элиминирвоанием.
Теперь перейдем к конкрентным случаям, с которыми придется справляться. Сразу обозначим важное ограничение – стереохимию отщепления анализируют только для E2-элиминирования по Зайцеву. В элиминировании по Гофману стереохимия почти всегда не имеет значения, а с совсем экзотическими случаями мы никогда не столкнемся. Как всегда жмем на заголовок, чтобы посмотреть, что внутри.
Простой случай: транс- или цис-алкен образуется в E2-элиминировании
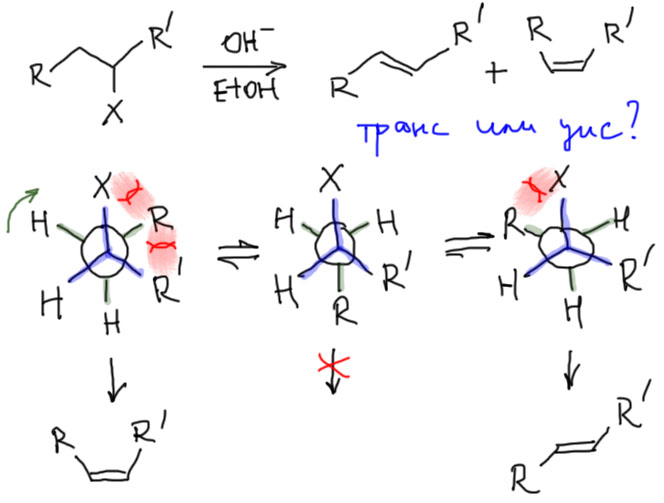
Более сложный случай: элиминирование из диастереомерных субстратов
Рисуем Фишера или сразу естественную проекцию. Кто забыл, прочитайте еще раз, как это делается. Естественная проекция очень просто перерисовывается в Ньюмена – основная цепь дает заместители напротив друг друга (подсвечено малиновым), и тогда легко относительно них нарисовать все остальное (не парьтесь с лево-право: мы рассматриваем диастереомеры, а не энантиомеры, всегда предполагается наличие обоих энантиомеров в рацемической смеси, поэтому рисуется только один – любой – из них). Смотрим, есть ли в полученной конформации анти-расположение уходящей группы и протона, если нет, крутим заднюю тройку относительно передней, пока не получим такого расположения. Обрываем H и уходящую группу, остаток плющим в плоский олефин (подсвечено синим). Видим, что действительно образуются два разных олефина – E и Z-диастереомеры 2-фенилбутена-2. Чтобы ответить на второй вопрос, нужно сравнить конформации, дающие продукт и посмотреть, отличаются ли они по стерике. Видим, что в обоих случаях объемные группы оказываются рядом и никакой разницы нет. Но так будет не всегда, поэтому нужно посматривать на взаимное расположение крупных заместителей в конформере для анти-элиминирования.
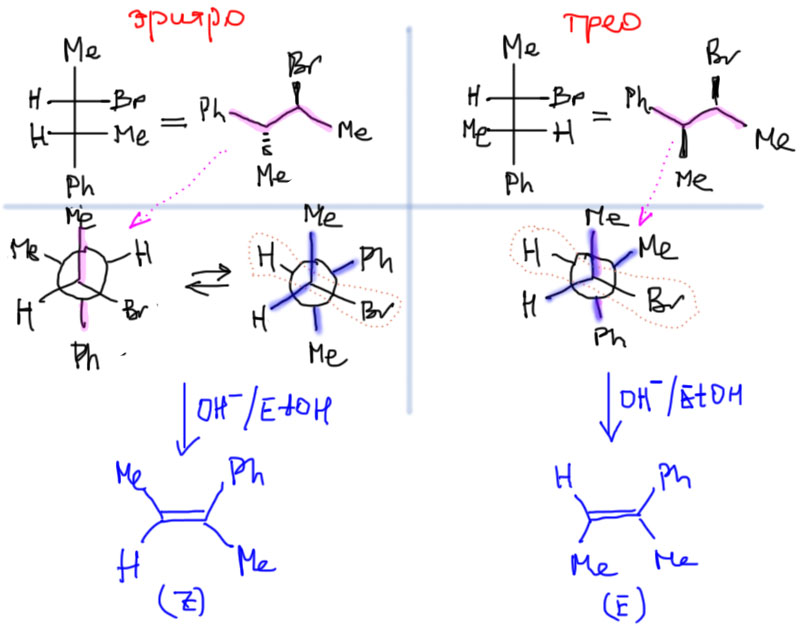
Еще более сложный случай: водород или дейтерий.
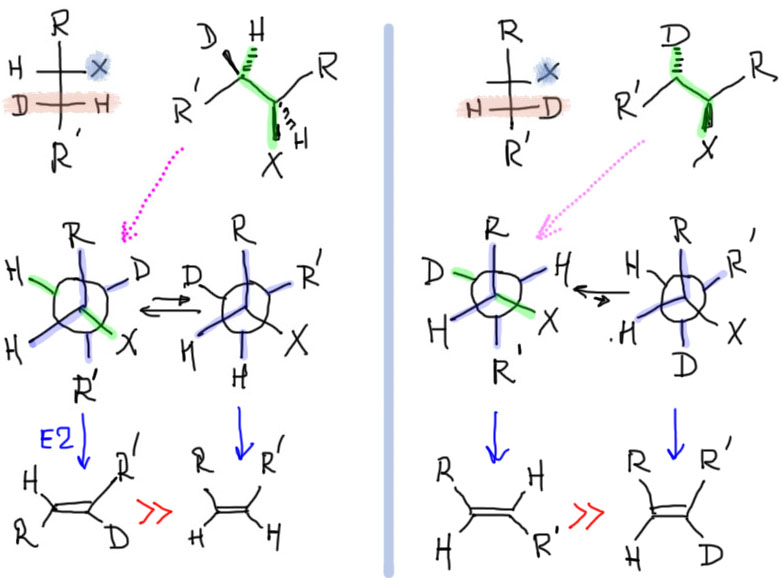
Все остальные возможные случаи получаются из рассмотренных по описанной схеме. Действуйте, но не забывайте, что вы везде пользуетесь упрощением, пренебрегая син-отщеплением. Тем не менее, многочисленные экспериментальные данные по такого рода отщеплениям, которые можно при желании найти в научных статьях, очень неплохо соотвествуют описанной схеме.
