Дополнительные материалы по теме ароматика
Это такая временная страничка, на которой я пока размещу некоторые материалы, которые уже написались, но ещё не пристроены в окончательное место. Это точно не для всех, а только для любопытных.
Фосфорные кислоты, полифосфорная кислота, метафосфорная кислота, фосфорный ангидрид, АТФ – реагенты для электрофильной активации в ацилировании и других реакциях.
В последней контрольной работе одна вещь вызвала у меня глубокое изумление. Прошло уже несколько часов, а изумление не проходит. Чтобы как-то справиться с этим навязчивым состоянием, я решил написать вот это дополнение.
Дело в том, что в одной реакции над стрелкой была обозначена метафосфорная кислота. Вот так было написано (HPO3)n. Это общепринятое обозначение полимерной метафосфорной кислоты. Что это за реагент, зачем он был взят, почему именно это и что имелось в виду? Естественно, когда так пишут, вместо обычных реагентов для, по всей видимости, обычной реакции ацилирования по Фриделю-Крафтсу, возникает масса вопросов и гипотез, уж не имел ли в виду составитель что-то гораздо более интересное. Уж больно реагент необычен. Успокоиться удалось не сразу, в голову лезли самые экзотические гипотезы типа образования ароматического цикла, состоящего из атомов фосфора и кислорода. Ну вот как-то так: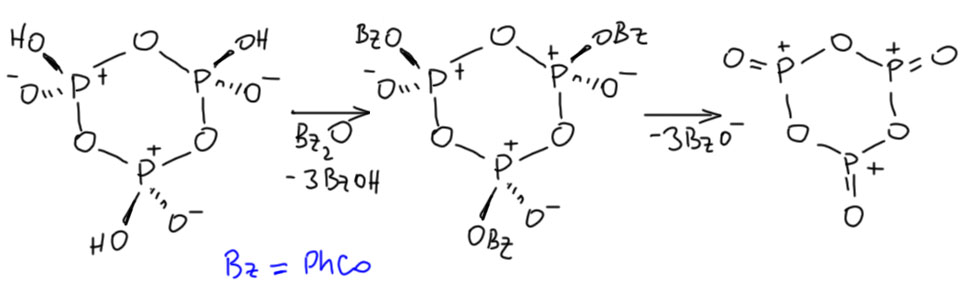
Эта хрень в конце и правда может быть ароматической, потому что у кислорода есть пара, а у такого фосфора вакантная p-орбиталь, хотя бы по аналогии с серным ангидридом. Но гипотеза кажется всё равно диковатой. Такое соединение фосфора вряд ли существует, хотя кое-что похожее есть, и в любом случае это неорганика, а у нас вроде бы органика. Хотя, чёрт знает.
В общем, мучения становились невыносимыми, но тут я заметил, что под стрелкой написан о-ксилол. Довольно типичный выкококипящий растворитель. А вдруг это реагент? Не пишут реагенты под стрелкой, если только не хотят устроить разводку и прикол. Вроде бы контрольная не место для таких развлечений, но мы живём в непростое время, и все немного уже свихнулись. Тут я увидел и два сильнопольных синглета в условии, понял, что это ещё один прикол – забыть привести ароматические мультиплеты. В общем, в этом месте натупило просветление, обозначенное вздохами, переходящими в истерический хохот. Всё просто, оказывается, это обычное ацилирование по Фриделю-Крафтсу. Но что это за странный катализатор. Давайте разберёмся, это довольно интересно.
Фосфорных кислот на свете довольно много. Фосфор в этом окислительном состоянии находится в sp3-гибридном состоянии, это тетраэдр, он координационно насыщен, все валентные возможности использованы. Самая обычная фосфорная кислота – орто-фосфорная H3PO4 Поэтому фосфорная кислота – просто протонная кислота, в водных растворах довольно слабая. Мы ее иногда применяем в качестве кислотного катализатора, например, для дегидратации несложных спиртов в олефины, всегда при нагревании и используя смещение равновесия, отгоняя летучий продукт. Но для ацилирования ароматики её кислотности не хватает. Для ацилирования применяют галогенангидриды и ангидриды. Мы знаем, что активация происходит за счет кординации кислотного катализатора по ацильному кислороду. Кислотный катализатор может быть или протонной кислотой или кислотой Льюиса. Электрофилом может быть или сам комплекс ацилирующего агента с кислотой Льюиса, или протонированная форма, или ацильный катион, который получается при диссоциации этих предшественников. В разных случаях бывает и то, и то. Нам сейчас это не важно. Мы просто понимаем, что, во-перых, протонные кислоты используют для ацилирования реже Льисовых протсо потому, что они вызывают побочные реакции. Во-вторых, кислотность орто-фосфорной кислоты еще и маловата для этих целей.
А что мы так прицепились к фосфорной кислоте? Дёшево, доступно, невредно (каждый человек с кока-колой за жизнь выпивает десятки литров фосфорной кислоты), да и реагент почти не вызывает побочных реакций, так как не является окислителем, как серная. В общем, мечта, только не такая, которую можно ухватить руками без некоторой подготовительной работы! К счастью, орто-фосфорная кислота не одна в этом ряду. Нет ли там чего-нибудь поактивнее. А вот мета-фосфорная кислота бывает? Что это вообще? О, это совершенно удивительная штука! Это кислота Льюиса. Фосфор в этой молекуле имеет sp2-гибридное состояние, она плоская, а на фосфоре сидит огромная пустая p-орбиталь. Более того, анион этой кислоты, мета-фосфат (а она и протонная кислота тоже) тоже плоский, и поэтому изоэлектронен и изоструктурен не много не мало – с самим серным ангидридом! Вот они все три, для каждого показана только одна граничная структура, сверху они на плоскости, снизу – бочком с p-орбиталью. 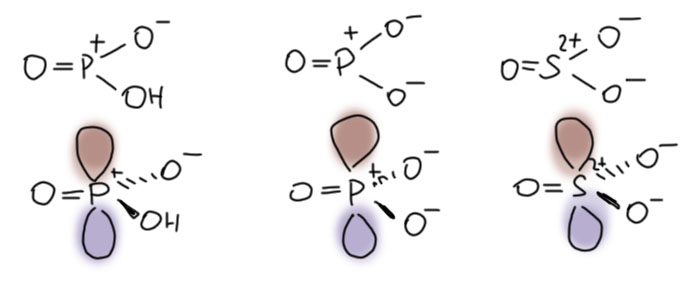
Мы знаем, что серный ангидрид – электрофил чудовищной силы, и кислота Льюиса могучая. Настолько, что применять его во всяких реакциях просто трудно, он совершенно неукротим и дров может наломать немало. Перебор. Метафосфат, напротив, электрофил и кислота Льюиса слишком деликатная, всё же в нём минусов больше, чем плюсов. А вот метафосфорная кислота, похоже, то, что нужно. Нарисуем реакцию с ангидридом карбоновой кислоты. Электрофильный фосфор с удовольствием цепляет кислород, фосфор очень любит кислород, дальше обычная активация , фосфорный остаток забирает карбоксилат, остаётся ацильный катион, готовый ацилировать ароматику (желающие могут нарисовать то же самое, только без образования ацильного катиона, как мы это делаем, например, а ацилировании хлорангидридом в присутствии хлористого алюминия, будет тоже самое, только более громоздко). Вот это нечто, образовавшееся, когда фосфорный остаток заберёт карбоксилат – это смешанный ангидрид фосфорной и карбоновой кислот, в виде сопряжённого основания (кто любит биохимию, знает, что там обожают рисовать фосфорные остатки именно в таком виде). И еще, напомню, что я везде рисую структуры соединений фосфора и серы, сохраняющие октет, как, в принципе, и надо делать. 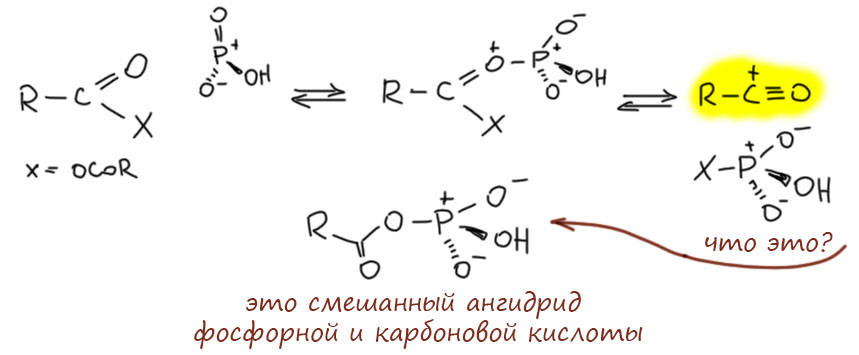
Итак, мы видим, что метафосфорная кислота вполне способна работать как кислота Льюиса и активировать ацилирующие агенты в ароматическом ацилировании по Фриделю-Крафтсу.
Но! Проблема! На свете нет свободной метафосфорной кислоты. Если ее попробовать получить, электрофильный фосфор спросит, а нет ли тут немного водички, и если есть, тут же присоединит её, образовав обычную орто-фосфорную кислоту. А если водички нет, то в другой молекуле метафосфорной кислоты найдётся нуклеофильный атом кислорода, и тоже пойдёт в дело – произойдёт димеризация. 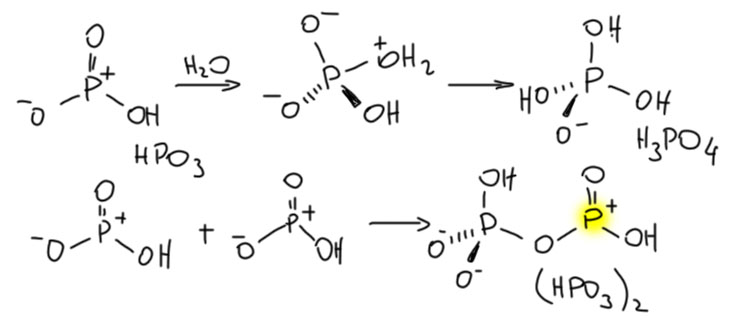
Смотрим внимательно на димер метафосфорной кислоты и видим, что один из фосфоров сохранил sp2-гибридную конфигурацию, а значит, остался сильным электрофилом и кислотой Льюиса, пригодным для активации в реакции Фрилеля-Крафтса. Но он тоже захочет нуклеофила, и если будет рядом молекула метафосфорной кислоты, присоединит её. И так и будет, пока есть свободная HPO3 – поэтому вместо мономера реально всегда быввает полимер. Вот такая метафосфорная кислота и существует реально. И не забывайте на фосфорах заряд ставить, как я. 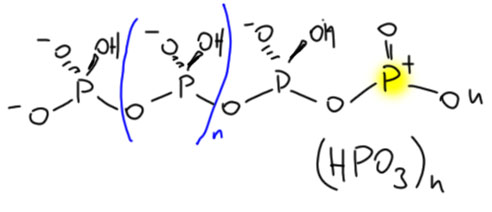
И когда такая полимерная кислота встречает, например, ангидрид, она просто сдаёт ему концевую электрофильную группу, и укорачивается на одно звено. Поскольку полимер это не имеет определённой длины, считайте, что он этого и не заметит, а укороченная молекула будет снова иметь на конце такое звено и сможет активировать следующую молекулу. Здесь заряды не забыл. Активированный ангидрид отправится в реакцию ацилирования или сам, или диссоциировав на ацильный катион. 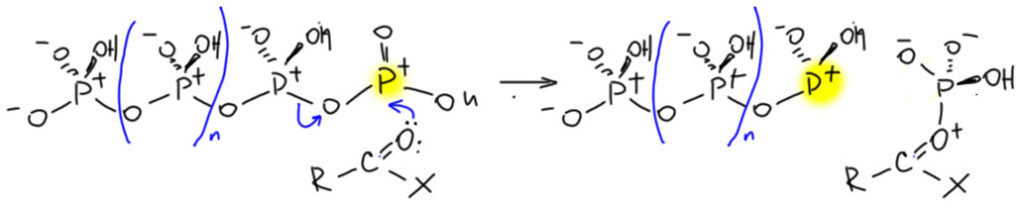
Вот так это и должно работать, если мы используем полимер метафосфорной кислоты для активации ацилирующего агента в реакции Фриделя-Крафтса.
Но в реальности всё, видимо, немного не так. Дело в том, что для того чтобы получить полимер, нужно иметь мономер, и тогда он заполимеризовался бы. Но мономерной метафосфорной кислоты никто никогда не видел и не получал. Слишком она, видимо, электрофильна. Полимер метафосфорной кислоты получают довольно грубым методом – просто греют обычную фосфорную кислоту сильно (очень сильно – до 900º, фактически до белого каления) и долго, часами, иногда ещё и в вакууме, – пока она не отдаст всю воду, которую может отдать. Или не фосфорную кислоту, а дигидрофосфат аммония. По идее, при таком нагревании должен был бы получиться ангидрид, как при нагревании других кислородных кислот, таких, которые при этом не разлагаются ещё глубже. Но получить фосфорный ангидрид обезвоживанием фосфорной кислоты невозможно. Максимум воды, которую отдаёт фосфорная кислота при длительном нагревании соответствует, просто по данным анализа, формуле метафосфорной кислоты. При таком нагревании фосфорная кислота превращается сначала в густой сироп, потом густеет дальше и в конце застывает практически в такую стекловидную массу, вода перестает уходить. При охлаждении получается нечто, очень похожее на мутное растрескавшееся стекло. Там много нюансов, в зависимости от температуры нагревания, длительности охлаждения, и прочих деталей получаются немного разные полимеры, но в общем это всегда она – метафосфорная кислота по составу. И ничего другого, кроме как назвать эту массу, которую можно разбить на кусочки и хранить, и даже продавать, полимером метафосфорной кислоты, не остаётся. Так и делают. Внимание, вопрос. А вы верите, что при этом концевая группа становится такой, как нарисовано выше в теоретическом полимере метафосфорной кислоты, то есть отлетает концевая вода и остается трёъкоординированный фосфор. Я – нет. Да и не нужно.
Кстати, чтобы немного отвлечься. Почти на том же принципе основана … противопожарная пропитка древесины. Для этого обычно применяют водный раствор фосфата аммония. Эта соль остается в порах древесины. И когда огонь нагревает древесину, соль аммония сначала разлагается на аммиак и фосфорную кислоту, а затем фосфорная кислота обезвоживается в поли(метафосфорную) и это негорючее “стекло” просто запечатывает обугливающуюся древесину, отсекая доступ воздуха, горение останавливается. Поэтому, если будете применять это средство, не думайте, что дерево гореть не будет вообще и всё останется как новенькое. Увы, будет, всё обуглится, но есть шанс, что огонь захлебнется, сожрав все внутри, и его будет легче потушить.
Очевидно, что при нагревании молекулы фосфорной кислоты понемногу, выделяя воду сшиваются в такие цепочки. Фосфорные кислоты вообще любят такие цепочки – не забудьте, что короткие цепочки из трёх фосфатов – основа жизни, – они в АТФ, и других нуклеотидтрифосфатах. Но что может заставить такую цепочку потерять воду с концевого атома фосфора? Да ничего. Там она, эта вода. И поскольку цепочки длинные, то эта небольшая разница просто не видна в составе поли-метафосфорной кислоты, не с такой аналитической точностью этот состав устанавливают. Фосфор, видимо, весь остается тетраэдрическим, sp3-гибридным. И обратите внимание, что структурной единицей таких цепочек действительно является метафосфорная кислота, а вся разница между теоретическим полимером метафосфорной кислоты и таким полимером состоит в одной-единственной молекуле воды на цепочку. Если цепочки длинны заметить такой “довесок” почти невозможно. Вы скажете, а как же аналитическая химия, четвёртый знак после запятой и т.п. Да не делает никто анализ этих материалов с такой точностью!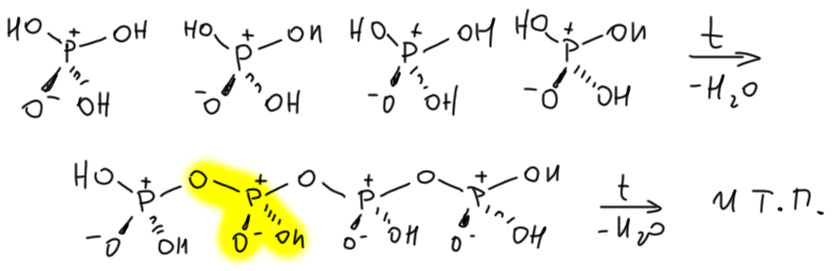
Вот и имеем мы продажную метафосфорную кислоту в виде такого гигроскопичного “стекла”, состоящего из такихполимерных цепей. А почему гигроскопичного? А представьте, какая огромная жажда к водородным связям у таких цепочек с огромным количеством атомов кислорода с хорошим зарядом. А вот растворимость у такого материала просто ужасная, почти во всём, и даже в воде это растворяется весьма медленно, с частичным гидролизом этих цепочек. Конкретный состав и длина цепей зависят от конкретных условий, температуры, длительности нагревания и условий охлаждения. Похожие фокусы происходят при нагревании дигидрофосфатов – образуются соли полиметафосфорной кислоты, а из дигидрофосфата аммония – тоже полиметафосфорная кислота, но немного другого вида. Бывает, например, не стекловидная, а волокнистая форма с хорошей поверхностью – цепочки в таком веществе имеют умопомрачительную длину. И это очень прочная штука во всех смыслах. Становится немного более ясно, почему так прочны нуклеиновые кислоты, сшитые фосфатными тетраэдрами в колоссальные молекулы, которые никогда просто так не кусочки не разваливаются и ничего не теряют. Это вообще очень интересная химия, и материалы получаются с множеством невероятных свойств, например, это такие неорганические ионообменники. Но нам важна органическая химия, к ней и вернёмся.
Метафосфорная кислота и полифосфорная кислота
Опять напрашивается вопрос – а с катализом-то что, если там нет sp2-гибридных атомов фосфора. Погодите, разберёмся. А сейчас пока посмотрим на другую популярную вещь – полифосфорную кислоту. Её получают просто – добавляют понемногу фосфорный ангидрид к фосфорной кислоте. Фосфорный ангидрид делает простую вещь – он добавляет фосфатные тетраэдры к нуклеофильным атомам кислорода. Из фосфорной кислоты получается пирофосфорная, дальше трифосфорная, и так далее. Когда фосфорного ангидрида набухают уже много получается такой густой сироп, который иногда называют фосфорным олеумом, но чаще полифосфорной кислотой (ПФК). Если это уже делали сами, знаете, что сначала всё немного шипит и дымит, а потом расходится настолько медленно. что приходится сутки греть и перемешивать. В реальности это немного сложнее, потому что фосфорный ангидрид молекула непростая, и реакция идёт более сложными кусками, но результат именно этот – цепочка. 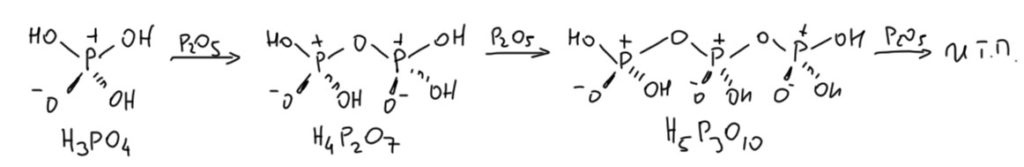
Да это же те же самый цепочки, что в продукте обезводивания фосфорной кислоты, который называют полимерной метафосфорной кислотой. Так что, метафосфорная кислота и ПФК – одно и то же? Почти. Цепочки имеют одинаковую природу, но в ПФК они намного короче. Секрет прост. Чтобы из орто-фосфорной кислоты и ангидрида получить метафосфорную нужна вот такая стехиометрия.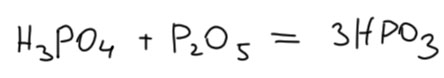
Но в реальности вы никогда – никогда! – не сможете сделать эту реакцию в таком соотношении. ФОсфорный ангидрид задолго до соттношения 1:1 перестанет растворяться, он просто заляжет на дно, покроется толстой коркой, и можете хоть год это перемешивать, если вообще сможете, потому что вязкость жидкой части смеси станет предельной – ни одна мешалка это не промешает. Диффузия просто остановится. И как с этим бороться? Поэтому то, что мы называем полимерной метафосфорной кислотой нельзя получить реакцией фосфорной кислоты с ангидридом, но только термическим обезвоживанием.
В ПФК те же цепочки короче, и это имеет хорошую сторону – ПФК это всё же не “стекло”, а жидкость, которую ещё можно перемешивать, особенно если нагреть. Эта вязкая жидкость растворяется в некоторых других жидкостях (за счет протонирования и водородных связей) и ее можно застаить реагировать. Поэтому берут именно ПФК, а не полимерную метафосфорную кислоту. Механизм действия этих двух, даже не соединений, а веществ, или, как любят говорить по-английски, материалов совершенно одинаков. И он, скорее всего, немного отличается от того, что мы уже нарисовали для того случая, когда в системе есть мета-фосфорная кислота, в которой есть фосфор в sp2-гибридном состоянии, являющийся настоящей кислотой Льюиса. Больше у нас нет кислоты Льюиса. Надо придумать, как запустить реакцию без кислоты Льюиса. Эти думы с хорошей вероятностью заведут нас … в живую клетку (хорошо что не в железную).
АТФ – это полифосфорная кислота живой клетки
В биохимии в реакциях в живой клетке много реакций ацилирования, да и других реакций, в которых органический электрофил участвует в реакциях замещения. Природа использует хорошо нам знакомый метод для того, чтобы из какого-то соединения, не имеющего достаточной реакционной способности, например спирта или карбоновой кислоты, сделать нечто, что может быть реакционноспособным субстратом – замену уходящей группы с плохой (например, гидроксила) на хорошую. Природа практически всегда использует одну и ту же хорошую уходящую группу – фосфат, хотя есть и ещё несколько рабочих вариантов этого приёма.
Фосфат – это хорошая уходящая группа? Вспомним “учение об уходящих группах” (в нуклеофильном замещении освежите, если забыли, но такие вещи забывать нельзя никогда): хорошая уходящая группа – это анион сильной кислоты, тозилат, например. Но фосфат – это анион слабой кислоты, фосфорной. Слабой, но из слабых одной из самых сильных. То есть даже просто фосфат – это не самая лучшая, но и не самая худшая уходящая группа. Точно на много порядков лучше чем гидроксид, и даже чем ацетат. Но у нас и у Природы есть дополнительные инструменты настройки уходящих групп – мы можем ее дополнительно протонировать, или навесить на неё кислоту Льюиса, или немного изменить структуру, или использовать активирующий фермент, и так далее. И так сделать ее вполне себе ничего. У нас в лаборатории, в отличие от живой клетки, ещё есть последнее средство – поднагреть как следует.
Итак, у нас есть карбоновая кислота или ее не очень реакционноспособное производное, например, ангидрид. Мы сначала действуем на ней реагентом – перносчиком фосфатной группы (фосфорилирующим реагентом). В Природе это почти всегда АТФ, нуклеотид, на который навесили трифосфатный остаток – тример фосфорной кислоты. А у нас – полифосфорная кислота из ПФК или полимерной метафосфорной кислоты. В Природе мы помогаем реакции фосфорилирования ферментами, которые собирают реагенты в реакционный комплекс, дополнительно помогая реакции водородными связями и льюисовой кислотностью. В наших грязных колбах подспорьем является нагревание и высокая кислотность таких полифосфорных кислот (кстати, они намного сильнее самой фосфорной). Опустим всякие детали, например, не обращаем внимания на протоны на фосфорных остатках, есть они или нет, зависит от среды в которой проходит реакция, и ясно, что в клетке с почти нейтральным рН и в полифосфорной кислоте с изрядной кислотностью, будет разница в степени протонирования – нам важно увидеть суть и общность. В результате такого фосфорилирования получается смешанный ангидрид карбоновой и фосфорной кислот.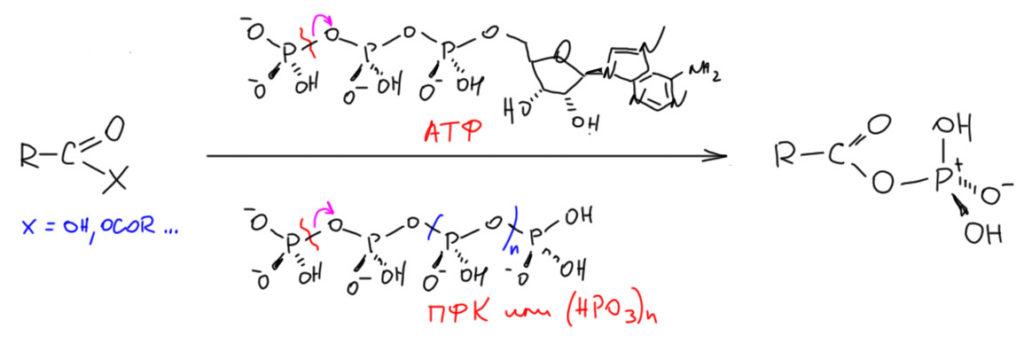
Сам механизм реакции пока оставим в стороне, поскольку мы ещё не изучали карбоновые кислоты и не вполне знакомы с замещениями на карбонильном углероде. Нам важно, что образующийся интермедиат, смешанный ангидрид, имеет хорошую уходящую группу и готов к реакциям ацилирования. Клетку мы оставим в покое, в клетке нет реакций Фриделя-Крафтса, там ацилируют спиртовые, амино-группы, иногда другие нуклеофильные места. Но в колбе условия намного жёстче и можно ацилировать и ароматику. Поскольку реакции почти всегда проводят или в среде ПФК или хотя бы с избытком ПФК или полимерной метафосфорной кислоты. Поэтому мы можем ожидать дополнительной активации за счёт протонирования ацильного кислорода. В реакции может участвовать, а может и не участвовать ацильный катион – в таких условиях это всё равно доказать невозможно. 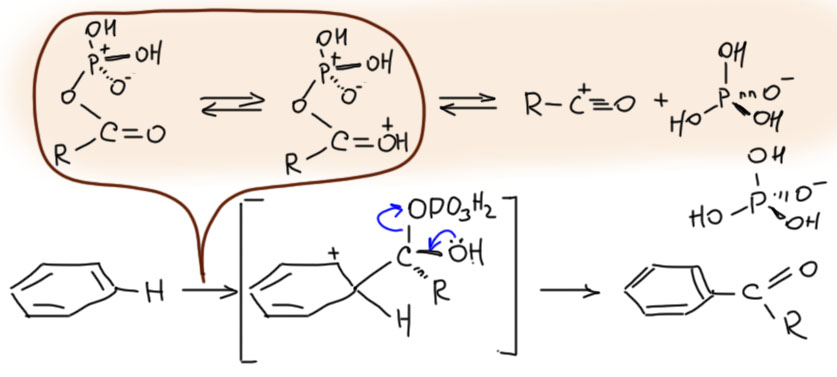
Полифосфорная кислота может активировать не только ангидриды, но и сами карбоновые кислоты, в общем, по тому же самому механизму и в тех же условиях. Всякие нюансы там есть, например, нужно иметь избыток ПФК над карбоновой кислотой, просто потому что при превращении кислоты в ангидрид выделяется вода, которая быстро снижает активность ПФК, гидролизуя длинные цепочки до более коротких и в конце концов до просто фосфорной кислоты.
Фосфорный ангидрид и циклические метафосфорные кислоты
И ещё несколько любопытных вещей, коль скоро мы попали на метафосфорную кислоту. У этой кислоты есть не только линейные полимерные формы, но и циклические. Представить образование таких форм просто – если вернуться к тому как полимеризуется метафосфорная кислота, то электрофильный фосфор на конце может куснуть не обязательно другую молекулу, но и саму растущую молекулу за хвост. Но поскольку мы решили, что мономерной метафосфорной кислоты всё же нет, то и в этом случае источник циклических структур другой. Самая занятная структура – тетрамер. И она имеет самое непосредственное отношение просто к фосфорному ангидриду. Фосфорный ангидрид – вполне конкретная и индивидуальная молекула, это димер того, что мы обозначаем формулой P2O5. И это очень симпатичная структура – трициклическая каркасная (это α-форма этого соединения, есть другие, но эта основная). В основе этой молекулы знаменитая структура, которая очень часто встречается в химии тетраэдрических атомов, а атомов с тетраэдрической структурой окружения в химии полно, и это не только производные элементов группы углерода, но и многие производные элементов группы фосфора. Наиболее чато это называют структурной единицей алмаза, в органической химии ей соответствует восхитительный углеводород адамантан.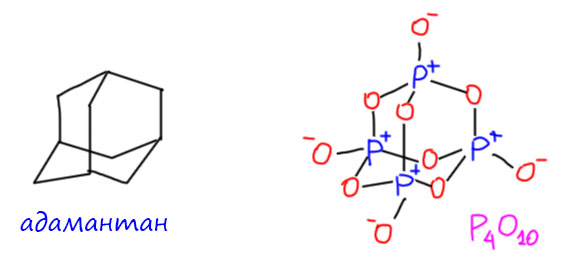 Если использовать органическую номенклатуру, фосфорный ангидрид можно было бы назвать тетра-P-оксо-1,3,5,7-тетрафосфагексаоксаадамантан. С другого бока это выглядит так.
Если использовать органическую номенклатуру, фосфорный ангидрид можно было бы назвать тетра-P-оксо-1,3,5,7-тетрафосфагексаоксаадамантан. С другого бока это выглядит так. 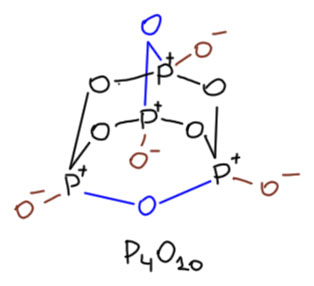
Мы отлично знаем, насколько это вещество реакционноспособно. Можно сказать конкретнее – электрофильно. Это сильный электрофил, всегда готовый реагировать с нуклеофилами, и проблема обычно только в крайней бурности и экзотермичности таких реакций, так что сложно бывает провести их аккуратно. Электрофильны в этой молекуле, как и во всех фосфорных тетраэдрах (атомы фосфора и здесь sp3-гибридные) как раз атомы фосфора. И нуклеофилы атакуют атомы фосфора, производя хорошо нам знакомое SN2-замещение, только на атоме фосфора. В этом месте есть небольшая проблема – в SN2-замещениях нукелеофил атакует с тыла от разрываемой связи, уходящая группа в этом случае – атом кислорода мостика между фосфорами. Но в адамантане в тыл зайти нельзя – в химии самого адамантана это приводит к строгому запрету на классический SN2. Как этот запрет умудряется обходить фосфор, я не знаю, возможно, это связано с тем, что в отличие от химии углерода, в химии фосфора пятикоординированное состояние не запрещено, и у такого состояния есть две геометрии. Подробнее не будем, просто примем, что реакции такие идут и очень охотно.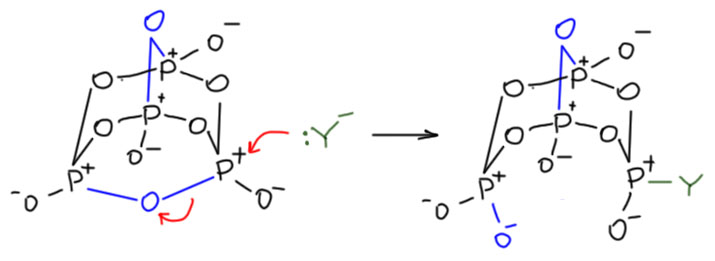
Таким же образом нуклеофил порвет и другие связи, последовательно атаковав каждый из атомов фосфора – тогда вся эта красота разлетится на мономерные прозводные фосфорной кислоты. Но если действовать аккуратно, можно ровно двумя нуклеофилами порвать только два мостика – они рвутся легче всего, потому что там есть напряжение в этих циклах. Тогда останется восьмичленный цикл. Довольно давно известно, что если фосфорный ангидрид добавлять к холодной воде очень маленькими порциями и при очень интенсивном перемешивании и охлаждении, не давая температуре подниматься выше 15ºС (если вы когда-нибудь видели, как фосфорный ангидрид реагирует с водой – с шумом, паром, брызгами – а если на бумажку с ангидридом плеснуть водой, она дымится и обугливается, то поймёте, что задача, мягко говоря, непростая), гидролиз рвёт только два кислородных мостика и остаётся восьмичленный цикл, весьма устойчивый в водном растворе – он гидролизуется дальше, но очень медленно. Смотрим внимательно, что получилось – это циклический тетрамер метафосфорной кислоты. 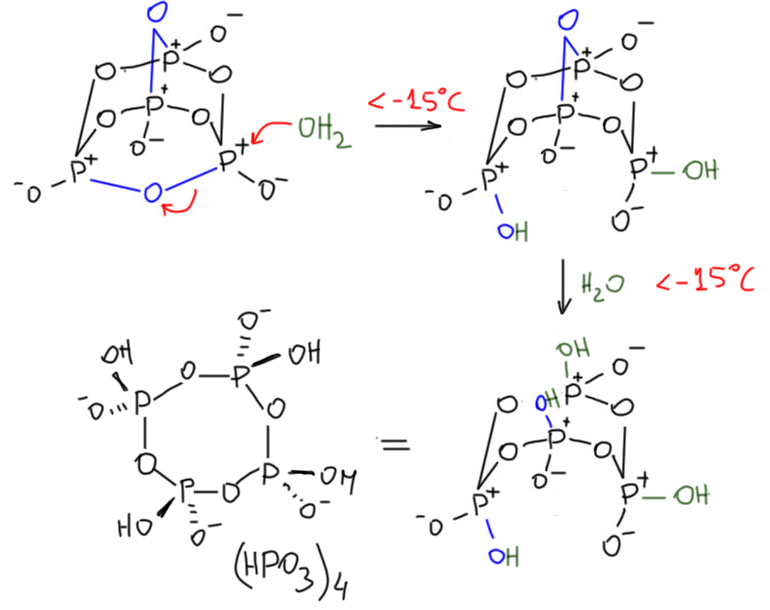 Медленный гидролиз этой молекулы показывает, что в ней больше нет напряжения, и фосфорные остатки обладают невысокой реакционной способностью. Сама молекула, тем не менее, не очень устойчива, выделить эту форму невозможно, она при выделении претерпевает разрыв цикла и полимеризацию. Но аккуратной титрование щелочью дает соль, тетраметафосфат, которую можно выделить в виде кристаллогидрата и хранить. В этих формулах я показываю клинышками и зеброй связи на фосфоре только чтобы обозначить тетраэдрическую конфигурацию – не ищите здесь никаких стереоизомеров, их нет и быть не может, потому что протон подвижен и через водородные связи скачет, куда хочет. Другое дело, если бы там были какие-то более прочно сидящие группы, например, эфирные. Тогда стереохимия может быть, а исследована ли эта проблема в реальности или только, как принято выражаться, ждёт своего исследователя, оставим за скобками. Может это будете вы, а может некто веке в 138-ом.
Медленный гидролиз этой молекулы показывает, что в ней больше нет напряжения, и фосфорные остатки обладают невысокой реакционной способностью. Сама молекула, тем не менее, не очень устойчива, выделить эту форму невозможно, она при выделении претерпевает разрыв цикла и полимеризацию. Но аккуратной титрование щелочью дает соль, тетраметафосфат, которую можно выделить в виде кристаллогидрата и хранить. В этих формулах я показываю клинышками и зеброй связи на фосфоре только чтобы обозначить тетраэдрическую конфигурацию – не ищите здесь никаких стереоизомеров, их нет и быть не может, потому что протон подвижен и через водородные связи скачет, куда хочет. Другое дело, если бы там были какие-то более прочно сидящие группы, например, эфирные. Тогда стереохимия может быть, а исследована ли эта проблема в реальности или только, как принято выражаться, ждёт своего исследователя, оставим за скобками. Может это будете вы, а может некто веке в 138-ом. 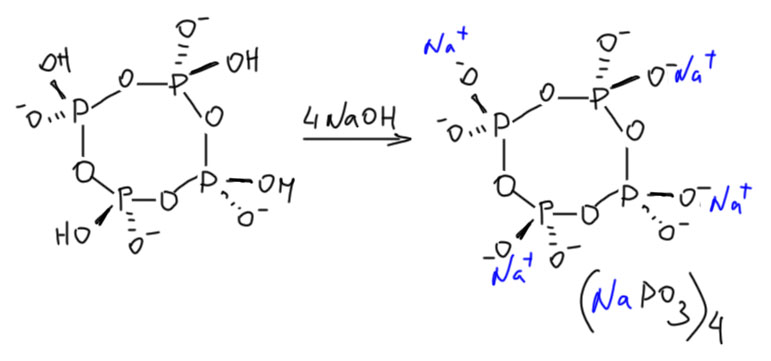
Бывает еще и тримерная метафосфорная кислота, шестичленный цикл, и её соли. Это тоже любопытно, хотя бы потому что и такой цикл тоже существует в виде кресловидных конформеров, прямо как циклогексан, до которого мы ещё не добрались. У органики и неорганики одни законы, а вы как думали?
